Урок " Умови перебігу реакцій обміну за участю солей. Хімічні властивості солей".
Урок хімії у 8 класі:
Тема: Умови перебігу реакцій обміну за участю солей.
Хімічні властивості солей.
Мета: формування уявлення про хімічні властивості солей, про особливості та умови взаємодії солей з кислотами, основами, солями;
Задачі : сформувати уявлення про хімічні властивості солей, про особливості та умови взаємодії солей з кислотами, основами, солями; розвивати вміння складати рівняння реакцій обміну; розвивати пізнавальний інтерес, вміння спостерігати та робити висновки.
Тип уроку: засвоєння нових знань
Форма проведення уроку: урок-дослідження.
Основні терміни та поняття: солі, кислоти, основи, реакція обміну.
Девіз уроку : Дерево науки всім своїм корінням пов'язане з практикою.
.
Просто знати - ще не все, знання треба використовувати.
О. Несмеянов
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності кислот, основ і солей у воді, ряд активності металів, пробірки, залізний цвях, сіль кальцій карбонат, набори хімічних реактивів, мультимедійний проектор, комп’ютер.
Хід уроку
І.Організація класу. Вітання. Створення позитивного емоційного настрою.
Ви знаєте, що хімія-це природнича наука. В процесі її вивчення ви слухали лекції, приймали участь в семінарських заняттях, розв'язували задачі, писали рівняння хімічних реакцій, знайомилися з віртуальними лабораторними дослідами . Хоча, я впевнена, що більшість із Вас хотіли б пограти, помандрувати, побувати в хімічній лабораторії,приймати участь в дослідженнях. Сьогодні на уроці у вас буде така можливість.
II. Актуалізація опорних знань учнів.
1. Проводиться експрес-контроль щодо формування вміння склади рівняння реакцій кислотно-основних взаємодій.
Завдання
Допишіть рівняння реакцій, назвіть продукти реакції:
/ варіант II варіант
а) Zn (OH)2 + H2S04 → а) А1 (ОН)3 + Н3Р04 →
б) КОН + H3S03 → б) Cu(OH)2+HBr →
в) FeO + HCl → в) ZnO + H2SO4 →
г) А1203 + H2S04 → г) Fe203 + HCl →
д) Ca(OH)2+S02 → д)КОН + N205 →
е) NaOH + N205 → е) Ва(ОН)2+С02 →
є) MgO + С02 → є)CaO+S02 →
2. Фронтально:
- Які речовини називають солями? Наведіть приклади.
- Як класифікують солі?
- Охарактеризуйте фізичні властивості солей.
- Яке значення мають солі в народному господарстві?
III. Вивчення нового матеріалу.
1. Мотивація діяльності учнів. Подорож по океану речовин.
Подорож - це завжди захоплююча подія,це нові знання,нові враження. Чи готові ви до цього?
І так країна «Солі» межує і встановила економічні стосунки з країнами «Оксиди», «Основи», «Кислоти», «Метали». Пропоную продовжити подорож по океану речовин і спрогнозувати результати досліджень(планування).
2. Планування результатів дослідження ( що учень повинен знати і пови- нен уміти):
- знає склад, назви, фізичні та хімічні властивості солей ;
- вміє складати відповідні рівняння хімічних реакцій;
- прогнозує перебіг хімічних реакцій солей та кислот із металами, використовуючи ряд активності металів;
- проводить хімічний експеримент з дотриманням правил техніки безпеки;
- спостерігає;
- узагальнює;
- формулює висновки.
А чого чекаєте ви від цієї подорожі?
3.Постановка проблемних питань.
Під час подорожі по океану речовин ми вивчили властивості оксидів,кислот,основ і за результатами наших досліджень ми склали таблицю взаємодії класів неорганічних сполук. Проаналізуйте її.
|
|
Основний оксид |
Кислота |
Основа |
Сіль |
|
Кислотний оксид |
+ |
- |
+ |
- |
|
Кислота |
+ |
- |
+ |
+ |
|
Основа |
- |
+ |
- |
+ |
|
Сіль |
- |
+ |
+ |
? |
Солі взаємодіють з кислотами та основами.
-А чи завжди можливі ці реакції?
- А чи взаємодіють солі з солями?
- Які стосунки у країни «Солі» з країною «Метали»?
-Що відбувається з солями при нагріванні?
Відповіді на ці проблемні питання ви зможете дати, коли дослідите властивості солей під час подорожі, тема якої «Хімічні властивості солей».
Метою подорожі є дослідження і вивчення хімічних властивостей солей засобами хімічного експерименту, вміння його виконати і теоретично обґрунтувати, зробити висновки і узагальнення.
Але перед дослідженням треба пригадати правила техніки безпеки при роботі в кабінеті хімії. Перед проведенням досліду згадаємо правила техніки безпеки.
Лабораторний дослід . Робота в зошитах.
Тема. Взаємодія солей з металами.
СuSO4 + Fе = FeSO4 + Сu↓
СuSO4 + Zn = ZnSO4 + Си↓
Висновок: Взаємодія між солями і металами відбувається при умові, якщо метал активніший ніж той, що у складі солі.
Лабораторний дослід . Робота в зошитах.
Тема. Взаємодія солей з лугами.
FеСl3 + 3NаОН = Fе(ОН)3 ↓+ 3NaС1
Na2SO4+ Ва(ОН)2 =ВаSO4 ↓+ 2NаОН
Висновок: Розчини солей реагують з лугами з утворенням нової солі і нової основи. Реакції пройшли до кінця, бо випав осад.
Лабораторний дослід . Робота в зошитах.
Тема. Реакція обміну між двома солями.
I пробірка Nа2СO3 + Ва(NO3)2 = ВаСОз↓+2NaNO3
II пробірка Na2СO3 + ZnС12 = ZnСO3↓+ 2NaС1
Висновок: солі реагують між собою, реакція йде до кінця, коли випадає осад.
IV. Закріплення вивченого матеріалу.
Учні розігрують казку "Випадок в країні "Хімія".
V. Підсумок уроку.
1. Солі взаємодіють з металами, солями, лугами та кислотами.
2. Для солей характерні реакції заміщення з простими речовинами, з металами та обміну солей зі складними речовинами.
3. Рефлексія і виставлення оцінок учням, що відповідали. Інтерактивна вправа «Очікування»
Підводиться підсумок стосовно того, чи реалізувалися бажання учнів вивчити чи почути щось нове на уроці,чи виправдались їх сподівання, чи комфортно почували себе під час роботи на уроці.
Вчитель: «Дякую всім учасникам подорожі. Ви всі були активними мандрівниками і компетентними дослідниками, толерантними співбесідниками . Сподіваюся, що знання, вміння, отримані сьогодні, знадобляться вам в житті. І на завершення хочу звернутися до вас словами російського письменника М. Горького: «…якомога уважніше вивчайте хімію! Це дивна наука, знайте!...ЇЇ пронизливий сміливий погляд проникає й у пітьму земної кори ,і в невідомі частинки вашого серця, і в таємниці будови каменю, і в безмовне життя дерев. Вона дивиться всюди і, скрізь відкриваючи гармонію, завзято шукає початок життя». То ж успіхів вам у вивченні цієї чарівної та дивовижної науки!
VI. Домашнє завдання.
Д/з: § 19 повторити.
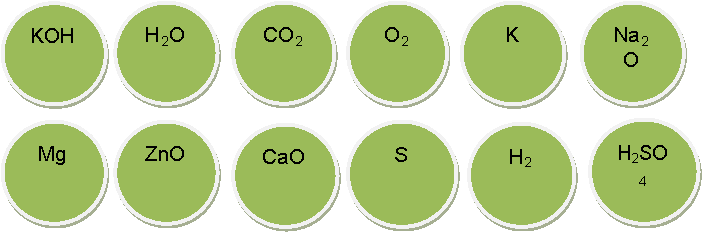
Хімічні шашки (диференційоване завдання).
Кожен мандрівник, повертаючись із подорожі, бере на згадку сувенір. Таким сувеніром будуть для вас хімічні шашки, які я виготовила для вас. Правила гри такі ж, як і в звичайних шашках, але на шашках написані формули простих і складних речовин. Перед тим, як зробити відповідний хід, необхідно записати рівняння можливих хімічних реакцій між речовинами, які написані на шашках.
Середній рівень. Написати 4,5,6 рівнянь хімічних реакцій з утворенням любих класів неорганічних сполук.
Достатній і високий рівень. Написати від 7 до 12 рівнянь хімічних реакцій. Обов'язкова умова: в результаті реакції утворюється сіль
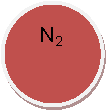
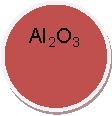
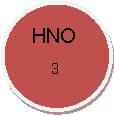
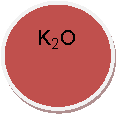
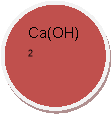
КОН, Н2O, СO2, O2, К, Nа2O, Мg, ZпО, СаО, S, Н2, Н2S04,
ВаС12, НС1, Са, Н3РO4, N2, Р2O5,Са(OН)2, К2O, HNO3,СиO,МgO,А12O3

 Хімічні шашки
Хімічні шашки







Додаток
Випадок у країні "Хімія "
Засперечались якось кислоти та солі: "От, - кажуть кислоти, - у нас стільки достоїнств, нас так багато, ми такі різні, що поділяємося на кисневмісні і безкисневі. Ми також відрізняємось за основністю, крім того ми навіть викликаєм страх. Індикатори з переляку змінюють свій колір, потрапляючи в наше середовище. Ось наша H2S04, за прізвиськом "сульфатна", змінює колір лакмусу на червоний, метилоранж - на рожевий, а нещасний фенолфталеїн взагалі не подає жодних ознак своєї присутності в ній".
"Ну, то й що? - заперечували солі. - Не штука , перелякати бідних індикаторів. Ось ми, товаристські, охоче маємо справи з металами, лугами, іншими солями. Із задоволенням спілкувалися з вами кислотами до сьогоднішнього дня".
"Не віримо! - кричали кислоти. - Хто ви взагалі такі? Доведіть, що також реагуєте з металами!"
"Відповідаємо на перше запитання. Ми - солі-речовини, що складаються з атомів металів та кислотних залишків. Але, кажучи про метали, треба врахувати, що не всі вони реагують з нами, а тільки ті, що займають почесне місце у витискувальному ряді металів і розміщуються лівіше від того металу, що входить до нашого складу.
Ну, наприклад, запросимо купрум (II) сульфат прореагувати зі залізом."
CuS04 підійшов до дошки і гордовитим виглядом написав усе, що він думає про залізо. "І ось що ми маємо: Fe+CuS04 → FeS04+Cu. Будь ласка!"
"Ну, і що! - пробурмотіли кислоти. - І це все, що нас об'єднує! А як же ви реагуєте з нами?"
Солі порадилися між собою, і з їх натовпу вийшов кальцій карбонат і підійшов до хлоридної кислоти.
"Чи не бачите ви, пані, настільки ласкаві, щоб обмінятися зі мною своєю складовою частиною, щоб показати, що кислоти не зовсім праві у своїй ворожнечі до нас?"
Хлоридна кислота погодилася, і вони разом написали на дошці: СаСОз+НСІ → СаС12+Н20+С02.
Потім карбонат дбайливо поставив коефіцієнт 2 перед НС1:
СаС03+2НС1 → СаС12+Н20+С02.
"Проте, - вже не так впевнено продовжували кислоти, - деякі з вас, наприклад, магній хлорид та цинк хлорид, повинні бути вдячні нам, кислотам, і зокрема хлоридній, за те, що взагалі з'явилися на світ. Ми це можемо довести. Пані хлоридна кислота, просимо ще раз взяти участь у дискусії". На дошці з'явилися два нових рівняння:
Mg+2HC1 → MgCl2+H2 ↑;
Zn+2HC1 → ZnCl2+H2 ↑.
"Отже, - продовжували кислоти, - якщо випарувати добуті розчини, тоді можна відокремити білі кристалічні речовини, вас - MgCl2 та ZnCl2".
""Згодні, згодні! - закивали солі. - але навіщо ворогувати? У країні „Хімії” знайдеться місце для всіх. Давайте помиримося і будемо знову спілкуватися!
Але для того щоб дружити з нами, ви повинні пам’ятати деякі важливі умови. Реакція відбувається, коли, по-перше, утворюється осад, що не розчиняється вами, по-друге, коли кислота реагент сильніша за ту, якою утворена сіль, по-третє, коли сіль утворена леткою кислотою, а кислота, що реагує, - нелетка."
Зраділи кислоти, погодилися з усіма умовами, бо хоч і ходили з „кислотами” обличчями, таки були миролюбними. Після цього кислоти і солі по-дружньому потиснули одне одному руки.


про публікацію авторської розробки
Додати розробку
