Урок узагальнення і систематизації знань із підтеми "Вуглеводні" теми "Найважливіші органічні сполуки" (9 клас)
9 клас
Тема: Узагальнення й систематизація знань із підтеми «Вуглеводні» теми «Найважливіші органічні сполуки».
Мета: узагальнити й систематизувати знання учнів про насичені та ненасичені вуглеводні, їх хімічні властивості, застосування; показати зв’язок будови, властивостей і застосування вуглеводнів на прикладі алканів, алкенів і алкінів; узагальнити та скоригувати знання учнів з теми «Вуглеводні»; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці; розвивати нестандартне мислення, показати значимість хімічних знань для сучасної людини; виховувати прагнення до підвищення особистих знань, виховувати чесність і принциповість (взаємоконтроль).
Предметні компетенції: наводити приклади гомологів метану, складати молекулярні і структурні формули метану та перших десяти його гомологів, етену, етину, уміння пояснювати реакції горіння органічних речовин, заміщення для метану, приєднання для етену й етину, порівнювати насичені й ненасичені веглеводні.
Ключові компетенції : спілкування державною мовою (уміння використовувати в письмовому мовленні хімічні терміни, поняття, символи, сучасну українську наукову термінологію і номенклатуру), основні компетентності у природничих науках і технологіях (уміння визначати проблеми довкілля, пропонувати способи їх розв'язування), інформаційно-цифрова компетентність (уміння використовувати сучасні пристрої для добору хімічної інформації, її оброблення, збереження і передавання), екологічна грамотність і здорове життя (уміння усвідомлювати причинно-наслідкові зв'язки у природі та їі цілісність), соціальна та громадянська компетентності (уміння співпрацювати з іншими ).
Тип уроку: узагальнення й систематизації знань, умінь і навичок
із використанням ІКТ.
Форма проведення: урок – гра.
Методи навчання: словесні, репродуктивні, частково пошукові, практичні (виконання вправ), інтерактивні методи навчання: робота у групах, ігри, метод проектів.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, комп’ютер, мультимедійний проектор, чорний ящик, гумові рукавички, свічка, моделі молекул вуглеводнів, зошит, картки-завдання.
Структура уроку:
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань. (1 хв)
Мотивація навчальної діяльності
ІІІ. Ознайомлення з умовами гри (1 хв)
ІV. Узагальнення й систематизація знань про вуглеводні (40 хв)
V. Підбиття підсумків уроку (3 хв)
VІ. Домашнє завдання
Хід уроку
І. Організація класу
Привітання, доповідь чергових. Налаштування учнів на робочий настрій
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань. (1 хв)
Мотивація навчальної діяльності
(Слайд 3)
Один із загальновідомих,
Кістяк органічних сполук,
Цеглинка, фундамент, основа
Для всіх природничих наук.
Карбон «С»
Учитель . Сьогодні ми з вами узагальнимо ті знання, які здобули під час вивчення насичених та ненасичених вуглеводнів.
Завдання, які ви будете сьогодні виконувати, покажуть, наскільки ви засвоїли навчальний матеріал, вмієте його застосовувати.
Сьогодні ви покажете свою ерудицію, ораторську майстерність, вміння працювати індивідуально, в групах, знаходити правильне рішення
Успіхів вам.
ІІІ. Ознайомлення з умовами гри (Слайд 4) (1 хв)
У грі беруть участь дві команди. Гра складається з десяти турів.
Вам належить пройти:
- Конкурс «Домашнє завдання»
- Конкурс «Розминка»
- Хімічний диктант
- Конкурс "Історична довідка"
- Конкурс «Теоретиків»
- Грати в гру «Хімічне лото», розібратися при цьому в темі «Гомологічні ряди вуглеводнів»
- Конкурс «Хімічні лінгвісти» (показати знання номенклатури вуглеводнів )
- Конкурс «Чорна скринька».
- Конкурс «Конструктор» (скласти моделі молекул вуглеводнів)
- Пройти випробування бліц турніром - «Розженемо хмари» , показавши високий рівень теоретичної підготовки
Оцінювати вашу роботу будуть наші гості. Якщо робота виконується в групі, то в колбу, яка є на кожному столі будуть опускати карточку відповідного кольору.
Червона – вищий рівень
Зелена – достатній
Жовта – середній.
Сьогодні ви будете працювати парами, групами та індивідуально.
Девіз уроку: (Слайд 5)
«Мало знати, треба і застосовувати. Мало хотіти, треба і робити »
Ґе́те
ІV. Узагальнення й систематизація знань про вуглеводні
Для організації роботи на уроці учні об’єднуються в дві групи.
- Конкурс «Домашнє завдання» . (6 хв)
Запрошую представника команди для захисту презентації по темі:
1. «Алкани. Алкени. Алкіни», (Слайд 6)
2. «Застосування полімерів» .
- Конкурс «Розминка». (Слайд 7) (5хв)
Гра «Так чи ні»
|
1 |
Органічна хімія — це спеціальний розділ хімії, який вивчає речовини, що отримані з організмів |
-- |
|
2 |
До складу органічних речовин обов'язково входить Карбон |
+ |
|
3 |
Карбон в органічних сполуках завжди чотиривалентний |
+ |
|
4 |
До елементів-органогеиів належать Карбон, Гідроген, Оксиген, Кальцій, Натрій, Магній, Сульфур і Хлор |
--
- |
|
|
|
|
|
5 |
У молекулах органічних сполук зв'язки переважно йонні та ковалентні сильнополярні. |
-- - |
|
6 |
Хімічна будова — це послідовність з'єднання атомів відповідно до їхньої валентності в молекулах |
+ |
|
7 |
Органічні речовини мають молекулярну будову |
+ |
|
8 |
Структурні формули можуть мати кратні зв’язки подвійні або потрійні |
+ |
|
9 |
При повному спалюванні органічних речовин утворюються вуглекислий газ і вода |
+ |
|
10 |
Гомологи — це сполуки одного класу, що мають подібну будову й не відрізняються за складом |
— |
|
11 |
В атомі Карбону в збудженому стані міститься 2 неспарених електрони |
— |
|
12 |
Атоми Карбону здатні утворювати між собою міцні хімічні зв'язки і з'єднуватися в досить довгі ланцюжки або цикли |
+ |
Тестова перевірка знань. (Слайд 8,9,10)
(колективне розв’язання тестів на мультимедійній дошці)
І команда
1. Вкажіть суфікс, що використовується в назвах етиленових вуглеводнів:
а) -ан;
б) -ін;
в) -ен;
г) –ол
2. Вкажіть зв’язок між атомами Карбону у молекулі ацетилену:
а) одинарний;
б) подвійний;
в) два подвійні;
г) потрійний
3. У якій речовині є кратні зв’язки?
а) метан;
б) пропан;
в) ацетилен;
г) бутан
4. До якого типу реакцій належить відноситься реакція ацетилену з воднем ?
а) обміну;
б) заміщення;
в) приєднання;
г) розкладу
5. Формула ацетилену:
а) С2Н6;
б) С2Н4;
в) С2Н2;
г) С6Н6.
ІІ команда
1. Яка загальна формула ацетиленових вуглеводнів ?
а) СnH2n-2;
б) СnH2n+2;
в) СnH2n+4;
г) СnH2n
2. Вкажіть мономер, що використовується для добування поліетилену:
а) пропен;
б) метан;
в) етан;
г) етен
3. Яка загальна формула етиленових вуглеводнів?
а) СnH2n-2
б) СnH2n+2
в) СnH2n+4
г) СnH2n
4. На першій стадії приєднання водню до ацетилену утворюється:
а) пропен;
б) етан;
в) етилен;
г)пропан
5. Яка речовина належить до алкенів:
а) С5Н12;
б) С5Н10;
в) С5Н8;
г) С5Н6
3. Хімічний диктант теми: «Алкани» , «Алкени», «Алкіни». (Слайд 12,13) (4 хв)
1. Вуглеводні — сполуки, що складаються з атомів ... і ... . ( С і Н)
2. За сучасною українською номенклатурою насичені вуглеводні називають . . . (Алкани)
3. В усіх органічних речовинах валентність атомів С становить ... (4)
4. Найпростіший представник алканів .... (СН4 метан)
5. Загальна формула алкенів ... . (СnH2n)
6. Найпоширенішим представником алкенів є ..( етилен С2Н4).
7. Реакція приєднання водню називається ... .(Гідрування)
8. Загальна формула алкінів …( СnH2n-2)
9. Перший представник гомологічного ряду алкінів — .... ( ацетилен С2Н2)
10. Реакції приєднання для алкінів відбуваються у ... стадії (2)
11. У молекулі етилену, на відміну від молекули ацетилену, є … (подвійний звязок)
12. В молекулах алкінів валентні кути дорівнюють: ( 180 ̊ ) (ВЗАЄМОПЕРЕВІРКА)
4. Конкурс "Історична довідка". (Слайд 14,15) (2 хв)
Зараз я роздам кожній групі картки з двома тестовими питаннями, і та команда, яка швидше за всіх відповість на питання, отримає можливість першими озвучити відповіді і отримати по 6 балів за питання, а інша команда отримає по 5 балів за питання.
1. Поняття "Органічна хімія" вперше ввів
а) Бутлеров А.М.
б) Берцеліус
в) Велер
г) Вюрц
2. Творець теорії хімічної будови органічних сполук
а) Марковников В.В.
б) Бутлеров А.М.
в) Менделєєв Д.І.
г) Кучеров М.Г.
1. Теорія хімічної будови органічних сполук була створена в
а) 1865р
б) 1869р
в) 1870р
г) 1861р
2. Вчений, перший отримав в лабораторії органічну речовину з неорганічних речовин - це
а) Бутлеров А.М.
б) Кекуле
в) Велер
г) Берцеліус
5. Конкурс «Теоретиків» (Слайд 16,17) (4 хв)
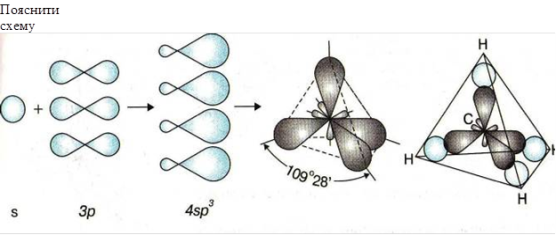
Відео запитання. На екрані без звуку показується відео фрагмент якісної реакції на ненасичені вуглеводні і учні повинні здогадатися, що це за експеримент. (Слайд 18)
6. Конкурс «Хімічне лото» (Слайд 19,20,21) (3 хв)
Учні класу виконують завдання «Хімічне лото». Вони розподіляють сполуки по гомологічним рядам та називають їх (завдання виконують на окремих аркушах).
Команда 1 (Алкани), Команда 2 (Алкени)
|
Алкани CnH2n+2 |
Алкени СnH2n |
Алкіни CnH2n-2 |
|
CH4 |
C2H4 |
C2H2 |
|
C6H14 |
C5H10 |
C7H12 |
|
C3H8 |
C3H6 |
C3H4 |
|
C10H22 |
C4H8 |
C10H18 |
|
C7H16 |
C10H20 |
C5H8 |
|
C4H10 |
C8H16 |
C4H6 |
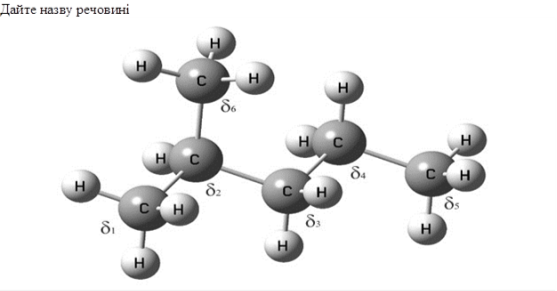
7. Конкурс «Хімічні лінгвісти» (Слайд 22,23,24) (4 хв)
Конкурс на знання номенклатури вуглеводнів. Команди отримують картки зі структурними формулами вуглеводнів. Потрібно дати їм назви (2 бали за правильну назву вуглеводню).
Давайте згадаємо алгоритм дій.
1. Знаходимо довгий ланцюг.
2. Визначаємо радикали.
3. Даємо назву.
Команда 1
|
1. СН3 – СН – СН2 – СН2 — СН3 ׀ СН3 |
2-метилпентан |
|
2. СН3 ׀ СН3 – С – СН – СН3 ׀ ׀ СН3 СН3 |
2,2,3-триметилбутан |
|
СН3 СН3 ׀ ׀ 3. СН2 – СН – СН2 |
2-метилбутан |
׀ С2Н5
|
3-етилпентан |
|
5. Н2С = СН2
|
Етилен (етен) |
|
СН3 ׀ 6. СН3 – СН2 – СН2 – СН – СН2 ׀ СН3 |
2,2-диметилпентан (4,4- диметилпентан) |
Команда 2
|
1. СН3 ׀ СН3 – СН– СН3
|
2-метилпропан |
|
2. СН3 – СН2 – СН2 – СН2 – СН2 –СН3
|
гексан |
|
5. СН3 – СН – СН – СН3 ׀ ׀ СН3 СН3 |
2,3-диметилбутан |
|
СН3 ׀ 4. СН3 – С – СН3 ׀ СН3 |
2,2 - диметилпропан |
|
СН3 ׀ 5. СН2 - СН2 ׀ СН3 |
бутан |
|
6. СН3 – СН – СН2 – СН – СН2 -СН3 ׀ ׀ СН3 СН3 |
2,4-диметилгексан |
8. Конкурс «Чорна скринька». (Слайд 25,26) (3 хв)
Вислухавши коментарі, учні повинні вгадати предмет у скриньці і детально обґрунтувати відповідь.
1. Речовина, з якого виготовлено це виріб, було завезено до Європи відомим мореплавцем. У далекому минулому його отримували з тропічних рослин, а з 1932 року стали отримувати штучно. Без цього виробу жоден хірург не встане за операційний стіл. (В скриньці гумові рукавички).
2. Матеріал, з якого виготовлено це виріб, - суміш вищих насичених вуглеводнів, що плавляться при температурі 40-65 ° С. Отримують його переробкою нафти. Застосовується в медицині, у виробництві сірників, а також як компонент мастил. (В скринці свічка).
9 . Конкурс «Конструктор» (Слайд 27) (3 хв)
За допомогою пластиліну і сірників зліпити моделі наступних речовин:
1-ша команда – бутану, 2-га команда – пропану
10. Бліц турнір «Розженемо хмари» (Слайд 28) (2 хв)
С6Н12 гексен
- СН3 метил
С2Н2 ацетилен або етин
С5Н12 пентан
С3Н6 пропен
С2Н4 етилен або етен
СН4 метан
- С2Н5 етил
С8Н18 октан
С10Н22 декан
С7Н16 гептан
С5Н8 пентін
СН2 = СН2 етилен
С6Н14 гексан
V. Підбиття підсумків уроку (Слайд 29) (3 хв)
Вправа «Резюме»
- Які завдання виконані на уроці ви вважаєте найцікавіші?
- Які завдання ви вважаєте занадто складними?
Підбиття підсумків роботи груп, оцінювання роботи учнів на уроці.
Заключне слово вчителя.
Сьогодні на уроці ви застосовували раніше здобуті знання, оволоділи новими знаннями та практичними навичками. І все це через діяльність, через вашу працю.
Б.Шоу сказав: «Єдиний шлях, який веде до знань - це праця». (Слайд 31)
«Без повсякденної працьовитості нема ні геніїв, ні талантів», - говорив Д.Менделєєв.
Працюйте й будьте щасливі!
VІ. Домашнє завдання
Повторити матеріал про вуглеводні.
|
Алкани CnH2n+2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкени CnH2n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Команда 1
|
1. СН3 – СН – СН2 – СН2 — СН3 ׀ СН3 |
|
|
2. СН3 ׀ СН3 – С – СН – СН3 ׀ ׀ СН3 СН3 |
|
|
СН3 СН3 ׀ ׀ 3. СН2 – СН – СН2 |
|
|
4. СН3 – СН2 – СН – СН2 - СН3 ׀ С2Н5
|
|
|
5. Н2С = СН2
|
|
|
СН3 ׀ 6. СН3 – СН2 – СН2 – СН – СН2 ׀ СН3 |
|
Команда 2
|
1. СН3 ׀ СН3 – СН– СН3
|
|
|
2. СН3 – СН2 – СН2 – СН2 – СН2 –СН3
|
|
|
5. СН3 – СН – СН – СН3 ׀ ׀ СН3 СН3 |
|
|
СН3 ׀ 4. СН3 – С – СН3 ׀ СН3 |
|
|
СН3 ׀ 5. СН2 - СН2 ׀ СН3 |
|
|
6. СН3 – СН – СН2 – СН – СН2 -СН3 ׀ ׀ СН3 СН3 |
|
|
Команда 1
П.І. членів команди: |
Конкурс «Домашнє завдання»
Разом - 12 |
Конкурс «Розминка» 1 правильна відповідь.-2 б. Для команди всі правильні відповіді – 10 б. |
Хімічний диктант
12 запитань Взаємо- перевірка Разом - 12 |
Конкурс "Історична довідка"
2 запит.- по 6 б. Разом - 12 |
Конкурс «Теоретиків»
1 запитання – 12 б.
Разом - 12 |
Гра «Хімічне лото», правильна відповідь.-2 б. Разом - 12 |
Конкурс «Хімічні лінгвісти» правильна відповідь.-2 б. Разом - 12 |
Конкурс «Чорна скринька». правильна відповідь.-12 б. Разом - 12 |
Конкурс «Конструктор»
(На швидкість) 12 б.
Разом - 12 |
Бліц турнір - «Розженемо хмари»
Разом - 12 |
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оцінювання команди:
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Команда 2
П.І. членів команди: |
Конкурс «Домашнє завдання»
Разом - 12 |
Конкурс «Розминка» 1 правильна відповідь.-2 б. Для команди всі правильні відповіді – 10 б. |
Хімічний диктант
12 запитань Взаємо- перевірка Разом - 12 |
Конкурс "Історична довідка" 2 запит.- по 6 б.
Разом - 12 |
Конкурс «Теоретиків» 1 запитання – 12 б.
Разом - 12 |
Гра «Хімічне лото», правильна відповідь.-2 б. Разом - 12 |
Конкурс «Хімічні лінгвісти» правильна відповідь.-2 б. Разом - 12 |
Конкурс «Чорна скринька». правильна відповідь.-12 б. Разом - 12 |
Конкурс «Конструктор»
(На швидкість) 12 б.
Разом - 12 |
Бліц турнір - «Розженемо хмари»
Разом - 12 |
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оцінювання команди:
Разом ______ б. |
|
|
|
|
|
|
|
|
|
|


про публікацію авторської розробки
Додати розробку
