Урок узагальнення знань з теми «Кількість речовини. Розрахунки за хімічними формулами».
|
Тема |
Урок узагальнення знань з теми «Кількість речовини. Розрахунки за хімічними формулами». |
|
Мета |
|
|
Обладнання |
Періодична система хімічних елементів Д.І.Менделєєва, картки із завданнями. |
|
Тип уроку |
Узагальнення та систематизації знань, умінь і навичок. |
|
Форми й методи |
Фронтальне опитування за методикою «Бумерангу», інтерактивний метод «Навчаючи вчусь», «Рефлексія», гра «Склади пару» |
Структура уроку
- Організаційний етап
- Мотивація пізнавальної діяльності
- Актуалізація опорних знань
- Узагальнення й систематизація знань
- Домашнє завдання
- Підбиття підсумків уроку
ХІД УРОКУ
- ОРГАНІЗАЦІЙНИЙ ЕТАП
- МОТИВАЦІЯ ПІЗНАВАЛЬНОЇ ДІЯЛЬНОСТІ
Ми з вами закінчили тему «Кількість речовини. Розрахунки за хімічними формулами» і сьогодні повинні узагальнити та систематизувати наші знання, підготуватись до тематичної атестації.
III. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Фронтальне опитування – у вигляді взаємоопитування учнів за методикою «Бумерангу», учні один одному «пускають» запитання, які на дошці записує учитель.
Запитання:
- Що таке кількість речовини?
- Яка формула визначення кількості речовини?
- Що таке молярна маса?
- Що таке молярний об‘єм?
- Що таке відносна густина газів?
IV. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Інтерактивний метод «НАВЧАЮЧИ ВЧУСЬ»
- група учнів отримують картку із задачею, яку опрацьовують;
- один учень виходить до дошки і пояснює всім, як розв‘язувати задачу так, щоб запам‘ятали інші.
- Група: Обчисліть кількість речовини атомів Гідрогену, що містяться в 0,7 моль ортофосфатної кислоти (Н3РО4).
- Група: Скільки молекул міститься в вуглекислому газі (СО2) об’ємом 112 л (н.у.)?
3 Група: В якій кількості речовини озону (О3) міститься 1,5025∙1023 атомів Оксигену?
4 Група: Відносна густина деякого газу за амоніаком (NH3) дорівнює 2,588. Обчисліть відносну густину цього газу за гелієм (Не).
5 Група: Маса 3 л деякого газу (н.у.) дорівнює 4,29 г. Визначте молярну масу цього газу.
6 Група: Обчисліть масу 16 л амоніаку (NH3).
7 Група: Обчисліть об‘єм 444,5 г хлору (Cl2).
«СКЛАДИ ПАРУ»
- учні отримують картки з структурними формулами і молекулярними формулами речовин – необхідно встановити відповідність;
Молекулярні формули: Структурні формули:
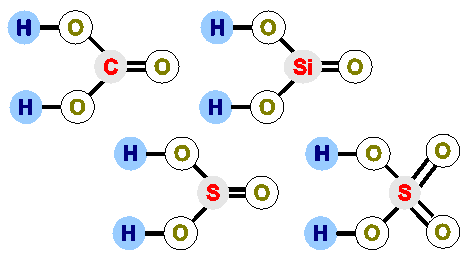
H2SO4
H2SO3
H2SiO3
H2CO3
- картки з формулами речовин і їх молярними масами – встановити відповідність;
Картка № 1.
|
Формула речовини: H3PO4 H2SO3 H2SiO3 H2CO3 |
Молярна маса: 78 98 62 82 |
Картка №2
|
Формула речовини: P2O5 SiO2 N2O5 NO |
Молярна маса: 30 60 142 108 |
Картка №3
|
Молярна маса 80 40 162,5 133,5 |
Формула речовини AlCl3 FeCl3 MgO CuO |
Картка №4
|
Молярна маса 59 188 40 78 |
Формула речовини Al(OH)3 Cu(NO3)2 NaOH Ca(OH)2 |
- картки з формулами і відносною густиною за воднем – встановити відповідність.
Картка № 1.
|
Формула речовини СО СО2 SO2 SO3 |
Відносна густина за воднем 14 40 22 32 |
Картка №2
|
Формула речовини О2 H2S NO2 N2O |
Відносна густина за воднем 17 16 23 22 |
Картка № 3
|
Відносна густина за воднем 16 15 14 8.5 |
формула речовини
N2 NH3 NO O2 |
Результати записують в зошит.
V. ДОМАШНЄ ЗАВДАННЯ
- Повторити § 19-22.
- Виконати завдання № 168, 169.
- Підготуватися до тематичного оцінювання.
VI. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Рефлексія:
- Як ви вважаєте, чи розглянули ми всі питання?
- Які труднощі виникли під час роботи?
- Яка частина уроку вам сподобалася більше?


про публікацію авторської розробки
Додати розробку
