Урок "Відносна густина газів"
Тема: Відносна густина газів.Обчислення відносної густини газів.
Мета:
- Вивести із закону Авогадро формулу для визначення відносної густини газів; розкрити суть поняття «відносна густина газів»; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною;
- розвивати вміння висловлювати свою думку, робити висновки. розвивати пізнавальний інтерес, логічне мислення;
- виховувати творчу , допитливу особистість, почуття гідності, бережливості, вміння працювати в колективі, взаємодопомогу;виховувати толерантність у спілкуванні.
Тип уроку: засвоєння нових знань.
Хід уроку.
I. Організаційна частина.
II. Актуалізація опорних знань.
Хімічний диктант.
1. Асоцыативне поняття щодо кількісті речовини…
2. Молярна маса − це маса…
3. Молярна маса чисельно дорівнює …
4. Молярна маса виражається в …
5. В 1 молі міститься … атомів або молекул.
6. Стола Авогадро позначається ….
7. Молярний об’єм газу дорівнює…
8. В рівних об’ємах різних газів за однакових умов міститься … .
III. Мотивація навчальної діяльності.
Відеоперегляд.
В Італії, в укосі однієї з гір вулканічної місцевості, є печера, яка відома всьому світові під назвою «Собача печера». Люди відвідують її без будь-якого ризику для свого життя. Собака ж та інші низькорослі тварини в печері не можуть дихати і гинуть, якщо їх не вивисти на свіже повітря.
Чому таке відбувається?
Вулканічний грунт місцевості, де знаходиться печера, постійно виділяє вуглекислий газ, який внаслідок своєї ваги збирається внизу печери, утворюючи шар висотою 80 см.
Отже, людина почуває себе в печері нормально, а собака гине.
Чому CO2 збирається внизу а не піднімається вверх?
Проблема: чи можна, маючи по 1 моль SO3 , CO2 , NH3 , CH4, сказати, який з цих
газів легший чи важчий за повітря, кисень та водень?
Кулька з яким газом і на якій відстані від землі (умовно) буде розташована у повітрі (намалювати у вигляді кульок): гелій, азот, вуглекислий газ, повітря, метан, чадний газ, кисень, водень?
Укажіть число, що відповідає молярній масі повітря:
А)6,02•1023 Б) 22,4 л/моль В) 29 г/моль Г) 44,8 л.
Це ми попробуємо з’ясувати сьогодні на уроці.
Величина, яка показує у скільки разів один газ легший чи важчий відносно іншого називається відносною густиною газу.
D = M1/M2,
---- Якщо ми говоримо про густину то давайте пригадаємо, що таке густина?
---- Запишіть формулу, як знайти густину?
---- Як знайти густину 1 моль газу?
--- Давайте порівняємо густини двох різних газів кількістю речовини 1 моль за н. у.
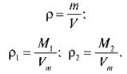 Тоді співвідношення густин:
Тоді співвідношення густин:
![]()
Таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
D = M1/M2,
IV. Закріплення вивченого матеріалу
Керована практика
На початку уроку ми поставили перед собою проблему, який із газів легший чи важчий за повітря,кисень і водень. Давайте це з’ясуємо.
Задача 1
Обчисліть відносну густину карбон(ІV) оксиду за киснем.
Розв’язання
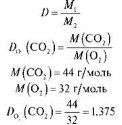
Відповідь: 1,375.
Задача 2
Варіант – 1
Обчисліть відносну густину сульфур(VІ) оксиду SO3 за воднем Н2.
Варіант – 2
Обчисліть відносну густину амоніаку NH3 за киснем О2.
Варіант – 3
Обчисліть відносну густину метану CH4 за воднем Н2.
Задача 3
Густина невідомого оксиду Нітрогену за воднем дорівнює 38. Обчисліть молярну масу цього оксиду, визначте його формулу.
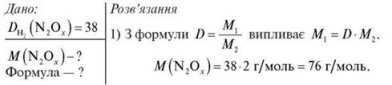
2) Визначаємо формулу. Складаємо рівняння:
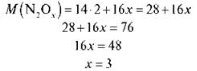
Відповідь: N2O3; M (N2O3) =76г/моль.
Учні заповнюють таблицю. Використовується прийом «Естафета»
|
варіант |
формула газу |
n,моль |
M, г/моль |
V, л |
N |
D |
|
|
за воднем |
за повітрям |
||||||
|
1 |
H2S |
0,7 |
|
|
|
|
|
|
2 |
CH4 |
2,5 |
|
|
|
|
|
|
3 |
Cl2 |
0,1 |
|
|
|
|
|
Практичне застосування: створити невеличкий проект щодо відомих галузях застосування знань про відносну густину газів:
-аеростати
-пожежі
-святкові кульки
-піротехнічні засоби на основі газів
-небезпечні та отруйні гази
-природні гази(печери, болото, родовища)
V. Підбиття підсумків уроку
Вправа «мікрофон»
- Сьогодні я дізнався (-лась) …
- Було цікаво …
- Я зрозумів (-ла) що …
- Я навчився (-лась) …
- Мене здивувало…
- Тепер я можу…
VІ. Домашнє завдання
Опрацювати параграф підручника.
Тема. Відносна густина газів
Мета:
- Розкрити суть поняття «відносна густина газів»; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків.
Обладнання та реактиви: презентація, періодична система хімічних елементів Д. І. Менделєєва, роздаткові картки з завданнями терези, колба об’ємом 0,250 мл із пробкою, установка для одержання кисню.
Базові поняття та терміни:
молярна маса, маса, молярний об’єм , нормальні умови,густина,об’єм.
Тип уроку: засвоєння нових знань.
Хід уроку
І. Організаційний момент
ІІ. Актуалізація опорних знань
учнів. Перевірка домашнього завдання
1. Звіряємо відповіді в задачах, коментуємо, відповідаємо на запитання учнів.
2. Заповнюємо таблицю на дошці й у зошитах, проводячи розрахунки усно (умови нормальні).
Формули для розрахунку записуємо на дошці:
n = V/Vm, n=m/M
|
Формула газу |
Кількість речовини |
Молярна маса |
Маса |
Об’єм |
|
N2 |
1 моль |
28 г/моль |
28 г |
22,4 л |
|
O2 |
0,5 моль |
32 г/моль |
16 г |
11,2л |
|
H2 |
1 моль |
2 г/моль |
2 г |
22,4 л |
|
CO2 |
2 моль |
44 г/моль |
88 г |
44,8 л |
|
CH4 |
2 моль |
16 г/моль |
32 г |
44,8 л |
|
NH3 |
0,5 моль |
17 г/моль |
8,5 г |
11,2л |
Яким законом ми скористалися, щоб обчислити об'єм газів
III.Мотиваціянавчальноїдіяльності Відеоролик, проблемна ситуація, задачі
IV. Вивчення нового матеріалу
З таблиці на дошці видно, що однакова кількість речовини різних газів займає однаковий об'єм, але має різну масу, як і різну молярну масу. Тобто гази мають різну густину. Порівняємо густину двох газів кількістю речовини 1 моль за н. у.
 Таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
Таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
D = M1/M2,
звідси M1 = D · M2.
Отже, за молярною масою відомого газу можна визначити густину будь-якого газу.
Відеодемонстрація
1. Зважуємо закриту колбу з повітрям на терезах.
2. Заповнюємо колбу киснем, закорковуємо та зважуємо.
3. Обчислюємо співвідношення маси колби з повітрям і киснем, це й буде відносна густина, оскільки об'єм колби однаковий, а отже, і кількість речовин однакова.
4. M2(O2) = 32 г/моль.
За формулою М1 = D · M2 обчислюємо молярну масу повітря в кімнаті.
V. Закріплення вивченого матеріалу
Розв’язування задач
Задача 1
Обчисліть відносну густину карбон (ІV) оксиду за киснем.
Робота з таблицею
VI Підсумок уроку
VII Домашнє завдання
Опрацювати 27 підручника, відповісти на запитання.


про публікацію авторської розробки
Додати розробку
