Урок "ВИВЕДЕННЯ МОЛЕКУЛЯРНОЇ ФОРМУЛИ РЕЧОВИНИ ЗА МАСОЮ, ОБ’ЄМОМ АБО КІЛЬКІСТЮ РЕЧОВИНИ РЕАГЕНТІВ АБО ПРОДУКТІВ РЕАКЦІЇ"
Урок №
ТЕМА. РОЗВ’ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ: ВИВЕДЕННЯ МОЛЕКУЛЯРНОЇ ФОРМУЛИ РЕЧОВИНИ ЗА МАСОЮ, ОБ’ЄМОМ АБО КІЛЬКІСТЮ РЕЧОВИНИ РЕАГЕНТІВ АБО ПРОДУКТІВ РЕАКЦІЇ
Мета: формування предметних компетентностей: Формувати вміння і навички розв’язування задач на виведення формули вуглеводнів за загальною формулою гомологічного ряду, густиною та відносною густиною
Обладнання та реактиви: підручник, картки-завдання.
Базові поняття та терміни: густина, відносна густина, молярна маса, алгоритм, найпростіша формула, вуглеводень, маса, кількість речовини.
Тип уроку:комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Наскрізні змістовні лінії:
Громадянська відповідальність.
Навчатися працювати в команді, відповідально ставитись до завдань, визначених колективом, та ретельно виконувати свою частину роботи. У позаурочний час дбати про чистоту навколишнього середовища свого регіону, брати посильну участь у реалізації соціально значущих навчальних проектів.
Здоров’я і безпека.
Дотримання правил безпечного поводження з речовинами і матеріалами у лабораторії, побуті й довкіллі; усвідомлення залежності здоров’я від чистоти води, повітря, складу харчових продуктів; дотримання здорового способу життя.
Екологічна безпека і сталий розвиток
Значення засобів захисту рослин і їхній вплив на здоров’я людей та довкілля за їх неправильного використання.
Забезпечення збереження довкілля під час одержання, зберігання, транспортування і застосування вуглеводнів та їхніх похідних
Підприємливість і фінансова грамотність
Одержання алканів, етену, етину, бензену, їх застосування.
Компетентності:предметна компетентність, ключова компетентність: інформаційно-цифрова, спілкування державною мовою, екологічна грамотність і здорове життя, обізнаність та самовираження у сфері культури, математична компетентність
Хід уроку
І. Організаційний момент
Привітання, побажання хорошого настрою.
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Тестовий контроль
1. Вкажіть загальну формулу вуглеводнів ряду бензену:
а) СnH2n+2 б) СnH2n в) СnH2n-2 г) СnH2n-6
2. Вкажіть структурну формулу бромбензену
а) С6H5Br б) С6H6Br2 в) С6H12Br2 г) С6H4Br2
3. Вкажіть назву речовини С6H4Cl2
а) хлорбензен б) дихлорбензен в) трихлорбензен г)метилбензен
4. Згадайте, як горить бензен:
а) горить майже безбарвним полум’ям; б) горить світлим полум’ям;
в) горить кіптявим полум’ям; г) горить зеленим полум’ям.
5. Вкажіть продукт взаємодії бензену з нітратною кислотою:
а) хлорбензен б) нітробензен в) бромбензен г) метилбензен
6. Вкажіть гібридизацію атомів Карбону в молекулі бензину:
а) sp2- б) sp- в) sp3- г) s-
7. Згадайте формулу молекули бензену
а) циклічна б) плоска в) плоска циклічна г) лінійна
8. Встановіть відповідність між вуглеводнями та їх загальними формулами:
1) арени а) CnH2n+2
2) алкани б) CnH2n
3) алкени в) CnH2n-6
4) алкіни г) CnH2n-2
9. Встановіть відповідність між молекулярними формулами та назвами речовин:
1) C6H5Cl а) нітробензен
2) C6H5Br б) метилбензен
3) C6H5NO2 в) хлорбензен
4) C6H5CH3 г) бромбензен
10. Встановіть відповідність між вихідними речовинами та продуктами реакції:
1) C6H6 + Cl2 а) C6H5- NO2 + H2O
2) C6H6 + HNO3 б) C6H5- Cl + HCl
3) C6H6 + 3Cl2 в) C6H5-Br + HBr
4) C6H6 + Br2 г) C6H6Cl6
Правда – неправда
1. Паризькі модельєри пропонують шанувальникам екологічні сукні з
деревини сосни, бука, дуба. (так)
2. Винайдено пляшки та іншу посуду, яку можна їсти разом із харчовими
продуктами, які в них містяться. (ні)
3. Винайдено тканини, які не потрібно прати, вони очищуються самі(так)
4. Нещодавно вченими було створено штучну чорну ікру і смажену картоплю,
які не відрізняються від природних. (так)
5. Винайдено лікувальну синтетичну тканину, яка має властивість
виліковувати такі хвороби, як кір, пневмонія, грип. (ні)
6. З нафти і кухонної солі вчені навчилися виготовляти дощові плащі,
скатертини, різну тару. (так
ІV. Мотивація навчальної діяльності
Будь яку речовину можна записати за допомогою формули. Формула речовини – це умовний запис складу речовини за допомогою символів хімічних елементів й індексів. Щоб визначити формулу речовини, необхідно знайти елементи, які входять до її складу, і кількість атомів кожного елемента, що утворює структурну частинку цієї речовини.
Отже, тема нашого уроку…(учні записують тему уроку і формулюють мету).
V. Вивчення нового матеріалу
Задача 1
6,8г ацетиленового вуглеводню повністю прореагували із 4,48л водню (н.у.). Знайдіть молекулярну формулу вуглеводню.
Розв’язання
Дано:
![]() V(Н2) = 4,48 л6,8 г 4,48л
V(Н2) = 4,48 л6,8 г 4,48л
m(СnH2n-2) = 6,8 г СnH2n-2+ 2Н2→ СnH2n+2
![]() (14n-2)г 2∙22,4 л
(14n-2)г 2∙22,4 л
СnH2n-2-?
(14n-2)∙4,48 = 2∙22,4∙6,8
n = 5 Відповідь: С5Н8
Задача 2
1,4г алкену приєднують 0,746л бромоводню (н.у.). Знайдіть молекулярну формулу вуглеводню.
Розв’язання
![]() Дано:
Дано:
m(СnH2n) = 1,4 г 1,4 г 0,746 л
![]() V(НBr) = 0,746 л СnH2n+ НBr → СnH2n + 1Br
V(НBr) = 0,746 л СnH2n+ НBr → СnH2n + 1Br
СnH2n-? 14n г 22,4 л
1,4∙22,4 = 14n∙0,746
n= 3 Відповідь: С3Н6
Задача 3
Для каталітичного гідрування алкіну невідомого складу потрібно використати 1,7л водню (н.у.). Така ж сама маса вуглеводню під час взаємодії з бромом утворює 15,24 г тетраброміду з розгалуженим карбоновим скелетом. Визначте формулу алкіну.
![]() Дано: Розв’язання
Дано: Розв’язання
V(H2) = 1,7 л 1. Складаємо рівняння відповідних реакцій:
m(СnH2n-2Br4) = 15,24г СnH2n-2 + 2H2 ![]() СnH2n+2
СnH2n+2
![]() СnH2n-2 + 2Br2
СnH2n-2 + 2Br2 ![]() СnH2n-2Br4
СnH2n-2Br4
СnH2n- ? 2. Обчислимо кількість речовини водню
що вступив у реакцію каталітичного
гідрування алкіну : n = V/Vm ;
n=1,7л/22,4 моль/л= 0,076 моль
3. Обчислимо кількість речовини брому, що вступив у реакцію:
n(Br2)= 0,076 моль
4. Обчислимо масу брому:
m(Br2) = М ![]() n = 160 г/моль
n = 160 г/моль ![]() 0,076 моль = 12,16 г
0,076 моль = 12,16 г
5. Обчислимо масу алкіну:
m(СnH2n-2) = m(СnH2n-2Br4) – m(Br2) = 15,24 – 12,16 = 3,08 г
6. Обчислюємо кількість речовини алкіну за рівнянням реакції приєднання брому:
n(СnH2n-2) = n(Br2)/2 = 0,076/2 = 0,038 моль
7. Обчислюємо молярну масу алкіну:
M(CnH2n-2) =m/n ; M(CnH2n-2) = 3,08/0,038 =82г/моль
8. Обчислюємо число атомів Карбону в алкіні:
12n + 2n – 2 = 82
14n = 84
n=6
9. Виводимо формулу алкіну:
С6H10 Відповідь: С6H10
Задача 4
Внаслідок спалювання вуглеводню масою 1,5 г утворилися карбон (ІV) оксид об’ємом 2,24 л (н.у.) та вода масою 2,7 г. Виведіть формулу вуглеводню, якщо відносна густина його за повітрям становить 1,0345.
![]() Дано: Розв’язання
Дано: Розв’язання
m(CxHy)=1,5г 1. Обчислимо молярну масу вуглеводню:
V(CО2)=2,24 л M(CxHy) = D(CxHy)пов * Mпов
![]() m(H2O)=2,7г Mпов = 29 г/моль
m(H2O)=2,7г Mпов = 29 г/моль
![]() D(CxHy)пов=1,0345 M(CxHy) =1,0345*29 = 30г/моль
D(CxHy)пов=1,0345 M(CxHy) =1,0345*29 = 30г/моль
CxHy- ? 2. Обчислимо кількість речовини вуглеводню масою 1,5г:
n(СхНу) = m(CxHy)/M(CxHy);
n(CxHy) =1.5г/30г/моль = 0,05 моль
3. Обчислимо кількість речовини карбон (ІV)оксиду об’ємом 2,24 л:
n(CO2) =2,24л/22,4 л/моль; n(CO2) == 0,1 моль
4. Обчислимо кількість речовини води масою 2,7 г:
n(H2O) =m(H2O)/M((H2O); n(H2O) =2,7г/18г/моль = 0,15моль
5. Обчислимо співвідношення кількостей речовин вуглеводню, оксиду карбону (ІV) та води:
n (CxHy) : n (СО2) : n(Н2О) = 0,05 : 0,1 : 0,15= 1:2:3
6. Обчислимо число атомів Карбону і Гідрогену у вуглеводні:
СхНу + О2 → 2 СО2 + 3Н2О
х=2; у=6; С2Н6; М(С2Н6) = 30 г/моль Відповідь: С2Н6 (етан)
VІ. Узагальнення та систематизація знань
Розв’язування задач
- Етиленовий вуглеводень масою 4,2 г приєднує 16 г брому. Знайти молекулярну формулу сполуки.
- Вивести формулу вуглеводню, якщо на спалювання його об’ємом 0,3 л витратили кисень об’ємом 1,95 л, а внаслідок реакції утворився вуглекислий газ об'ємом 1,2 л і пари води об'ємом 1,5 л.
Задачі
1. Яку кількість речовини водню потрібно взяти для реакції з етином
масою 0,26 кг, щоб утворився насичений вуглеводень? (20 моль)
2. Який об’єм кисню потрібний для спалювання суміші 50 л пропіну і 30 л
етану? (305 л)
3. Суміш етину і метану об’ємом 89,6 л з об’ємною часткою метану 0,25
спалили. Обчисліть об’єм вуглекислого газу, що при цьому виділився. (156,8 л)
4. Суміш етану і етину обємом 1,6 л знебарвила 400 г бромної води з
масовою часткою брому 1,6%. Визначте обємні частки газів у суміші. (відповідно
72%, 28%)
5. Яку масу брому може приєднати 5,4 г алкіну, густина якого 2,41 г/л?
(32 г)
6. Об’ємна частка метану в природному газі 88%. Який об’єм етину (н.у.)
можна добути з 400 м3 такого газу? (176 м3)
Властивості гомологічних рядів вуглеводнів
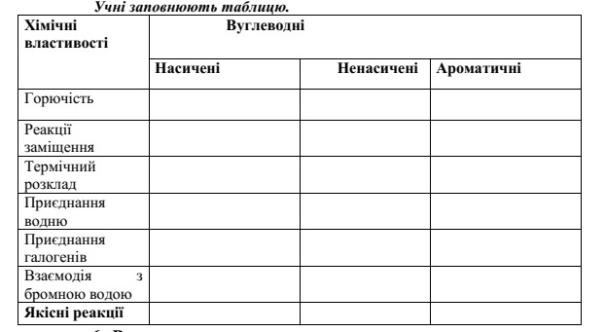
VІІ. Домашнє завдання
Опрацювати матеріал підручника. Розв’язати задачу:
При спалюванні органічної речовини масою 1,1 г утворився вуглекислий газ масою 2.2 г і вода масою 0.9 г. Виведіть формулу речовини, якщо її пари об’ємом 0,7 л мають масу 2,75 г.
VІІІ. Підсумок уроку


про публікацію авторської розробки
Додати розробку
