Урок "Вуглеводні. Метан. Гомологи метану"
9 клас хімія дата:
Урок ___
ТЕМА: ВУГЛЕВОДНІ. Метан. Гомологи метану
Мета: формувати знання учнів про молекулярну, електронну й структурну формули метану; ознайомити учнів з поняттям «гібридизація електронних орбіталей» на прикладі sp3-гібридизації електронів у атомі Карбону; поглибити знання про поширення органічних сполук у природі на прикладі метану; ознайомити з фізичними властивостями метану, показати зв’язок будови та властивостей молекули метану.
Тип уроку: вивчення нового матеріалу.
Форми роботи: фронтальна робота, розповідь учителя, розв’язання задач. Обладнання: медіафільм про гібридизацію електронів у атомі Карбону, моделі молекул органічних речовин.
Фронтальна робота за питаннями
- Яку валентність проявляє в органічних сполуках атом Карбону?
- Наведіть схему будови атома Карбону.
- 3 якими особливостями будови атома Карбону пов’язане розмаїття органічних сполук?
Узагальнення вчителя
Карбон — особливий елемент. Жоден інший хімічний елемент не здатен утворювати таку кількість сполук. Причина цього розмаїття полягає в тому, що атоми Карбону здатні:
- з’єднуватися один з одним у ланцюги різної будови — відкриті (нерозга- лужені, розгалужені), замкнені;
- утворювати не лише прості (одинарні), але й кратні (подвійні, потрійні) зв’язки:
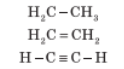
- утворювати міцні зв’язки майже з будь-яким іншим елементом.
Ці унікальні властивості Карбону пояснюються сполученням двох факторів:
- наявністю на зовнішньому енергетичному рівні (2s і 2р) чотирьох електронів (тому атом Карбону не схильний ні віддавати, ні приєднувати вільні електрони з утворенням йонів);
- дрібний розмір атома (порівняно з іншими елементами IV групи).
Унаслідок цього Карбон утворює переважно ковалентні, а не йонні зв’язки, і проявляє валентність IV.
Метан, його молекулярна, електронна та структурна формули
Розповідь учителя
Найпростіша органічна сполука — метан, утворена одним атомом Карбону й чотирма атомами Гідрогену.
- Молекулярна формула— СН4
Структурна формула
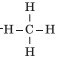
У процесі утворення молекули метану в атомі Карбону відбувається sр3 гібридизація електронних хмарин.
Гібридизація — це явище змішування різних за формою й енергією електронних орбіталей з утворенням однакових за формою й енергією гібридних орбіта- лей.
У процесі sр3-гібридизації відбувається цілковите змішування однієї s- і трьох p-орбіталей з утворенням чотирьох гібридних орбіталей.
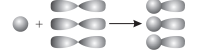
Утворені гібридні орбіталі асиметричні й дуже витягнуті в один бік від ядра. Вони відштовхуються одна від одної під кутом 109° 28', тому молекула метану в просторі являє собою тетраедр.
Розглядаємо модель молекули метану:
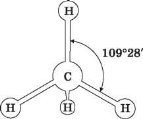
У молекулі метану між атомами Карбону й Гідрогену утворюються чотири однакові за силою й довжиною ковалентні слабкополярні σ-зв’язки.
σ -зв’язок — це ковалентний зв’язок, утворений у результаті перекривання орбіталей уздовж лінії зв’язку (що єднає центри атомів).
σ -зв’язок міцний, має значну енергію.
Гомологія — це явище існування подібних за будовою та властивостями органічних речовин, що відрізняються на групу -СН2.
Група -СН2 називається гомологічною різницею. Речовини, що подібні за будовою й відрізняються одна від одної на одну або кілька груп -СН2, утворюють гомологічні ряди.
Речовини, що входять в один гомологічний ряд, називаються гомологами. Розглянемо таблицю гомологічного ряду алканів з назвами (у підручнику або роздавальному матеріалі). Цей ряд називають гомологічним рядом метану.
Знайдіть закономірність між кількістю атомів Карбону й Гідрогену в молекулах алканів.
Загальна формула гомологів метану — СлН2n+2.
Завдання. Для вуглеводню складу С4Н10 складіть формули двох найближчих гомологів і можливих ізомерів. (Записуємо їх структурні формули на дошці й у зошитах.)
- Зобразіть структурну формулу метану.
- Подумайте, чим відрізняються структурна формула на рисунку й модель молекули метану?
- Яку просторову форму має молекула метану?
- Скільки загальних електронних пар у молекулі метану?
- Зобразіть електронну формулу молекули метану.
- Які фізичні властивості проявлятиме молекула метану?
Фізичні властивості метану
Метан — газ, без кольору, без запаху, без смаку, легший за повітря (Dповітря= =16/29,) практично не розчинний у воді, tкип = -161,6 °С, tпл = -182,5 °С, горючий.
Прочитати §__.


про публікацію авторської розробки
Додати розробку
