Урок "Періодичний закон і періодична система хімічних елементів Д.І.Менделеєва"
Періодичний закон і періодична система хімічних елементів
Д.І. Менделєєва. Хімічний зв’язок. Основні класи неорганічних сполук.
Мета: повторити та систематизувати знання про природні групи хімічних елементів; порівняти властивості хімічних елементів відносно збільшення маси їх атомів і сформулювати Періодичний закон Д.І.Мендєлєєва. Сформувати уявлення про те, що Періодичний закон є класичним прикладом наукового підходу до пізнання навколишнього світу; розвивати вміння аналізувати інформацію та робити висновки;
Обладнання: періодична система Д.І. Менделєєва, таблиці та схеми.
Базові поняття: металічні та неметалічні елементи, хімічний елемент,атом, відносна атомна маса, періодичність, Періодичний закон, періодична система, хімічний зв'язок,кислоти,оксиди,основи,солі.
Тип уроку: комбінований.
Структура уроку
І. Організаційний момент;
ІІ. Перевірка знань, умінь і навичок студентів;
ІІІ. Актуалізація навчальної діяльності студентів;
ІV. Оголошення теми та мети заняття, мотивація пізнавальної діяльності;
V. Опрацювання теми заняття;
- Історія відкриття Періодичного закону;
- Відкриття Періодичного закону;
- Поняття про будову атома. Склад атомних ядер;
- Види та характеристика хімічного зв’язку;
- Означення основних класів неорганічних сполук та їх приклади;
VІ. Закріплення нового навчального матеріалу;
VІІ. Підбиття підсумків. Оцінювання студентів;
VІIІ. Домашнє завдання.
Хід заняття
І. Організаційний момент
Перевірка готовності учнів до уроку, налаштування на робочий настрій.
ІІ. Перевірка знань, умінь і навичок студентів
Перевірка виконання письмових завдань (усно або на дошці).
1. Проводиться хімічний диктант
«Природні сімейства елементів».
(Учитель читає твердження. Учні, в залежності від того, згодні вони чи ні, відповідають «так» або «ні».)
1) До групи лужних металів належать такі елементи: Літій, Рубідій, Цезій, Натрій, Кальцій.
2) Натрій і Калій мають металічний блиск.
3) Натрій і Калій активно реагують із водою за звичайних умов.
4) У сполуках Натрій і Калій завжди двовалентні.
5) Метали Натрій і Калій м’які, легко ріжуться ножем.
6) Галогенами є Хлор, Бром, Йод.
7) У сполуках із Гідрогеном галогени мають валентність один.
8) Галогени є неактивними металами.
9) Галогени — «ті, що народжують солі».
10) Молекули простих речовин галогенів двохатомні.
11) Водні розчини сполук галогенів із Гідрогеном є кислотами.
12) Сімейство інертних газів утворюють Гелій, Неон, Аргон, Криптон, Ксенон і Радон.
13) Інертні (благородні) гази містяться в повітрі.
° Декілька учнів під час тестування виконують завдання на картках (на дошці або на місцях).
- З наведеного переліку хімічних елементів випишіть окремо: а) лужні метали; б) лужноземельні метали; в) галогени; г) інертні гази.
Br, Na, Al, Ca, S, Xe, K, Cl, I, Li, Ba, Ne, Be, Rb, Sr, F, Fe, He, H.
- Складіть рівняння реакції взаємодії будь-якого з галогенів.
а) з Калієм; б) Кальцієм; в) Алюмінієм.
3) Складіть рівняння реакції взаємодії води:
а) з лужним металом; б) з лужноземельним металом.
ІІІ. Актуалізація навчальної діяльності студентів
● Бесіда.
— Поясніть, чому виникла необхідність у класифікації хімічних елементів.
— Які природні родини хімічних елементів вам відомі?
— Які вчені намагалися систематизувати хімічні елементи?
— Яку спробу ви вважаєте найбільш вдалою? Чому?
ІV.Оголошення теми та мети заняття, мотивація пізнавальної діяльності
Вчитель називає тему уроку, визначає спільно з учнями цілі уроку.
V. Опрацювання теми заняття
● Розповідь вчителя.
Знання й усвідомлення періодичного закону допоможе вам зрозуміти та пояснити дуже багато фактів і полегшити вивчення хімії як науки.
1. Історія відкриття періодичного закону.
Датою відкриття періодичного закону хімічних елементів Д.І. Менделєєвим прийнято вважати 1 березня 1869 р. Цього дня Д.І. Менделєєв завершив роботу над таблицею «Дослідження системи елементів, заснованої на їхній атомній вазі та хімічній подібності». Ця таблиця була лише прообразом періодичної системи.
Періодичний закон був відкритий не в один день: відкриттю передував довгий період роздумів і попередньої роботи.
Момент відкриття періодичного закону описаний у спогадах А.А. Іно-странцева.
Д.І. Менделєєв три дні й три ночі, не лягаючи спати, пропрацював за конторкою, намагаючись оформити результати своєї уявної конструкції в таблицю, але спроби виявилися невдалими. Нарешті, украй стомлений учений ліг спати і одразу ж заснув.
«Бачу у сні таблицю, де елементи розставлені, як треба. Прокинувся, негайно записав на клаптику паперу — лише згодом стало потрібним в одному місці виправлення». Із цих спогадів А.А. Іностранцева й виникла версія про те, що Д.І. Менделєєв зробив своє відкриття у сні.
Случилось в Петербурге это.
Профессор университета
Писал учебник для студентов…
Задумался невольно он
Как обьяснить про элементы?
Нельзя ли тут найти закон?
Искали многие решенья,
Но, проходя лишь полпути, бросали.
Мучило сомненье «А можно ли его найти?»
Мир состоит из элементов
(Всего их знали 60).
А сколько их всего
На это нельзя ответить наугад,
Но не угадал, а верил он.
Тут должен, должен быть закон!
Упрямо он искал решенье.
Был труд, надежда и терпенье,
И вера в то, что он найдет!
Он так работал целый год.
И вдруг!!!
Шляпа брошена в углу!
Он бросается к столу и строчит карандашем.
Наконец-то!Он нашел!
Он на чем попало пишет.
Ничего вокруг не слышит.
Наконец-то понял он,
В чем разгадка, в чем закон!
Из кабинета он выходит
«Не упустить бы мысли той».
Он элементы ставит в строй,
Но все ж таблица не выходит…
Тогда, усталостью сражен, лег на диван и видит СОН!
Насправді одне з найбільших відкриттів у хімії було зроблено Д.І. Мен-делєєвим після тривалої й виснажливої праці.
2. Відкриття періодичного закону
На відміну від своїх попередників, Д.І. Менделєєв був глибоко переконаний в існуванні природного взаємозв’язку між усіма хімічними елементами, як між подібними, так і несхожими.
За основу систематизації хімічних елементів учений обрав відносну атомну масу, вважаючи, що вона є головною характеристикою хімічного елемента, адже не змінюється при утворенні елементом простої чи складної речовини. Розташовуючи символи всіх відомих на той час 63 хімічних елементів у ряд у порядку зростання їх відносної атомної маси, він помітив, що елементи з подібними властивостями (наприклад, лужні метали) не з’являються безпосередньо один за одним, а періодично (регулярно) повторюються. Виявилося, що так само закономірно, через певний інтервал, повторюється «хімічний характер» сполук елементів.
Проаналізуємо, які закономірності виявив Д. І. Менделєєв при об’єднанні елементів у ряд. Для цього складаємо таблицю, в якій наведено вищі валентності елементів у сполуках та формули їх сполук з Оксигеном і Гідрогеном для елементів від Літію до Аргону і зазначимо їх властивості.
У ряду, що представлені у таблиці, чітко прослідковується періодична зміна властивостей. Від Літію до Флуору виявляється поступова зміна властивостей. Так, Літій утворює просту речовину метал (лужний метал). Поступово характер простої речовини змінюється на неметал. Також поступово збільшується вища валентність, що проявляють елементи, та характер оксиду. Літій оксид є основним, а Нітроген (V) оксид – кислотним (звісно, Оксиген і Флуор не здатні утворювати оксиди).
Далі така послідовність у зміні властивостей різко обривається. З’являється елемент Натрій, який за своїми властивостями подібний до першого елементу ряду – Літію. У подальшому властивості елементів змінюються у такій самій послідовності, що і від Літію до Флуору. В ряд простих речовин відбувається поступовий перехід від типового металу (Літію) до типового неметал (Хлору). Спостерігається зміна складу і характеру властивостей сполук, зокрема перехід від основного літій оксиду через амфотерний алюміній оксид до кислотного хлор (VII) оксиду. Ці закономірності більш-менш чітко прослідковуються по всьому ряду всіх елементів, що розташовані за порядком їх збільшення атомних мас.
Аналізуючи послідовність елементів, Д. І. Менделєєв виявив, що залежність властивостей елементів і їх сполук від атомної маси є періодичною. У 1869 році він сформулював Періодичний закон: Властивості хімічних елементів, а також утворені ними простих і складних речовин перебувають у періодичній залежності від відносних атомних мас елементів.
Первісне формулювання закону було інше: «Властивості простих тіл, а також форма і властивості сполук елементів перебувають у періодичній залежності або, виражаючись алгебраїчно, утворюють періодичну функцію від величини атомних ваг елементів». У той час замість «речовина» говорили «тіло», а атомну масу називали атомною вагою, ще не були відомі інертні гази та деякі інші елементи.
Базуючись на Періодичному законі, Д.І.Менделєєв побудував класифікацію хімічних елементів, яку називають Періодичною системою. Якщо записати в окремий рядок символи елементів кожного періоду так, щоб природні сімейства( лужні метали, галогени,інертні гази) утворювали вертикальні стовпчики, то отримаємо довгоперіодичний варіант таблиці.
Ряд хімічних елементів, розташованих у порядку зростання їхніх атомних мас, що починається з Гідрогену або лужного металічного елемента і закінчується інертним газом, називають періодом. Усього відомо 7 періодів: три малі (1,2 і 3) і чотири великі (4,5,6,7). У малих періодах при переході від Гідрогену або лужного металічного елемента до інертного газу вища валентність поступово зростає від 1 до 7. Великі періоди мають по 18 і більше елементів. Властивості елементів, а також утворених ними простих речовин і сполук, при збільшенню атомних мас у періоді поступово змінюються.
Вертикальні колонки Періодичної системи називають групами. У короткому варіанті таблиці їх число дорівнює 8, Номер групи, як правило, збігається з вищою валентністю хімічного елемента, що він виявляє у сполуках з Оксигеном (наприклад, Хлор і Манган,розташовані в групі 7 і мають вищу валентність 7). Кожну групу розподіляють на дві підгрупи-головну (А-група) і побічну (В-група). У головну входять елементи як малих, так і великих періодів, а в побічну – тільки великих періодів. Побічні підгрупи містять тільки металічні елементи (їх називають перехідними металами).
Періодичні зміни властивостей елементів була відома і до Менделєєва, а його геніальність полягає в тім, що він першим побачив у цій періодичності
фундаментальний закон природи і поклав його в основу складеної ним таблиці.
Робота з таблицею
Структура Періодичної системи
|
Назва |
Визначення |
|
Періоди |
Ряд хімічних елементів, розташованих у порядку зростання їхніх атомних мас, що починається з Гідрогену або лужного металічного елемента і закінчується інертним газом. |
|
Групи |
Вертикальний ряд елементів, який містить подібні за властивостями елементи. |
|
Головні підгрупи |
Складаються з елементів малих та великих періодів. |
|
Побічні підгрупи |
Складаються з елементів лише великих періодів. |
Багато властивостей елементів закономірно змінюються в підгрупах з ростом відносної атомної маси (учитель, за допомогою учнів зображує періодичність зміни властивостей елементів головних підгруп у вигляді таблиці).
Робота з таблицею
Закономірність зміни властивостей хімічних елементів
|
Властивості |
Закономірності зміни у головних підгрупах |
Закономірності зміни у періодах |
|
Металічні |
Посилюються |
Посилюються |
|
Неметалічні |
Посилюються |
Посилюються |
|
Вища валентність за Оксигеном |
Постійна |
Збільшується |
|
Валентність у летких сполуках з Гідрогеном |
Постійна |
Збільшується |
- Поняття про будову атома. Склад атомних ядер.
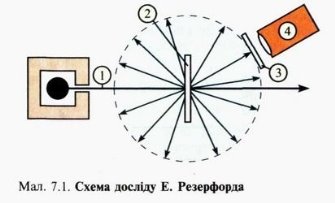
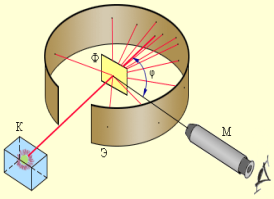
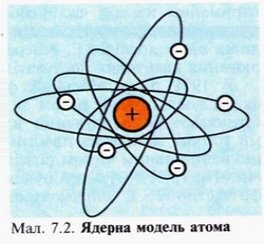
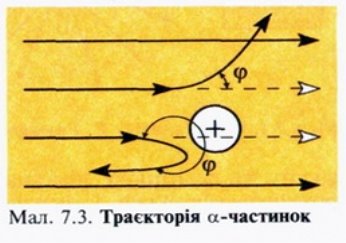
Вам вже відомо, що всі речовини складаються з атомів. В хімічних реакціях атоми не змінюються, а лише переходять з однієї речовини в іншу. Тобто атоми є хімічно неподільними частинками. Перші експериментальні підтвердження складної будови атомів з’явились наприкінці 19 ст., коли стало відомо,що деякі речовини за певних обставин випромінюють промені, що являють собою потік електронів – негативно заряджених елементарних частинок. Це свідчило про те, що атом має складну будову. Атом не має електричного заряду, виходить крім електронів у ньому повинні міститися й позитивно заряджені частинки. Атом являє собою заряджену позитивним зарядом кулю, всередині якої, наближаючись до положень рівноваги, коливаються електрони. Сумарний негативний заряд електронів дорівнює позитивному заряду кулі, тому атом загалом нейтральний. В 1906 р. Томсон висунув ідею, що атом має кількість електронів, що дорівнює хімічному атомному номеру елемента, а в позитивно зарядженому середовищі — більшій частині маси атома. Помилковість гіпотези Томсона довів Е. Резерфорд (1871-1937 рр.). В 1908-1911 рр. під його керівництвом були виконані досліди з розсіювання а-частинок металевою фольгою. Більшість з них, проходячи крізь фольгу, відхилялися від первісного напрямку, деякі сильно змінювали траєкторію руху, а окремі відбивалися від фольги і летіли у зворотньому напрямку. На основі цього він довів, що позитивний заряд в атомі не розподілений рівномірно, а сконцентрований в центрі атома в дуже невеликому об’ємі, який він назвав ядром. Отже, атом – це електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
На основі цього сформувалася планетарна модель атома:
- Весь атом складається з позитивно зарядженого ядра, І в якому сконцентрована майже вся маса атома. Розміри ядра порядку 10-14 -10-15 м (атом — 10-10 м).
- Навколо масивного ядра по замкнених орбітах рухаються легкі електрони, загальний негативний заряд яких дорівнює позитивному заряду ядра атома.
- Ядро атома складається із частинок двох видів – протонів і нейтронів. Протони – позитивно заряджені частинки із зарядом +1 (електрони мають заряд -1), нейтрони не мають заряду.
- Заряд ядра атома дорівнює порядковому номеру елемента в періодичній системі;
- Протонне число дорівнює заряду ядра атома елемента;
- Види та характеристика хімічного зв’язку
Атоми різних елементів, що входять до складу простих або складних речовин, утримуються разом завдяки наявності хімічного зв’язку. В утворенні хімічного зв’язку беруть участь кулонівські сили , носіями яких є електрони та ядра атомів. Хімічний зв'язок виникає внаслідок електростатичної взаємодії позитивно заряджених ядер і негативно заряджених електронів.
Завдання. Заповнити порожні графи.
|
Формула оксиду |
Назва оксиду |
Формула основи,що відповідає оксиду |
Назва основи,що відповідає оксиду |
|
|
Літій оксид |
|
|
|
CaO |
|
|
|
|
|
|
KOH |
|
|
|
|
|
Натрій гідроксид |
Відповідь : 1)Li2O - Літій оксид- LiOH-Літій гідроксид
2)CaO - Кальцій оксид - Ca(OН)2 - Кальцій (II )гідроксид
3) К2О- калій (I ) оксид - КОН-калій гідроксид
4) Na2O – натрій (I ) оксид – NaOH – натрій гідроксид
VІ. Закріплення нового навчального матеріалу
— Які властивості елементів і їхніх сполук періодично змінюються?
— Як змінюється характер оксидів елементів у періоді? Проілюструйте рівняннями реакцій властивості оксидів Літію, Берилію і Карбону. Які властивості характерні для відповідних їм гідроксидів?
- Напишіть формули оксидів і гідроксидів хімічних елементів третього періоду. Які з них є: а)основними; б) амфотерними; в) кислотними?
- Назвіть склад атомного ядра;
- Які види хімічного зв’язку Вам відомі?
- Що таке оксиди? Навести приклади;
- Назвіть основні хімічні властивості кислот.
VІІ. Підбиття підсумків. Оцінювання студентів
VІIІ. Домашнє завдання.


про публікацію авторської розробки
Додати розробку