Урок з теми: "Будова атома. Склад атомних ядер (протони і нейтрони). Протонне число. Нуклонне число."
№ 6
Дата: ______________
Тема: Будова атома. Склад атомних ядер (протони і нейтрони). Протонне число. Нуклонне число.
Очікувані результати: учень розрізняє атомне ядро, електрони, протони, нейтрони; характеризує склад атомних ядер (кількість протонів і нейтронів).
Тип уроку: засвоєння знань, умінь і навичок.
Форми роботи: розповідь учителя, індивідуальні повідомлення учнів, фронтальна робота.
Клас: 8 клас.
Обладнання: ПСХЕ Д. І. Менделєєва.
Перебіг уроку
І. Організаційна частина.
II. Перевірка домашнього завдання, актуалізація опорних знань.
ІІІ. Вивчення нового матеріалу.
Нам уже відомо, що Д. І. Менделєєв узагальнив великий обсяг знань і відкрив фундаментальний закон природи – періодичний закон. Але рівень тогочасних знань не давав змоги розкрити фізичний зміст періодичного закону, виявити причини періодичної зміни властивостей елементів залежно від зростання їх атомних мас. Це стало можливим лише після з'ясування будови атома.
Відомий американський учений двічі лауреат Нобелівської премії Лайнус Полінг в своїй книзі «Основи хімії» (1974 р.) пише: «велику допомогу всякому вивчаючому хімію перш за все допоможе знання будови атома».
У науці довго панувала думка, що атоми – найменші частинки речовини і не містять інших, простіших складових частинок. Тому вони неподільні і не можуть перетворюватися на інші атоми. Проте наприкінці XIX ст. фізики експериментально підтвердили складність будови атома. Відкриття рентгенівських променів (1895), явища радіоактивності А. Беккерель, П’єр Кюрі і Марія Складовська-Кюрі (1896), електрона (1897) спричинили революцію в природознавстві, зокрема сприяли перегляду уявлень про структуру і властивості речовини, оскільки атом виявився складним утворенням. Саме відкриття радіоактивності відіграло велику роль у встановленні складної природи атома і розкритті його структури.
Поняття про радіоактивність.
Досліджуючи солі Урану, французький фізик А. Беккерель виявив, що елемент Уран випромінює невидимі для ока промені, подібні до рентгенівських. Його дослідами зацікавилися інші вчені. Зокрема, Марія Склодовська-Кюрі встановила, що сполуки Торію також мають цю здатність. Разом зі своїм чоловіком, французьким фізиком П'єром Кюрі, вона відкрила два нові елементи, названі за її пропозицією Полонієм і Радієм, які виявилися значно потужнішими джерелами випромінювання, ніж Уран і Торій. Таку здатність деяких елементів назвали радіоактивністю, а елементи – радіоактивними.
Ядра з великою кількістю протонів (понад 82) є нестійкими. Вони розпадаються на менші окремі ядра, окремі частинки. Цей процес називають радіоактивним розпадом. Нестійкість великих ядер є причиною того, що в природі нема елементів з порядковими номерами, що перевищують 92.
Вивчаючи природу радіоактивного випромінювання, англійський фізик Ернест Резерфорд установив, що воно неоднорідне: під дією електричного поля поділяється на три пучки, один з яких не змінює свого початкового напрямку, отже, не несе електричного заряду, - це γ-випромінювання (електромагнітні хвилі), а два інші – відхиляються у протилежні боки до зарядів електричного поля. Це α-проміння (ядра атомів елемента Гелію) і β-проміння (потік електронів).
Радіоактивні елементи з часом руйнуються з утворення інших хімічних елементів і α, β, γ променів:
α-промені – потік частинок з масою 4 і зарядом +2 (атомів гелію ![]() ).
).
β-промені – це потік негативно заряджених частинок – електронів.
γ-промені – випромінювання електромагнітних хвиль (подібні рентгенівським).
Історичні моделі будови атома:
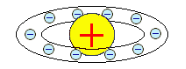
1. 1902 р. модель У. Томсона (лорда Кельвіна) - атом є згустком позитивно зарядженої матерії, середині якої рівномірно розподілені електрони (кекс з ізюмом).

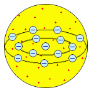
2. 1903 р. модель Дж. Томсона - атом є позитивно зарядженою кулею, всередині якої електрони містяться у одній площині та утворюють концентричні кільця (кавуноподібна модель Томсона).
3. 1903 р модель Філіпа фон Лєнарда - атом є кулею, в якій протилежні заряди не існують окремо.

4. 1904 р. модель Хантаро Нагаока – атом подібний до планети Сатурн.
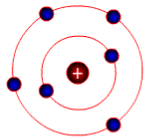
5. Вивчаючи розсіювання α-частинок, які проходять крізь тонкі металеві пластинки, Е. Резерфорд у 1911 р. запропонував схему будови атома, що дістала назву ядерна модель атома (або планетарна).
Модель атома Карбону Ернест Резерфорд.
Згідно з цією моделлю атом складається з позитивно зарядженого ядра і негативно заряджених електронів, що обертаються навколо нього. Позитивний заряд ядра нейтралізується сумарним негативним зарядом електронів, так що атом загалом електронейтральний.
Атом – найдрібніша електронейтральна частинка речовини, яка складається з позитивно зарядженого ядра й негативно заряджених електронів, які рухаються навколо нього.
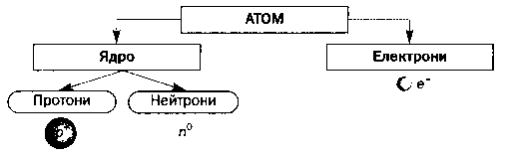
У 1911 р. англійський учений Е. Резерфорд довів, що в центрі атома є позитивно заряджене ядро. Ядра атомів складаються з протонів і нейтронів (загальна назва – нуклони).
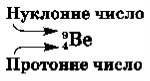
Кількість протонів у ядрі дорівнює порядковому номеру елемента, а сума чисел протонів і нейтронів відповідає його масовому числу. Навколо ядра по орбіталям обертаються електрони. Їх число дорівнює позитивному заряду ядра. Атом у цілому електронейтральний.
Маси протонів і нейтронів приблизно однакові і майже у 2000 разів більші за масу електрона.
|
Частинка атома |
Позначення |
Маса |
Заряд |
|
Протон |
р+ |
1 |
+1 |
|
Нейтрон |
n0 |
1 |
0 |
|
Електрон |
|
0 |
-1 |
Заряд ядра атома дорівнює числу протонів (Z) і відповідає порядковому номеру елемента в періодичній системі хімічних елементів Д. І. Менделєєва.
Сума числа протонів (Z) і нейтронів (N) дорівнює масі атома (А):
А = Z + N
Існує двадцять елементів, у кожного з яких усі атоми мають однакові нуклонні числа (вони майже збігаються з відносними атомними масами у періодичній системі):
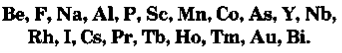
Атоми досить стійкі і здатні до існування протягом тривалого часу.
Хімічний елемент – вид атомів із певним протонним числом.
Численні експериментальні дослідження англійських учених (Е. Резерфорда, Г. Мозлі, 1917 р.) показали, що заряд ядра атома дорівнює порядковому номеру елемента в періодичній системі.
Так було розкрито фізичний зміст порядкового номера. Він виявився дуже важливою константою, що виражає величину заряду ядра. Оскільки атом загалом електронейтральний, то й число електронів у атомі також дорівнює порядковому номеру елемента.
Прості йони елементів містять стільки протонів і нейтронів, стільки й атоми, але відрізняються від них за кількістю електронів.
IV. Закріплення знань.
1. Обчисліть число протонів і нейтронів атома Карбону.
2. Дайте характеристику будови атома елементів № 13, № 15 за положенням у періодичній системі.
Приклад: Al – 3 період, ІІІ група, головна підгрупа, р+ = 13, е- =13, n0 = 27-13=14 вища валентність – ІІІ.
Розв’язування вправ за підручником.
V. Підсумок уроку.
VI. Домашнє завдання.
Опрацювати §
Письм. №


про публікацію авторської розробки
Додати розробку