Урок з теми "Швидкість хімічних реакцій" 9 клас
Урок у 9 класі
на тему:
«Швидкість хімічної реакції, залежність швидкості реакції від різних чинників»
підготувала:
учитель хімії
Опорного закладу
«Охтирська ЗОШ І-ІІІ ступенів»
Жувак Ірина Володимирівна
Урок
Тема: Швидкість хімічної реакції, залежність швидкості реакції від різних чинників.
Інструктаж з БЖД.
Мета: - Сформувати поняття про швидкість хімічної реакції; визначити чинники, від яких залежить швидкість реакції та розглянути їх вплив на перебіг реакції
- Розвивати уявлення учнів про можливість керування хімічними процесами; формувати вміння аналізувати інформацію, встановлювати причинно-наслідкові зв’язки між явищами; робити висновки.
- Виховувати бажання здобувати нові знання, пізнавати навколишній світ. Дати поштовх у формуванні ставлення учнів до інших людей, праці, успіхів та невдач.
Тип уроку: вивчення нового матеріалу.
Обладнання: Періодична система хімічних елементів Д.І Менделєєва, таблиця розчинності, ряд активності металів, пробірки,нагрівальний прилад, стружка заліза, хлоридна кислота, цинк, магній.
Девіз уроку: «Щоб перемогти, потрібно знати, вміти, думати».
Хід уроку:
І. Організаційний етап.
Доброго дня шановні учні! Сьогодні у вас незвичайний урок. Ви звикли до традиційних уроків хімії. А сьогодні урок у вас особливий, сповнений цікавими фактами. Сподіваюсь, що вам запам’ятається цей урок, і ви візьмете із нього все те, що вам знадобиться в майбутньому. Тому прошу, будьте уважними!
Будь ласка, виберіть картки з кольором, що вам сподобався і займіть своє місце за столом з позначкою того ж кольору.
Ви обрали собі картки певного кольору. На зворотній стороні цих карток ви бачите слова або словосполучення. Ваше завдання: за 1-2 хв. з усіх уривків, скласти визначення, з яким ви познайомилися на минулому уроці, а також обрати лідера, який і озвучить відповідь на запитання. Лідера група, яка справиться раніше, прошу підняти руку.
Отже, групи сформовані, лідери обрані, тож розпочинаємо активну співпрацю.
ІІ. Перевірка д/з.
Актуалізація опорних знань
Для перевірки основних понять і термінів минулого уроку, прошу допомогти мені лідерів груп. Але, ви перевірятимете знання у членів не власної групи, а сусідніх груп. Прошу лідерів перейти до інших груп. Для перевірки д/з у вас є список запитань і бланк для оцінювання. У цей бланк ви записуєте прізвище кожного члена групи, знання якої перевіряєте, із списку запитань задаєте кожному учню по 4 запитання. Час на роздуми 5 секунд. Якщо учень відповів правильно, ставите 1 бал у відповідну колонку. На дане завдання ви маєте 5 хвилин.
Запитання для перевірки д/з.
- Назвіть типи реакцій за кількістю реагентів і продуктів реакції.
- Реакція обміну – це…
- Реакція сполучення – це…
- Реакція заміщення – це…
- Реакція розкладу – це…
- Екзотермічна реакція – це….
- Ендотермічна реакція – це….
- Тепловий ефект реакції – це…
- Тепловий ефект реакції позначається…
- Тепловий ефект екзотермічних реакцій….
- Тепловий ефект ендотермічних реакцій…
- Оборотні реакції це…
- Хімічна рівновага – це…
- Окисник – це…
- Відновник – це…
- Окиснення – це…
- Відновлення – це…
- ОВР – це…
Відкладіть, будь – ласка бланки, а лідери поверніться до своїх груп.
Переходимо до вивчення нової теми.
IІІ. Мотивація навчальної діяльності
- Скажіть будь-ласка чим відрізняється черепаха від гепарда? (У них різна швидкість руху)
А тепер за допомогою експерименту переконаємось, що швидкість може використовуватись і в хімії.
Спостерігаючи за експериментом зверніть увагу яка з реакцій відбувається швидше, а яка повільніше.
Демонстрація. Горіння свічки та горіння паперу.
– Чи однакова швидкість горіння в обох випадках?
Як ви вже здогадались тема нашого уроку "Швидкість хімічної реакції".
На сьогоднішньому уроці ми з вами спробуємо визначити, що називають швидкістю хімічної реакції, та чи можна керувати швидкістю хімічних реакцій?Якщо так, то яким чином?
ІV. Вивчення нового матеріалу
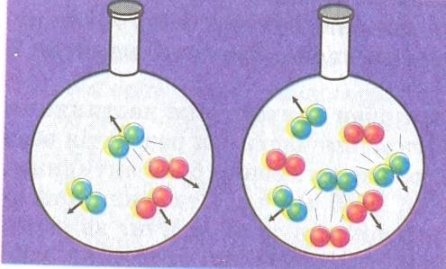
Хімічні реакції можуть протікати як дуже швидко, так і дуже повільно. Так, реакція горіння залежно від природи речовини може відбуватися швидко(папір), миттєво(вибух пороху), повільно(вугілля).
Вам вже відомо із курсу фізики, що швидкість – це величина, яка чисельно дорівнює шляху, який проходить тіло за одиницю часу.
Проте в хімії під час проходження хімічної реакції механічного переміщення не відбувається.
Проблема: То що ж характеризує швидкість в хімії?
– Скажіть, будь ласка, швидко чи повільно відбуваються такі процеси:
а) Іржавіння заліза; (повільно)
б) утворення мінералів в земній корі; (повільно)
в) тверднення цементу; (повільно)
г) вибух пороху; (швидко)
д) спалах пари бензину в двигуні. (швидко)
Завдання 1.
Розташуйте явища за зростанням швидкості хімічних реакцій
(група, яка справиться раніше, підніміть руки)
1) Вибух газу 6
2) Ржавіння заліза 2
3) Утворення мінералів у природі 1
4) Згоряння бензину в двигуні 5
5) Бродіння виноградного соку 3
6) Скисання молока 4
Швидкістю хімічних реакцій називають швидкість зміни концентрації реагуючих речовин за одиницю часу.
![]() ,
,
де v – швидкість хімічної реакції, c1 та c2 – початкова та кінцева концентрація (відповідно), t1 та t2 – початковий та кінцевий час (відповідно) , ![]() – зміна концентрації,
– зміна концентрації, ![]() – проміжок часу .
– проміжок часу .
Вивченням швидкості хімічних реакції займається спеціальний розділ хімії – хімічна кінетика. Серед учених, що зробили вагомий внесок у її розвиток, багато імен, зокрема: Якоб Вант-Гофф (перший лауреат нобелівської премії з хімії (1901 р), якої удостоєний був за ряд відкриттів, одне з яких правило, що носить його ім’я), Сванте Арреніус (лауреат нобелівської премії за відкриття в області розчинів, відкрив залежність миттєвої швидкості реакції від температури), а також Петер Вааге, М. М. Семенов та інші.
У житті часто виникає необхідність змінювати швидкість хімічних реакцій: сповільнювати чи навпаки, прискорювати. Для управління хімічними процесами важливо знати від яких факторів залежить швидкість реакції.
Водій керуючи автомобілем, використовує різні пристосування для зміни швидкості руху автомобіля (коробку передач, зчеплення, гальма, "газ").
Щоб керувати хімічним процесом також необхідно змінювати швидкість хімічної реакції. Які ж "пристосування" можна використати для зміни швидкості хімічної реакції?
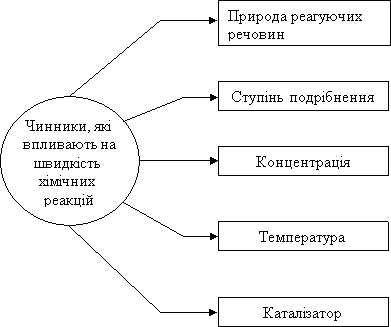 Давайте більш детально зупинимось на впливі кожного фактору.
Давайте більш детально зупинимось на впливі кожного фактору.
А зараз, ви у своїх групах виконаєте досліди, що продемонструють вплив різних факторів на швидкість реакції . Після виконання досліду ви оформите звіт і зробите висновки. Запишіть рівняння проведених вами хімічних реакцій.
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й природи реагуючих речовин на швидкість хімічної реакції.
Завдання 1. Дослідіть вплив площі поверхні контакту реагентів на швидкість хімічної реакції.
В одну пробірку покладіть грудочку крейди з приблизним діаметром 0,5 см, у другу – порошок крейди, рівноцінний за масою грудочці. В обидві пробірки обережно додайте близько 2 мл хлоридної кислоти. Зверніть увагу в якій із пробірок реакція відбувається швидше.
Висновок: Чим більша площа частинок реагенту, тим Швидкість реакції більша, де більша площа стикання реагентів (де порошок).
Завдання 2. Дослідіть вплив концентрації речовини на швидкість хімічної реакції.
У дві пробірки налийте по 1 мл хлоридної кислоти. Одну з порцій розбавте водою вдвічі. У кожну з пробірок (обережно!) помістіть по гранулі цинку та спостерігайте, з однаковою чи різною швидкістю відбуваються реакції в обох пробірках. Здобуті результати обґрунтуйте та зробіть висновок про вплив концентрації хлоридної кислоти на швидкість хімічної реакції.
Висновок: Чим менша концентрація кислоти, тим швидкість менша.
Завдання 3. Дослідіть залежність швидкості реакції від природи речовин
У 2 пробірки покладіть відповідно цинк і мідний дріт. Налити хлоридну кислоту. В якій пробірці реакція відбувається найшвидше?
Сu + HCl →
Zn + 2HCl → ZnCl2 + H2↑
В залежності від місця у ряді активності металів , реакції відбуватимуться з різною швидкістю.
Прошу лідерів кожної з сусідніх груп ознайомити усіх учнів з результатами діяльності своєї групи. Усі висновки мають бути записані в конспектах. 5хв.
Але, на швидкість реакції впливає ще й температура і ви це добре знаєте. Кожного ранку ви п’єте чай і добре знаєте, що цукор краще розчиняється у гарячій воді, ніж у холодній.
А от наскільки краще, цим питанням займався Вант Гофф.
Існує правило Вант Гоффа:
При підвищенні температури на кожні 100 швидкість хімічної реакції збільшується в 2-4 рази. ![]()
Це ЦІКАВО!!!!
Під час проведення деяких операцій на серці та мозку пацієнтів охолоджують для того що сповільнити реакції, які відбуваються в організмі людини.
V. Закріплення вивченого матеріалу.
Прошу виконати самостійну роботу. 3 хв.
Групи обмінюються зошитами і лідери сусідніх груп перевіряють відповіді, а результати заносять до бланку відповідей.
- Швидкість реакції – це… (0, 5 б.)
- Швидкість реакції залежить від природи реагуючих речовин, температури, …., ….. (0, 5 б.)
- Що згоряє швидше дерев’яна дошка чи дерев`яні ошурки? (0, 5 б.)
- У якому стані частинки речовини мають найменшу швидкість? (0, 5 б.)
- Зі зростанням температури швидкість реакції…(0, 5 б.)
- Зі зростанням площі поверхні контакту реагентів швидкість реакції… (0, 5 б.)
- Чому влітку зростає небезпека харчових отруєнь? (1 бал)
8. Чому термін служби мідних водопровідних труб значно більший порівняно зі сталевими? (1 бал)
Всього 5 балів
VІ. Підбиття підсумків уроку.
VІІ. Домашнє завдання.
Опрацювати § 19, с. , з.№
Задача.
На чавунному візку за 100 годин утворилася іржа масою 300 мг. А на сталевому з такою самою площею – за 200 годин 200мг. У якому випадку швидкість корозії більша?
υ1= m/t υ1= 300мг/100год.=3мг/год.
υ2= 200мг/200год.=1мг/год.
Отже, у першому випадку швидкість корозії вища, ніж у другому у 3 рази.

про публікацію авторської розробки
Додати розробку
