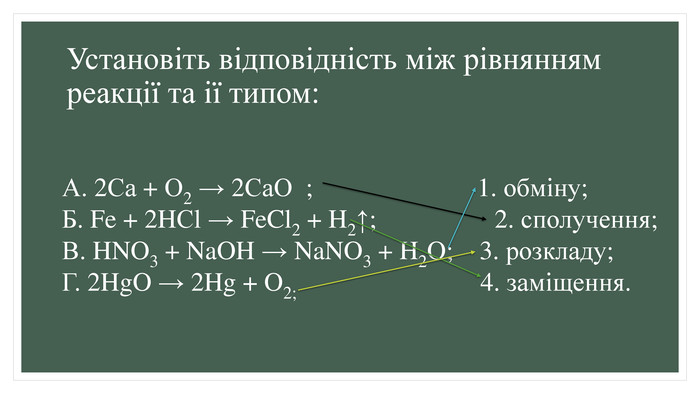
Узагальнення й систематизація знань з теми «Хімічні реакції»
Про матеріал
Мета уроку
повторити і узагальнити знання про хімічні реакції
вдосконалити ваше вміння писати рівняння хімічних реакцій та класифікувати їх за
різними ознаками;
підготуватися до контрольної роботи.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку