Відкритий урок 9 клас Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: реакції сполучення, розкладу, обміну, заміщення.
Відкритий урок 9 клас
Тема: Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: реакції сполучення, розкладу, обміну, заміщення.
Мета:
навчальна: поглибити знання учнів про класифікацію хімічних реакцій за різними ознаками, удосконалити навички складання рівнянь хімічних реакцій, узагальнити й систематизувати знання учнів про типи хімічних реакцій за складом вихідних та кінцевих речовин, формувати навички розпізнавання типів реакцій теоретично - за рівняннями реакції, експериментально - за ознаками хімічних реакцій;
розвивальна: розвивати навички і вміння складати рівняння хімічних реакцій, розвивати логічне мислення учнів, навички самостійної пізнавальної діяльності;
виховна: сприяти формуванню наукового світогляду учнів; виховувати вміння роботи в колективі, формувати здоров'язберігаючу компетентність.
Медіапрезентація додається.
Тип уроку: урок вивчення нового матеріалу
Форми роботи: розповідь учителя, проблемне запитання, демонстраційний експеримент, групова робота, фронтальна робота, робота з підручником.
Методи та методичні прийоми: «Асоціативний кущ», гра «Чому вони разом?», гра «Хімічне лото», «Вільний мікрофон».
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, мультимедійна презентація до уроку, картки із опорною схемою.
Демонстрація 4. Реакції розкладу, сполучення, заміщення, обміну.
Для демонстрації дослідів: мідний дріт, порошок магнію, купрум(ІІ) сульфат, натрій гідроксид, сульфатна кислота, спиртівка, сірники, пробірки, тримач.
Структура уроку
І. Організаційний етап……………………………..1—2 хв.
ІІ. Актуалізація опорних знань……………………..5—6 хв.
ІІІ. Мотивація навчальної діяльності………………..2 хв.
IV. Повідомлення теми й мети уроку………………..2 хв.
V . Вивчення нового матеріалу…………… ……….21—23 хв.
VІ. Узагальнення й закріплення знань……………….5 хв.
VІI. Підсумок уроку………………………………2-3 хв.
VIІI. Рефлексія…………………………. ……..1 хв.
VIII. Домашнє завдання………………… ………1 хв.
Хід уроку
І. Організаційний момент. Слайд 1
Доброго дня! Сьогодні наш урок дещо незвичний і я дуже задоволена, що сьогодні з вами зустрілася. Мене звати Ірина Аркадіївна! Перш ніж розпочати заняття, давайте з'ясуємо з яким настроєм ви сьогодні прийшли.
У кожного з вас на столі є долоньки різних кольорів. Подумайте і підніміть долоньку того кольору, який зараз найбільше імпонує вашому настрою.
Жовтий - добрий настрій
Червоний - поганий настрій
Зелений - нейтральний
 Таким чином всі готові до активної взаємодії, тож нас чекає плідна робота. А щоб вона була для вас продуктивною протягом уроку за успішне виконання завдань ви отримаєте, «аурумчики».
Таким чином всі готові до активної взаємодії, тож нас чекає плідна робота. А щоб вона була для вас продуктивною протягом уроку за успішне виконання завдань ви отримаєте, «аурумчики».
Аурум-хімічний елемент,проста речовина (золото). Ті хто збере найбільше "золота" отримає найкращі оцінки.
ІІ. Актуалізація опорних знань.
Відомі сотні тисяч різноманітних речовин. Щоб розібратися в їх багатоманітності, вчені розподілили ці речовини по групам. Давайте згадаємо як поділяють речовини.
Завдання. Скласти «Асоціативний кущ» , до поняття речовина.
(З купи карток вибрати ті що пов'язані з записаним на дошці та вистроїти логічну схему). Додаток 1

Гра «Чому вони разом?» Слайд 2,3
- Na, C, H2, Fe (прості речовини)
- CaO, KOH, H2SO4, BaCO3 (складні речовини)
- FeO, P2O5, Al2O3, CO2 (оксиди)
- HCl, HNO3, H2SO4, H3PO4 (кислоти)
- NaOH, Ca(OH)2, Al(OH)3, Zn(OH)2 (основи)
- BaSO4, NaCl, CaCO3, Mg(NO3)2 (солі)
Хімічні властивості кожної речовини проявляються в хімічних реакціях за її участю.
Фронтальна робота: Слайд 4
Дайте відповідь на запитання:
Які ознаки хімічних реакцій? (зміна забарвлення, виділення газу, виділення світла і тепла, випадання осаду, поява запаху).
Що таке реагенти або вихідні речовини та продукти реакції? (Реагенти або вихідні речовини – це речовини, що вступають в хімічну реакцію, продукти – це речовини, що утворюються внаслідок реакції)
ІІІ. Мотивації навчальної діяльності. Слайд 5
 (Розповідь із «Клеопатри», Г.Р.Хаггарда)
(Розповідь із «Клеопатри», Г.Р.Хаггарда)
Стародавня легенда розповідає, що цариця Клеопатра, яка була відома не тільки своєю красою, а ще й освіченою, виграла оригінальне парі, з'ївши дорогоцінний «сніданок», який коштував 100 000 сестерцій.
Ось як це описано в книзі Генрі Хаггарда «Клеопатра»: «…Вона вийняла з вуха одну з тих величезних перлин і опустила перлину в оцет. Запанувала тиша, вражені гості, завмерши спостерігали, як незрівнянна перлина повільно розчиняється у міцному оцті. Від неї не залишилось і сліду, і тоді Клеопатра підняла келих, покрутила його і випила весь до останньої краплі».
Проблемне запитання.
Що сталося з перлиною? До якого типу можна віднести цю хімічну реакцію?
Щоб відповісти на ці питання здійснимо класифікацію хімічних реакцій.
ІV. Повідомлення теми та мети уроку Слайд 6
Розгортайте, будь ласка, зошити, запишіть число та тему над якою будемо працювати «Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: реакції сполучення, розкладу, заміщення,обміну»
Мета нашого уроку:
- Ознайомитись з ознаками класифікації хімічних реакцій:
- Навчитись розрізняти реакції сполучення, розкладу, заміщення,обміну;
- Вміти наводити приклади вивчених типів хімічних реакцій.
- Вивчення нового матеріалу.
V. Вивчення нового матеріалу
Кожна хімічна реакція індивідуальна,оскільки в неї беруть участь конкретні хімічні речовини з притаманними їм властивостями . Разом з тим, різні хімічні реакції мають багато спільних ознак, що дає змогу класифікувати їх на підставі тієї чи іншої ознаки.
Класифікація хімічних реакцій Слайд 7
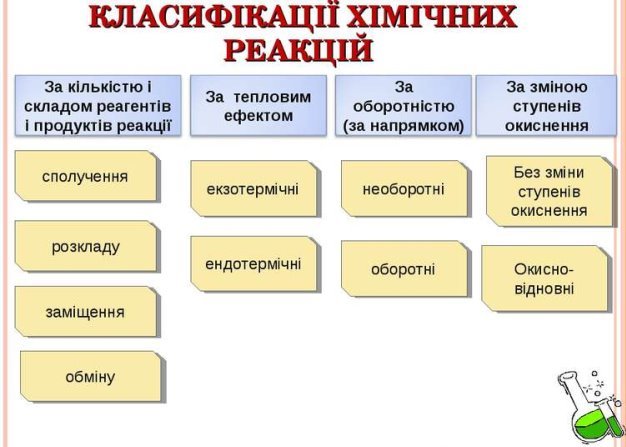
Робота з опорною схемою (Додаток 2): Слайд 8
Розглянемо на сьогоднішньому уроці першу класифікацію: за кількістю і складом реагентів і продуктів реакції .
Давайте пригадаємо які ж саме реакції називаються реакціями сполучення, розкладу, обміну та заміщення?
Запишемо схему класифікації в зошити Слайд 9
Хімічні реакції
(за кількістю і складом реагентів і продуктів реакції)
Сполучення Розкладу Заміщення Обміну
Робота з підручником.
П.П. Попель Хімія 9 кл. с.70-75 §13
Хімічний експеримент
Перейдемо до хімічного експерименту.
Перед проведенням хімічного експерименту, повторимо правила техніки безпеки.
Пам’ятка «Правила техніки безпеки» Слайд 10
- Речовини не можна брати руками й перевіряти їх на смак.
- Працювати в спеціальному одязі та рукавичках.
- Для з’ясування запаху речовин не можна підносити посудину близько до обличчя, тому що вдихання парів і газів може спричинити подразнення дихальних шляхів. Для ознайомлення із запахом потрібно долонею руки зробити рух від отвору посудини в бік носа.
- Без указівки вчителя не змішуйте не відомі вам речовини.
- Під час виконання дослідів користуйтеся невеликими дозами речовин.
- Особливої обережності дотримуйтесь під час роботи з кислотами й лугами. Якщо кислота або луг випадково потрапить на руки чи одяг, то негайно змийте їх великою кількістю води.
- Завжди користуйтеся тільки чистим лабораторним посудом.
- Залишки речовин не висипайте і не вливайте назад у посудину з чистими речовинами.
- Користуючись спиртівкою, не можна запалювати її від іншої спиртівки, тому що може пролитися спирт і виникне пожежа.
- Нагріваючи рідини, тримайте пробірку отвором від себе і не спрямовуйте її на сусідів.
- При нагріванні пробірки над полум’ям спочатку обережно прогрійте її по всій довжині у верхній частині полум’я, а потім продовжуйте нагрівати, не торкаючись дном пробірки до гнота спиртівки, щоб вона не тріснула… Тощо
Ваше завдання – уважно спостерігати, вести записи, складати рівняння реакцій і визначати їх тип.
Реакції сполучення - хімічні реакції, в результаті яких із двох або кількох речовин утворюється одна нова складна речовина. Слайд 11
А +В = АВ
Дослід 1. Візьмемо скручену мідну спіраль, закріпимо її в тигельних щипцях та нагріємо її на спиртівці. Нагріваємо у верхній частині (тому що найбільша t). Через деякий час ми будемо спостерігати зміну забарвлення і появу чорного кольору, на кінчику спіралі, який ми нагріваємо. Утвориться чорний наліт - це купрум (ІІ) оксид. Якщо почистити чорний наліт на білий листок паперу ми отримаємо порошок купрум (ІІ) оксид.
Запишимо рівняння реакції : 2Cu + O2=2CuO
Умови перебігу: нагрівання
Ознаки: зміна кольору
Тип реакції: сполучення.
______________________________________________________________
Реакції заміщення – хімічні реакції між простою і складною речовинами, під час яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини. Слайд12
А +ВС = АС + В
Дослід 2. У пробірку всипаємо невелику кількість порошку магнію. Після цього доливаємо сульфатної кислоти об'ємом 1 мл. Спостерігаємо виділення водню.
Умови перебігу: приведення в систему. Mg + H2SO4 → MgSO4 + H2↑
Ознаки: виділення газу
Тип реакції: заміщення
Проте не всі метали реагують із кислотами так, як у вищенаведених реакціях. Для передбачення можливості перебігу реакції між металом і кислотою користуються рядом активності металів. Метали, розміщені в ряду активності лівіше водню, реагують із кислотами з утворенням солі і виділенням водню. Аналогічно реагують метали із розчинами солей.
________________________________________________________________
Реакції обміну - хімічні реакції, під час яких дві речовини обмінюються своїми складовими частинками, утворюючи дві нові речовини. Слайд 13
АВ +СD = АD + CВ
Дослід 3. Візьмемо розчин натрій гідроксид і додамо розчин купрум сульфату (мідного купоросу). Спостерігаємо утворення драглистого осаду з блакитним забарвленням.
Ознаки: утворення осаду 2NaOH + CuSO4 =Cu(OH)2 + Na2 SO4
Умови перебігу: приведення в систему
Тип реакції – обміну.
________________________________________________________________
Реакції розкладу - хімічні реакції, в результаті яких із однієї складної речовини утворюється дві чи більше нових речовин. Слайд 14
АВ → А +В
Дослід 4. Візьмемо свіжоприготовлений розчин купрум (ІІ) гідроксид, який ми добули в попередньому досліді. Пробірку закріплюємо в пробіркотримачі і будемо нагрівати. Хочу нагадати, що дуже багато реакцій відбувається при нагрівані . Прогріваю всю пробірку, тримаю під кутом 450,а потім ту частину, де знаходиться речовина. Ми бачимо, що в пробірці утворюється речовина чорного кольору. Це відбувається розклад купрум (ІІ) гідроксиду на купрум (ІІ) оксид речовина чорного кольору та воду.
Умови перебігу: нагрівання Cu(OH)2 → CuO + H2O
Ознаки: утворення чорного порошку та води
Тип реакції: розкладу
VІ. Узагальнення й систематизація знань.
Робота в групах.
У вас на столах у роздатковому матеріалі лежить «Хімічне лото» (Додаток 3), необхідно знайти відповідність правої та лівої сторін.
А зараз ми перевіримо чи є виграшною складена вами комбінація?
Який тип рекції, складених вами рівнянь? Слайд 15-18
VІІ. Підсумок уроку Слайд 19
Повернемось до нашої легенди про Клеопатру.
Проблемне запитання.
Що трапилось з перлиною?
Очікувана відповідь: Слайд 20 перлина складається з кальцій карбонату - вона розчинилася у кислоті: СаСО3 + 2HCl →CaCl2 + H2O + CO2↑ - реакція обміну, некаталітична, екзотермічна, необоротна.
VІІІ. Рефлексія Слайд 21
«Вільний мікрофон». Завершіть речення:
- Як ви вважаєте, чи досягли ми очікуваних результатів? (Досягли)
- Я навчився розрізняти...
- Мені сподобалось...
- На мою думку, найкращими були...
- Мені сподобалось....
ІХ. Домашнє завдання: Слайд 21
- Вивчити із підручника Хімія 9 кл Н.М. Попель параграф 13 (с. 70-75), виконати вправи № 98(письмово).
- Творче завдання: скласти кросворд із словами, що зустрічаються в темі «Типи хімічних реакцій»
Мені сподобалось працювати з вами
Додаток 2
Хімічне лото
І група – реакції сполучення
3Fe+ 2O2 →Fe3O4
2H2+O2 →2H2O
SO3+H2O → H2SO4
ІІ група – реакції розкладу
2KMnO4 → K2MnO4+ MnO2 +O2
2NaNO3 → 2NaNO2 + O2
2H2O → 2H2+O2
ІІІ група – реакції заміщення
Fe + CuSO4 → Cu + FeSO4
Fe + 2HCl → FeCl2 + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
ІV група – реакції обміну
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
NaOH + HCl → NaCl + H2O
BaCl2 + H2SO4 → BaSO4↓ + 2HCl








Опорна схема Додаток 3
Додаток 1















1

про публікацію авторської розробки
Додати розробку
