Відкритий урок у 8 класі "Кислоти, їхні склад і назви"
Урок з хімії на тему:
"Кислоти, їхні склад і назви"
(8 КЛАС)
Мета: освітня – сприяти розширенню знань про класифікацію неорганічних речовин на прикладі кислот, ознайомити учнів із поняттям „кислота”, класифікацією кислот за складом та номенклатурою кислот;
розвиваюча – розвивати логічне мислення, пам’ять, вміння визначати та класифікувати кислоти, давати назви кислотам; розвивати інтелектуальну культуру учня;
виховна – виховувати науковий світогляд, вміння брати відповідальність за прийняте рішення.
Тип уроку: урок засвоєння нових знань, урок – подорож.
Обладнання: ПСХЕ, зразки кислот, ноутбук, презентація «Кислоти».
Методи навчання: пояснювально – ілюстративні - бесіда, розповідь; наочні – демонстрація; практичні – виконання завдань; репродуктивні, інтерактивні.
Рефлексія: „Австралійський дощ”.
Хід уроку
1. Організаційний етап
Привітання, побажання здоров’я та успіху на уроці.
Доброго дня! Сідайте будь ласка. Черговий, скажіть, хто відсутній на уроці? (Слайд 1)
2. Перевірка домашнього завдання. Мотивація навчальної діяльності
На попередньому уроці ми вивчали «Основні класи неорганічних сполук», зокрема тему «Оксиди».
Сьогодні на уроці ми з вами здійснимо наукову подорож на „Хімічному експресі” у загадкову країну. Яку саме – ми дізнаємось пізніше.
Крім цього, під час нашої подорожі, за вашу активність, ви будете отримувати бали.
Рожевий колір – 1 бал;
Зелений колір – 2 бали;
Фіолетовий колір – 3 бали.
Проте, щоб наш поїзд-експрес рушив з місця, ви маєте отримати проїзні квитки.
(Роздаємо квитки із запитаннями. Щоб продовжити рух поїзда, учні повинні дати відповідь на запитання).
- На які дві групи поділяються всі речовини?
- Які речовини називаються простими?
- На які дві групи діляться прості речовини?
- Які речовини відносяться до складних?
- Які групи складних речовин ми вже вивчили?
- Що таке оксиди?
- На які групи поділяються оксиди?
- Який оксид найпоширеніший на Землі?
- Валентність Оксигену в оксидах становить?
- Як утворюються назви оксидів?
- Назвіть несолетворні оксиди.
- Дайте назву оксиду К2О.
3. Актуалізація опорних знань
Запитання. На основі знань, отриманих на попередньому уроці, можливо ви здогадуєтесь в яку країну ми помандруємо? (Слайд 2)
- Ні? Тоді дайте відповіді на запитання.

-
„Мозковий штурм”.
- Що спільного між лимоном, томатом, квашеною капустою, щавлем і кефіром? (кислий смак)
- Чому від кропиви подразнення шкіри? (до складу соку входить кислоти)
- Чому чай після додавання лимону світлішає? (кислота змінює забарвлення)
- Чому кефір, ряжанка, сметана, просто кваша відноситься до молочно – кислих продуктів? ( до їх складу входить молочна кислота)
- „Дешифрувальник”. За першими літерами назв хімічних елементів, вказаних порядкових номерів (ПСХЕ) назвати слово. (Слайд 3,4)
|
19 |
И |
16 |
3 |
8 |
22 |
13 |
(кислота)
- Повідомлення теми та мети уроку
Тема уроку: «Кислоти, їхні назви та номенклатура»
Мета уроку:
- розширити знання про складні речовини на прикладі кислот;
- вивчити склад і назви кислот;
- навчитися класифікувати кислоти. (Слайд 5)
5. Вивчення нового матеріалу
Отже, ви отримали перепустку для подорожі на „Хімічному експресі” по країні Кислоти. Потяг їде з певними зупинками. Кожна зупинка буде мати свої відомості та завдання.
- Зупинка „Понятійна”.
Бесіда: - Які асоціації викликає у вас слово „кислота”? (лимон, кислий)
Вправа: «Асоціативний кущ» (Слайд 6)
Розповідь: кислоти входять до складу фруктів, щавлю, шлункового соку. Всі вони поділяються на неорганічні та органічні кислоти. У 8 класі ви ознайомитеся з неорганічними кислотами.
Завдання: Знайдіть у підручнику (протягом 1 хв) та прочитайте визначення поняття „кислота”.
Всі разом говорять визначення.
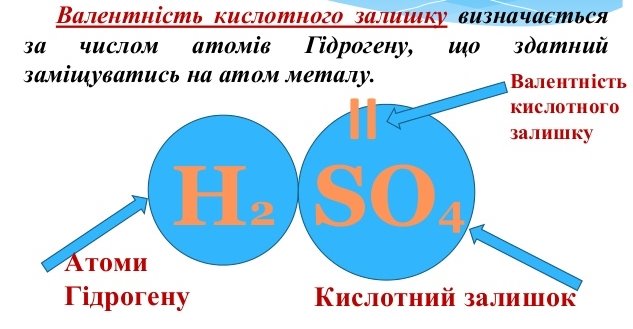
Кислоти – це складні речовини, що містять атоми Гідрогену, здатні заміщуватися на метал та кислотний залишок. (Слайд 7)
Нn КЗ
Валентність кислотного залишку дорівнює кількості атомів Гідрогену(n) у кислоті.
Наприклад: H2SO4 – cульфатна кислота
КЗ (валентність ІІ)
- Зупинка „Номенклатурна”.
- Хто знає, що означає назва зупинки? (номенклатура – порядок складання, написання та читання назв речовин)
В ході пояснення вчитель разом із учнями аналізує таблицю. (Слайд 8)
Таблиця
|
Формула кислоти |
Назва кислоти |
Кислотний залишок |
Валент- ність кислот-ного залиш-ку |
Назва солі |
Формула відповід-ного оксиду |
|
HCl |
Хлоридна (соляна) |
Cl- |
І |
Хлорид |
- |
|
HBr |
Бромідна |
Br- |
І |
Бромід |
- |
|
HI |
Йодидна |
I- |
І |
Йодид |
- |
|
HF |
Фторидна |
F- |
І |
Фторид |
- |
|
H2S |
Сульфідна |
S2- |
ІІ |
Сульфід |
- |
|
HNO3 |
Нітратна (V) (азотна) |
NO3- |
І |
Нітрат |
N2O5 |
|
H2CO3 |
Карбонатна (вугільна) |
CO32- |
ІІ |
Карбонат |
CO2 |
|
H2SiO3 |
Силікатна (кремнієва) |
SiO32- |
ІІ |
Силікат |
SiO2 |
|
H2SO3 |
Сульфітна (ІV) (сірчиста) |
SO32- |
ІІ |
Сульфіт |
SO2 |
|
H2SO4 |
Сульфатна (VI) (сірчана) |
SO42- |
ІІ |
Сульфат |
SO3 |
|
H3PO4 |
Ортофосфат-на (фосфорна) |
PO43- |
ІІІ |
Ортофос-фат (фосфат) |
P2O5 |
Сучасна назва кислот відповідає назві кислотних залишків, це необхідно пам’ятати, щоб добре засвоїти назви солей.
Демонстрація. Вчитель демонструє зразки кислот.
- Зупинка „Класифікаційна”.
Бесіда:
- Зверніть увагу на дані формули кислот. (Таблиця)
- Що спільного? (кожна має атоми Гідрогену)
- Чим відрізняються? (кількістю атомів Гідрогену та наявністю атомів Оксигену) (Слайд 9)
1) Класифікація за кількістю атомів Гідрогену
![]()
![]()
![]() к и с л о т и
к и с л о т и
одноосновні двоосновні трьохосновні
HBr, HCl H2S, H2CО3 H3РО4
2) Класифікація за наявністю атомів Оксигену
к и с л о т и
![]()
![]()
оксигеновмісні безоксигенові
H2CО3, HNО3 HBr, HCl, H2S
3) Класифікація за силою електроліту
к и с л о т и
![]()
![]()
сильні електроліти слабкі електроліти
HCl, H2SО4, HNО3 H2CО3, H2S
(Учні наводять приклади)
6. Закріплення та узагальнення знань
4. Зупинка „Ерудит”.
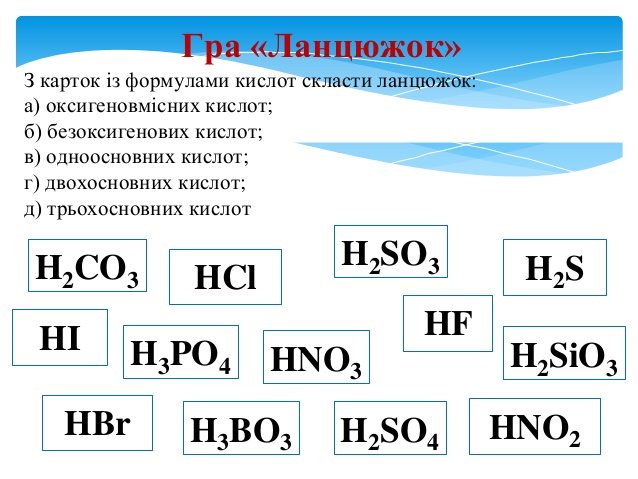
- „Впізнай”: з наведеного переліку формул виписати формули кислот та дати їм назви: СаО, H2SiО3, K2SО4, HNО3, NaОН, СО2, Н3РО4, H2S, AgCl, HF, H2О, HCl, LiОH, H2SО4. (Слайд 10, 11)
- „Третій зайвий”
а) H2S, Н3РО4, H2SО4; (H2S – безоксигенові кислота)
б) HNО3, H2CО3, Al(ОH)3; (Al(ОH)3 – не є кислота)
в) HF, H2SiО3, HNО3. (H2SiО3 – двоосновна кислота) (Слайд 12, 13)
3. „Хрестики – нулики”: знайти правильну відповідь.
|
Cl |
CО3 |
РО4 |
|
SО4 |
Br |
SiО3 |
|
S |
SО3 |
NО3 |
а)
а) Cl, Br, NО3 – одновалентні кислотні залишки. (Слайд 14, 15)
|
HBr |
HCl |
HI |
|
H2SО4 |
Н3РО4 |
HNО3 |
|
H2S |
H2SiО3 |
H2CО3 |
б)
б) HBr, HCl, HI – одноосновні кислоти. (Слайд 16, 17)
7. Рефлексія
- Зупинка „Рефлексивна”.
„Австралійський дощ”
(Слайд 18-20)



8. Підсумок
6. Зупинка „Кінцева”.
Наш „Хімічний експрес” їде в депо на відпочинок. Всі пасажири потягу підводять підсумки своєї діяльності.
Вчитель аналізує і проводить оцінювання. (Слайд 21)
9. Д/З.
- Переписати таблицю із формулами кислот в зошити.
- Вивчити формули й назви кислот.
- *Повідомлення „Кислоти в природі”.
- *Скласти казку (ребус) „Кислоти”.
1


про публікацію авторської розробки
Додати розробку
