Відкритий урок з теми: «ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ. КОРОЗІЯ МЕТАЛІВ, СПОСОБИ ЗАХИСТУ ВІД КОРОЗІЇ.»
Тема: Хімічні властивості металів. Корозія металів, способи захисту від корозії.
Мета: ознайомити учнів із загальними хімічними властивостями металів, рядом активності металів; показати взаємозв'язок між хімічними властивостями металів та будовою їхніх атомів; формувати уявлення про амфотерні властивості металічних елементів; властивостями, процесом руйнування металів під дією навколишнього середовища, основними способами захисту металів від корозії; розвивати навички складання рівнянь реакцій на прикладі властивостей металів; удосконалювати вміння спостерігати за перебігом реакцій і робити узагальнюючі висновки про відновний характер металічних елементів; виховувати уважність, старанність та акуратність у веденні записів, вміння працювати в групах та висловлювати власні думки.
Обладнання: періодична система хімічних елементів, ряд активності металів, відеодосліди, проектор, презентація.
Між предметні зв'язки: матеріалознавство, фізика, електротехніка, спецтехнологія.
Державний навчальний заклад
«Дніпрорудненський професійний ліцей»
Відкритий урок з теми:
«ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ. КОРОЗІЯ МЕТАЛІВ, СПОСОБИ ЗАХИСТУ ВІД КОРОЗІЇ.»
підготувала
викладач хімії
спеціаліст
Яненко О.А.
2017-2018 р.
Тема: Хімічні властивості металів. Корозія металів, способи захисту від корозії.
Мета: ознайомити учнів із загальними хімічними властивостями металів, рядом активності металів; показати взаємозв’язок між хімічними властивостями металів та будовою їхніх атомів; формувати уявлення про амфотерні властивості металічних елементів; властивостями, процесом руйнування металів під дією навколишнього середовища, основними способами захисту металів від корозії; розвивати навички складання рівнянь реакцій на прикладі властивостей металів; удосконалювати вміння спостерігати за перебігом реакцій і робити узагальнюючі висновки про відновний характер металічних елементів; виховувати уважність, старанність та акуратність у веденні записів, вміння працювати в групах та висловлювати власні думки.
Обладнання: періодична система хімічних елементів, ряд активності металів, відеодосліди, проектор, презентація.
Між предметні зв’язки: матеріалознавство, фізика, електротехніка, спецтехнологія.
Тип уроку: комбінований.
Очікувані результати:
Учні називають:
- сполуки металічних елементів за сучасною українською номенклатурою;
Учні складають:
- формули складних речовин, утворених металами;
- рівняння відповідних реакцій;
Учні характеризують:
- хімічні властивості металів;
Учні пояснюють:
- ознаки проходження хімічних реакцій.
ХІД УРОКУ
І. Організаційний момент.
ІІ. Перевірка домашнього завдання.
На попередньому уроці ми розпочали вивчати тему «Металічні елементи та їх сполуки», а саме вивчили їх місце положення у періодичній системі та їх фізичні властивості.
1. Фронтальна бесіда за питаннями.
- Сформулюйте визначення металічних елементів як простих речовин. (клас хімічних елементів і речовин з такими хімічними та фізичними властивостями: добре проводять електричний струм і тепло, мають металічний блиск, ковкі, пластичні)
- Який хімічний зв'язок існує в металах?
- Що називається металічним зв’язком?
- Які фізичні властивості металів обумовлені таким зв’язком?
- Чи потрібні вам знання про будову та фізичні властивості в майбутній професії?
2. Тестове завдання «Хімічний калейдоскоп» ( слайд №2)
Вказати правильні відповіді, 12 тестових завдань, правильна відповідь – 1 бал
1) Метал з найвищою електропровідністю (Cu, Al , Ag )
2) Найважчий метал (Al, Os, Fe)
3) Найлегший метал ( Na, Li, K)
4) Найпластичніший метал ( Au, Fe, Cu )
5) Рідкий метал за нормальних умов ( Ga, Cs, Hg )
6) Найтвердіший метал ( Cr, W, Ta)
7) Найм’якіший метал ( K, Na, Pb)
8) Кольоровий метал ( Сu, Al, Fe)
9) Найбільш тугоплавкий метал ( Ba , W, Ti)
10) «Найчорніший» метал ( Na, Ca, Fe)
11) Метал – феромагнетик ( Co, Ni, Fe ) (речовини, які здатні намагнічуватися)
12) Метал жовтого кольору ( Pt, Au, Cs )
Перевірка виконання роботи ( слайд № 3).
ІІІ. Мотивація навчально-пізнавальної діяльності.
Ваша майбутня професія безпосередньо пов’язана з металами, з яких виготовляють електровози та їхні складові частини, тому сьогодні Ви повинні усвідомити, що корпуси електровозів, металеві деталі, крім фізичних впливів (деформація, тертя, механічного пошкодження – подряпин), зазнаватимуть і впливу різних хімічних речовин.
Отже, об’єкт нашого вивчення на сьогоднішньому уроці – металічні елементи, а саме – їх хімічні властивості.
Повідомлення теми та мети уроку (Слайд № 1).
Гасло уроку : «Розум полягає не лише в знанні, а й в умінні застосовувати знання для справи». Арістотель (Записано заздалегідь на дошці).
План уроку ( запис на дошці)
- Взаємодія з простими речовинами.
- Взаємодія з складними речовинами.
- Амфотерність металів.
- Корозія металів. Захист від корозія.
IV. Вивчення нового матеріалу.
- Взаємодія з простими речовинами.
Найбільш енергійно метали реагують з неметалами (реакції сполучення). Розглянемо 2 випадки, більш детально ми вивчили в попередній темі.
а) взаємодія з галогенами:
- взаємодія калію з хлором (відеодослід №1)
- запис рівняння реакції ( учень на дошці)
2К + Cl2 = 2КClнатрій хлорид
- взаємодія заліза з хлором (відеодослід № 2) (реакцію записати самостійно)
2Fe + 3Cl2 = 2FeCl3 ферум(ІІІ) хлорид Ме окиснюються
б) взаємодія з киснем: ряд активності металів
- активні метали окиснюються швидко (Na-плавиться, К-вибухає)
- взаємодія з літієм
4Li + O2 = 2Li2O літій оксид
- Ме від алюмінію до Н окислюються повільно при нагріванні
2 Zn + O2 = 2 ZnO цинк оксид Ме є відновниками
- золото і платина не окиснюються
Висновок: метали окиснюються неметалами і є відновниками.
- Взаємодія з складними речовинами ( реакції заміщення).
а) взаємодія з водою.
- реагують неоднаково (ряд активності Ме)
- активні – до Аl – без нагрівання (Na – плавиться, К – з вибухом)
- взаємодія натрію з водою ( відеодослід №3)
2 Na + 2 H2O = 2NaOH + H2 ↑ натрій гідроксид (утв. газ)
- Ме до водню – при нагріванні .
Zn + H2O =t ZnO + H2 ↑ цинк оксид ( утв. газ)
- Ме після водню з водою не реагують
б) взаємодія з розчинами кислот ( відповідно до їх положення в ряді активності)
- Демонстрація №1. Взаємодія цинку з розчином хлоридної кислоти.
- Що спостерігаємо? Які ознаки проходження реакції? ( утв. газ)
Zn0 + 2 H+Cl- = Zn+2Cl2- + H20 ↑ цинк хлорид
Zn0 – 2 e- = Zn+2 відновник
2H+ + 2e- = H20 ↑ окисник
- Ме після водню з розчинами кислот не реагують
в) взаємодія з розчинами солей.
- Різниця в активності дозволяє одним металам витісняти інші з розчинів їх солей.
- Демонстрація №2. Взаємодія заліза з розчином купрум сульфату
- Що спостерігаємо? Які ознаки проходження реакції? (зміна кольору)
Fe + CuSO4 = Cu ↓ + FeSO4 ферум сульфат
Висновок: метали окиснюються при взаємодії зі складними речовинами і є відновниками
- Існує ряд металів (цинк, алюміній, берилій та інші), які взаємодіють і з кислотами і з лугами, таке явище називається амфотерністю.
- Демонстрація №3. Взаємодія цинку з лугом.
- Які ознаки проходження цих реакцій ( утв. газ)
- Є 2 рівняння реакцій взаємодії цинку з калій гідроксидом :
- 1 – спікання твердих речовин, утворюється сіль калій цинкат K2ZnO2
Zn + 2 KOH =t K2ZnO2 + H2 ↑
- 2 – у водному розчині, сіль іншого складу калій тетрагідроксоцинкат
- Zn(OH)2 + 2 KOH =t K2[Zn(OH)4]
Висновок: є метали, що мають амфотерні властивості – реагують і з кислотами і з лугами.
- Корозія металів, способи захисту від корозії.
Металеві конструкції широко використовуються в житті й діяльності людини. Близько 2 % залізних виробів щодня руйнуються через іржавіння заліза. У перерахуванні на кількість конструкцій це приблизно 3-5 млн. м3 залізобетонних конструкцій.
• Чому руйнуються металеві конструкції?
• Що необхідно зробити, щоби призупинити цей процес?
Розберемося в сутності цього процесу та знайдемо його причини.
Корозія — це хімічне або електрохімічне руйнування металів під дією навколишнього середовища.
Хімічна корозія — це процес руйнування металів під дією агресивного середовища (газу або рідини, вода, кисень, оксиди карбону і сульфуру, водні розчини солей).
![]()
Електрохімічна корозія — це процес, що протікає за наявності двох-трьох металів у середовищах з іонною провідністю. На аноді (більш активному металі) відбувається окиснення цього металу; на катоді (менш активному металі) — відновлення водню.
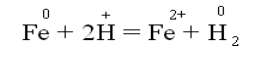
Способи захисту металів від корозії:
• Застосування захисних покриттів:
- нікелювання, хромування;
- лаки, фарби, емалі;
- захисні оксидні плівки (оксидування (Al2О3, Fe3О4));
- фосфатні покриття (ZnHPО4 + H3PО4).
• Сплави, стійкі до корозії (легування хромом Сг, нікелем Ni, вольфрамом W та ін.).
• Електрохімічні методи:
- заклепки з більш активного металу;
- пластини з більш активного металу;
- нейтралізація струму в разі корозії постійним струмом у протилежному напрямку.
• Зміна складу середовища, використання інгібіторів.
V. Закріплення та первинне застосування набутих знань
1. Складіть рівняння реакцій взаємодії металів з речовинами, назвіть речовини за сучасною українською номенклатурою ( робота в групах) .
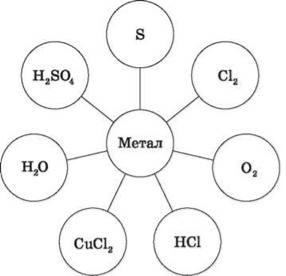
Метал: група 1– Са; група 2 – К; група 3 – Zn; група 4 – Na; група 5 – Mg; група 6 – Al.
Перевірка виконання завдань. (слайд № 18-24)
4.Вправа « Сьогодні на уроці я»: ( слайд № 25)
дізнався…
зрозумів…
запам’ятав…
навчився…
найбільші труднощі відчув…
не вмів , а тепер вмію…
мене найбільше вразило …
VI. Підсумки уроку.
Отже, сьогодні на уроці ми вивчили загальні хімічні властивості металів, вони є відновниками та окислюються неметалами, кислотами, лугами, розчинами солей.
На наступних уроках ми будемо детальніше вивчати хімічні властивості металів, а саме їх особливі властивості.
Оцінювання знань, умінь і навичок та коментар.
VII. Надання та пояснення домашнього завдання.
Дописати схеми реакцій, скласти хімічні рівняння:
- Pb(NO3)2 + Al =
- NaOH + Zn =
- K + H2O =
- H2SO4 (конц) + Bi =


про публікацію авторської розробки
Додати розробку
