Відносна густина газів
8 клас
Урок № 32
Тема: Відносна густина газів. Обчислення з використанням відносної густини газів.
Мета:
- освітня: сформувати знання учнів про поняття відносна густина газів; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною;
- розвиваюча: розвивати вміння розв’язувати задачі, визначати формули, хімічні символи елементів та записи речовин;
- виховна: виховувати самостійність, вміння працювати у колективі, дисциплінованість, раціональність у часі.
Матеріали та обладнання: періодична система хімічних елементів Д. І. Менделєєва, ручки, щоденники, робочі зошити.
Очікувані результати: називає хімічні речовини, знає їхні хімічні символи, використовує Періодичну систему як довідкову, обирає і обґрунтовує способи розв’язання питань, виробляє власні ставлення до природи як найвищої цінності; робить висновки на основі спостережень теми (за допомогою вчителя).
Ключові компетентності: спілкування державною мовою, уміння вчитися впродовж життя, математична, підприємливість.
Тип уроку: засвоєння нового матеріалу застосування набутих знань.
ХІД УРОКУ
І. Організаційний етап уроку
Привітання з учнями, відмічання відсутніх на уроці учнів у класному журналі.
II. Актуалізація опорних знань
 Гра «Куля питань»
Гра «Куля питань»
Вчитель обирає першого учня → задає питання за попередніми темами → кидає кульку → учень відповідає та кидає наступному учневі задаючи інше питання (у разі правильної відповіді учень може отримати 1 бонус=1 бал).
Вчитель контролює зароблені бонуси папірцями та фішками. Ці бонуси учні можуть використовувати протягом загальної теми.
III. Мотивація навчальної діяльності
Сьогодні, ми будемо продовжувати розв’язувати задачі та вивчати хімічні речовини. Але для цього нам потрібно відгадати загадки, щоб дізнатися про назви цих речовин.
Загадки
Учитель повідомляє учням, що
Учитель відгадайте будь ласка, про які елементи іде мова?
****
Я – найлегший елемент,
Електрон мій аргумент
Чи прийняти чи віддати? –
Це мене треба питати
Бо вирішую все я –
Особливість в цім моя. (Гідроген)
****
Я живу в квартирі вісім,
Як з’являється хтось лишень –
Вмить оксиди виникають
А інертників минаю. (Оксиген)
****
Кругом носа в’ється, а в руки не дається.
(Повітря, запах)
IV.Повідомлення теми, мети уроку
Вчитель оголошує тему уроку, записує тему на дошці.
V. Засвоєння нових знань
 Згідно з другим наслідком із закону Авогадро молярна маса речовини в газоподібному стані дорівнює його подвоєній густині D за воднем:
Згідно з другим наслідком із закону Авогадро молярна маса речовини в газоподібному стані дорівнює його подвоєній густині D за воднем: ![]() .
.
Аналогічно для повітря, молярна маса якого дорівнює 29 г/моль :
Mгазу = Мпов · Dпов = 29 · Dпов
Відносна густина D за будь-яким газом визначається експериментально, а потім визначається молярна маса газу.
Загальна формула для визначення відносної густини D одного газу за іншим матиме такий вигляд: 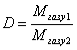 .
.
Наприклад, визначимо відносну густину фтору за повітрям. Для цього визначимо молярну масу фтору:
M(F2) = 2 · Ar(F) = 2 · 19 = 38 г/моль
Задача 1. Обчисліть відносну густину карбон(ІV) оксиду за киснем.
Розв’язання
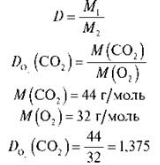
Відповідь: 1,375.
VІ. Узагальнення й систематизація знань
 Керована практика
Керована практика
Задача 2. Густина невідомого оксиду Нітрогену за воднем дорівнює 38. Обчисліть молярну масу цього оксиду, визначте його формулу.
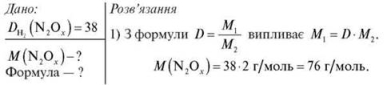
2) Визначаємо формулу. Складемо рівняння:
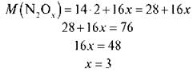
Відповідь: N2O3; M (N2O3) = 76 г/моль.
Задача 3. Обчисліть об'єм водню, що взаємодіє з киснем об'ємом 3 л.
 Дано:
Дано:
V(O2) = 3 л
V(H2) - ?
Розв’язання
Для розв'язання цієї задачі ми скористаємося наслідком із закону Авогадро — законом об'ємних відносин: «Об'єми газоподібних речовин, що беруть участь у реакції, співвідносяться між собою як відповідні стехіометричні коефіцієнти».
- 2Н2 + O2 = 2Н2O
За рівнянням: 2л 1л
За умовою: хл 3л
- Складемо пропорцію:
2/x = 1/3;
х = 6 л.
Відповідь: 6 л.
VІІ. Підсумок уроку
Вчитель пропонує учням скласти умову задачі на обчислення відносної густини.
VІІІ. Домашнє завдання
Параграф 22, Ст. 116-121, Впр.168,169


про публікацію авторської розробки
Додати розробку
