Використання інтерактивних схем для формування навичок мислення високого рівня
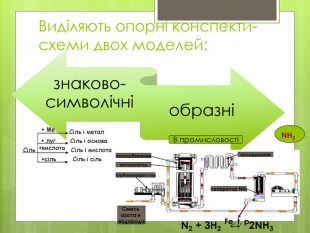
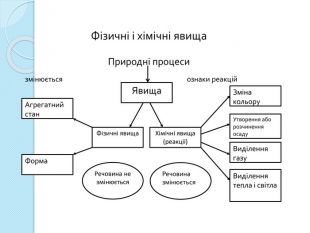
Процес навчання учнів є більш ефективним, коли він ґрунтується не тільки на викладанні матеріалу в традиційній формі, але й відображається у стислих конспектах або опорних схемах.














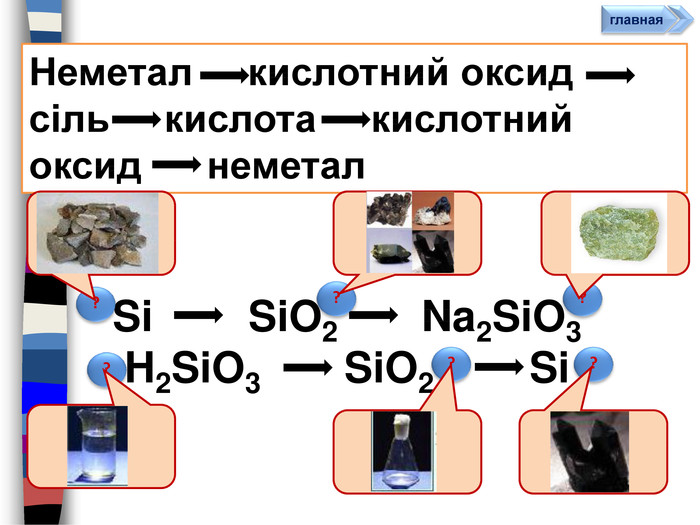
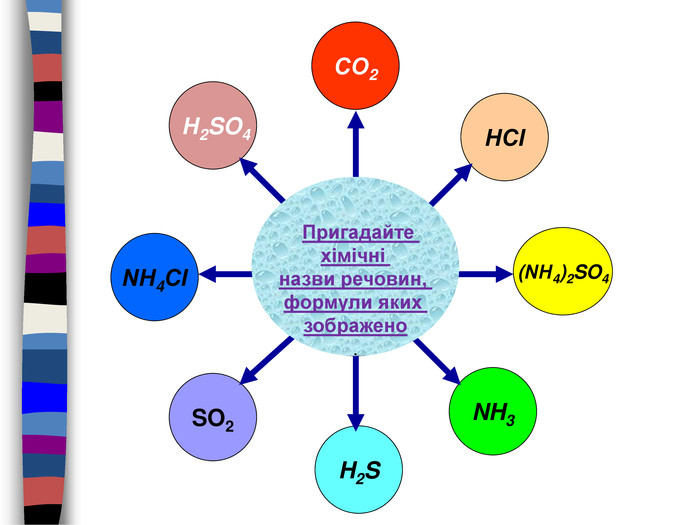


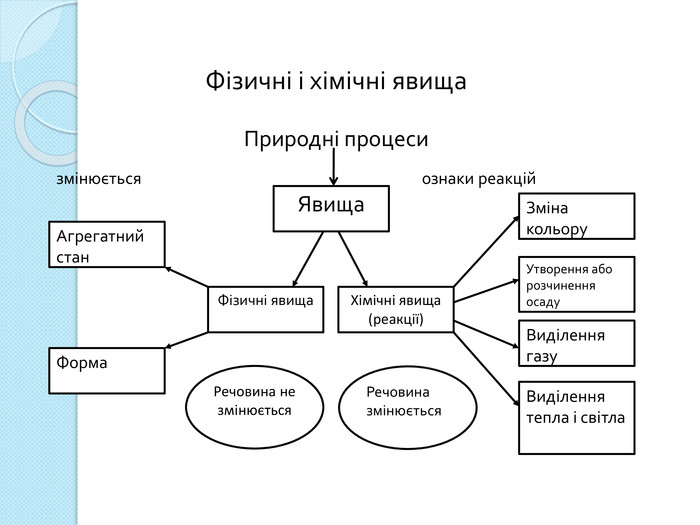
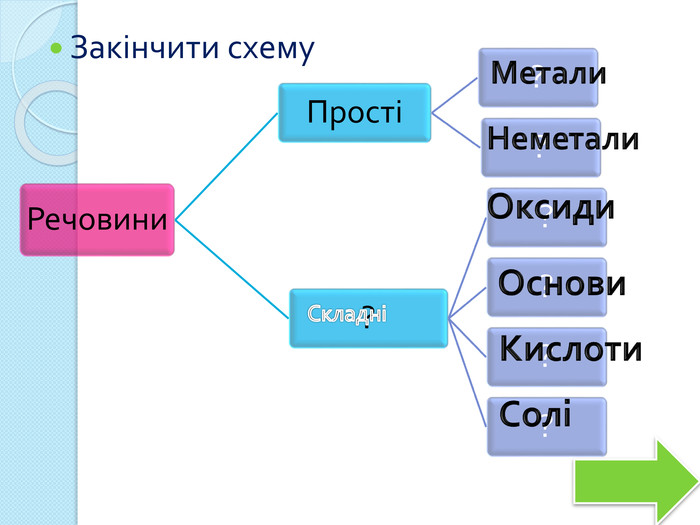

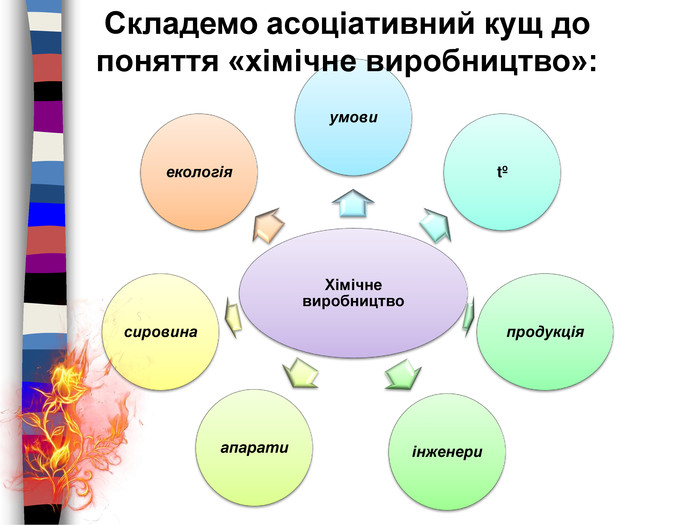



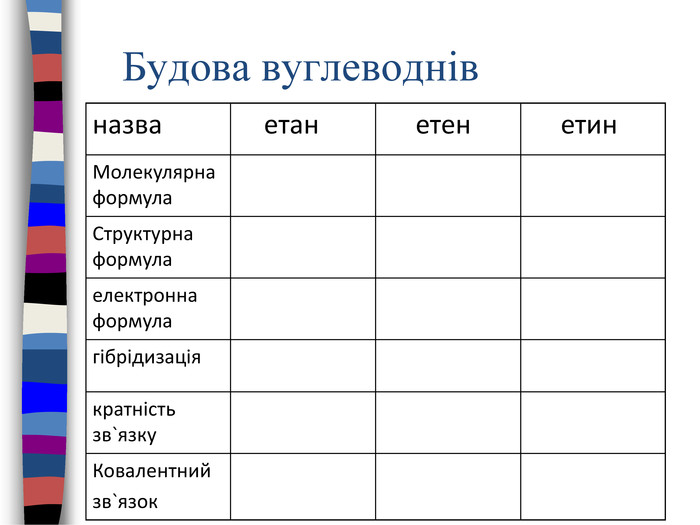
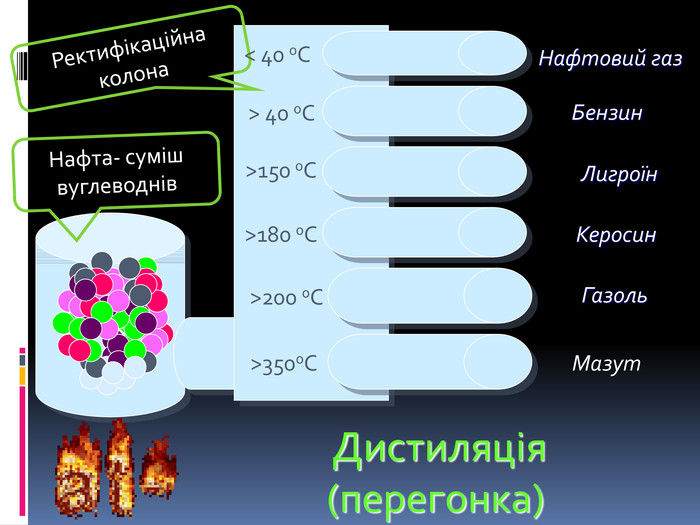
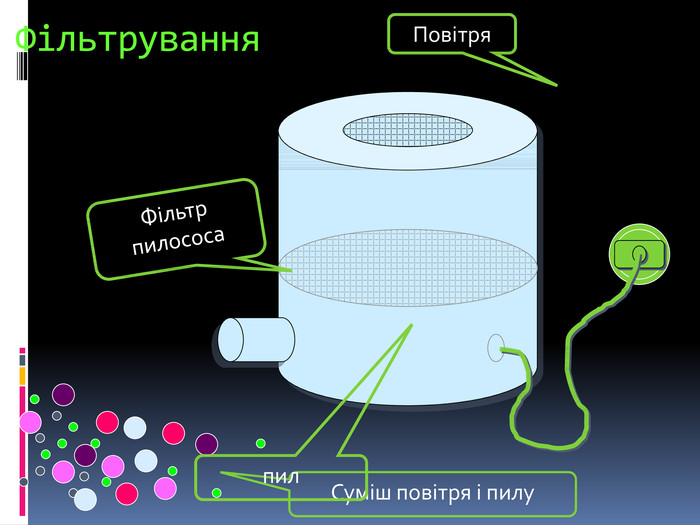
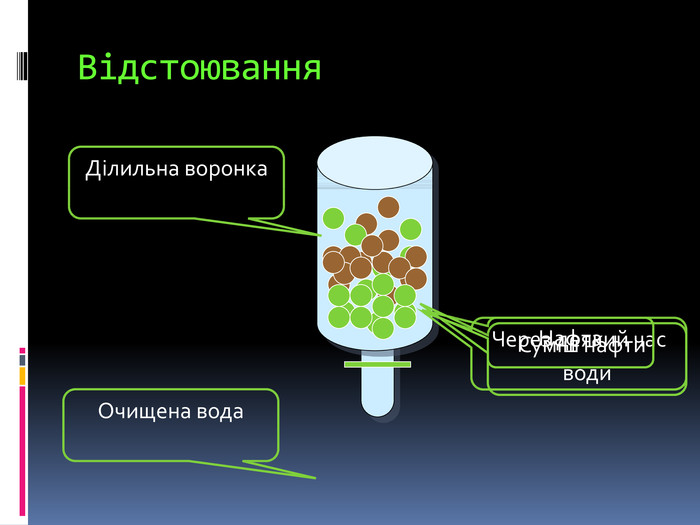



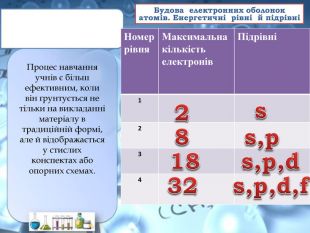
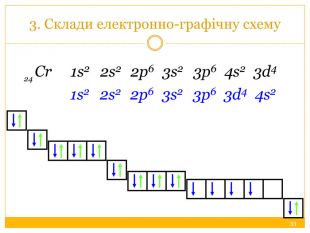
Процес навчання учнів є більш ефективним, коли він ґрунтується не тільки на викладанні матеріалу в традиційній формі, але й відображається у стислих конспектах або опорних схемах.{00 A15 C55-8517-42 AA-B614-E9 B94910 E393}Номер рівня. Максимальна кількість електронів Підрівні 1234281832ss,ps,p,ds,p,d,f. Будова електронних оболонок атомів. Енергетичні рівні й підрівніrrrrrrrr
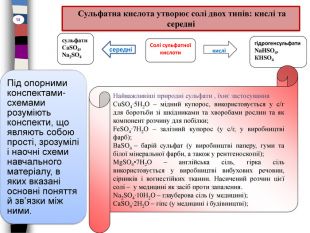
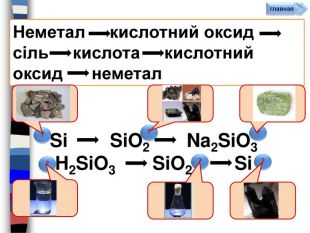
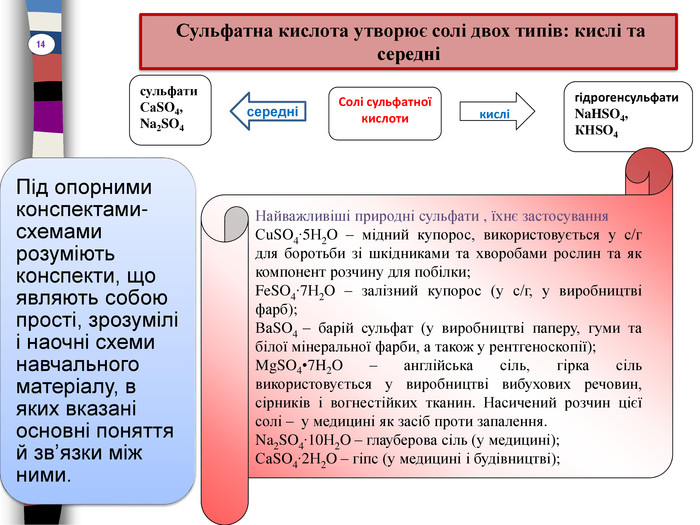
Сульфатна кислота утворює солі двох типів: кислі та середнісульфати. Са. SO4, Na2 SO4середніСолі сульфатної кислоти кислігідрогенсульфати. Na. HSO4,КHSO4 Найважливіші природні сульфати , їхнє застосування. Сu. SO4∙5 Н2 O – мідний купорос, використовується у с/г для боротьби зі шкідниками та хворобами рослин та як компонент розчину для побілки;Fe. SO4∙7 Н2 O – залізний купорос (у с/г, у виробництві фарб);Ва. SO4 – барій сульфат (у виробництві паперу, гуми та білої мінеральної фарби, а також у рентгеноскопії);Mg. SO4•7 H2 O – англійська сіль, гірка сіль використовується у виробництві вибухових речовин, сірників і вогнестійких тканин. Насичений розчин цієї солі – у медицині як засіб проти запалення. Na2 SO4∙10 Н2 O – глауберова сіль (у медицині);Са. SO4∙2 Н2 O – гіпс (у медицині і будівництві);
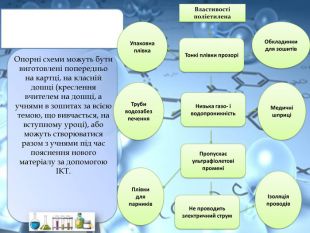
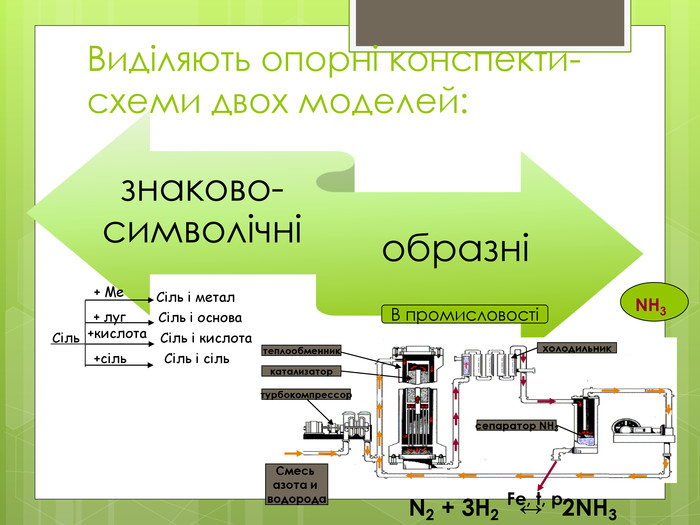
Опорні схеми можуть бути виготовлені попередньо на картці, на класній дошці (креслення вчителем на дошці, а учнями в зошитах за всією темою, що вивчається, на вступному уроці), або можуть створюватися разом з учнями під час пояснення нового матеріалу за допомогою ІКТ. Труби водозабезпечення. Обкладинки для зошитів. Плівки для парників. Медичні шприціІзоляція проводів. Упаковна плівка. Тонкі плівки прозоріНизька газо- і водопроникність. Пропускаєультрафіолетові променіНе проводитьэлектричний струм. Властивості поліетилена
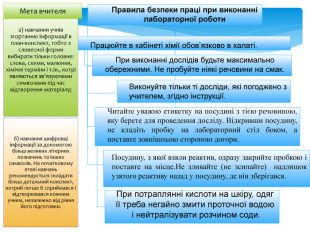
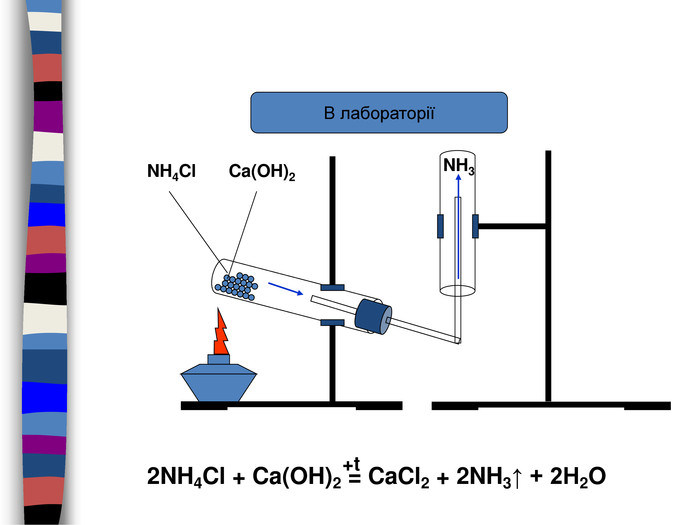
Правила безпеки праці при виконанні лабораторної роботи. Працюйте в кабінеті хімії обов’язково в халаті. При виконанні дослідів будьте максимально обережними. Не пробуйте ніякі речовини на смак. Виконуйте тільки ті досліди, які погоджено з учителем, згідно інструкції. Читайте уважно етикетку на посудині з тією речовиною, яку берете для проведення досліду. Відкривши посудину, не кладіть пробку на лабораторний стіл боком, а поставте зовнішньою стороною догори. Посудину, з якої взяли реактив, одразу закрийте пробкою і поставте на місце. Не зливайте (не зсипайте) надлишок узятого реактиву назад у посудину, де він зберігався. При потраплянні кислоти на шкіру, одяг її треба негайно змити проточної водою і нейтралізувати розчином соди. Мета вчителя
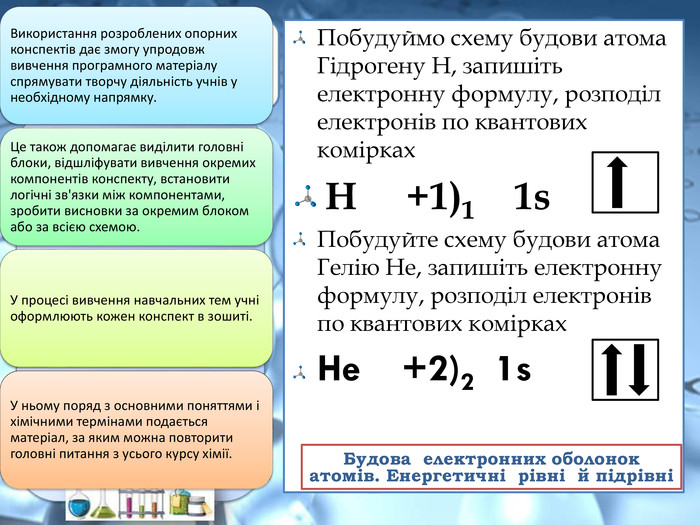
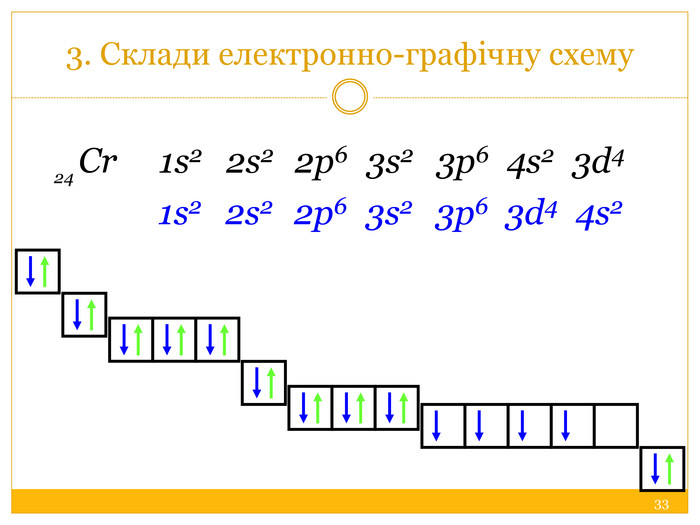
Побудуймо схему будови атома Гідрогену Н, запишіть електронну формулу, розподіл електронів по квантових комірках. Н +1)1 1s. Побудуйте схему будови атома Гелію Не, запишіть електронну формулу, розподіл електронів по квантових комірках. He +2)2 1s Будова електронних оболонок атомів. Енергетичні рівні й підрівні
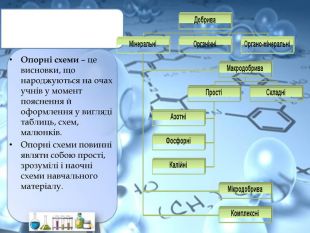
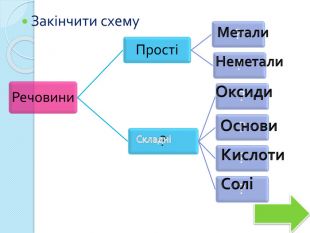
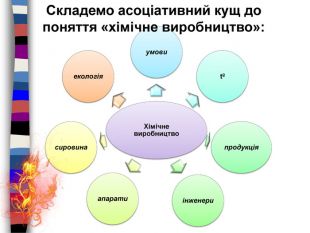
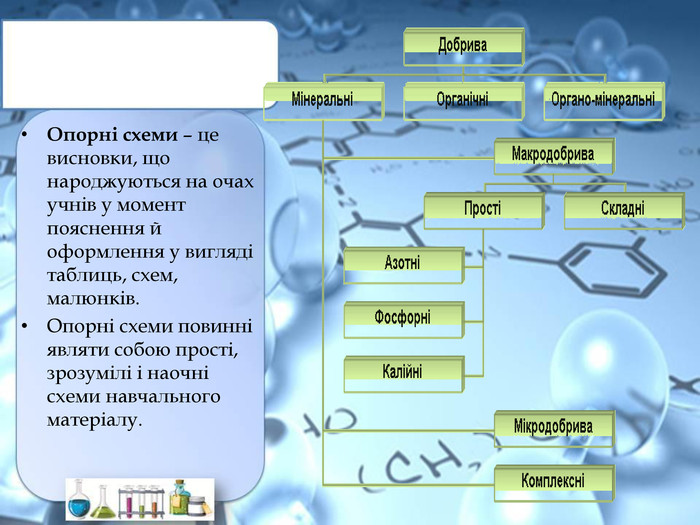
Використання схем. Загальні відомості про мінеральні добрива. Раціональне використання добрив та проблема охорони природи. Роль хімії у розв’язуванні продовольчої проблеми. Учитель складає опорні конспекти-схеми, щоб учні в узагальненому вигляді запам’ятали зміст навчальної теми (наприклад, основні положення хімічної теорії).
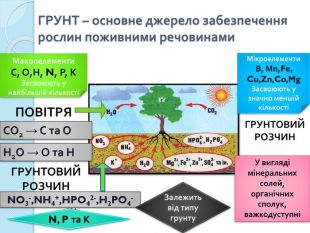
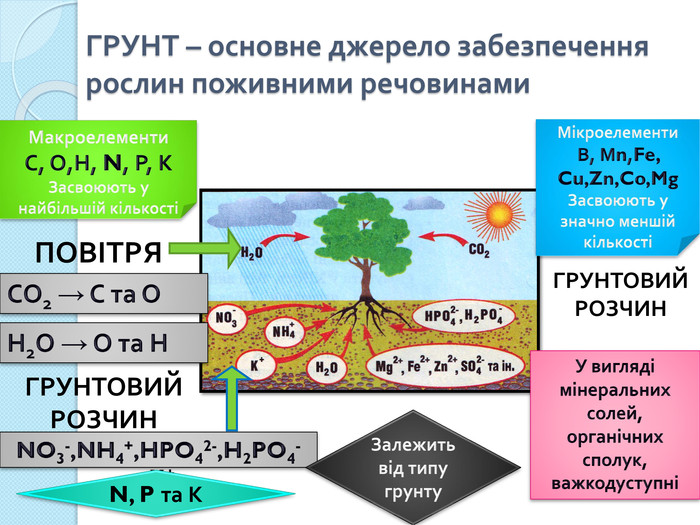
ГРУНТ – основне джерело забезпечення рослин поживними речовинами. Макроелементи. С, О,Н, N, Р, КЗасвоюють у найбільшій кількостіСО2 → С та ОН2 О → О та НПОВІТРЯГРУНТОВИЙРОЗЧИНNO3-,NH4+,HPO42-,H2 PO4-,K+У вигляді мінеральних солей, органічних сполук, важкодуступні N, P та КМікроелементи. В, Мn,Fe, Cu,Zn,Co,Mg. Засвоюють у значно меншій кількостіГРУНТОВИЙРОЗЧИНЗалежить від типу грунту
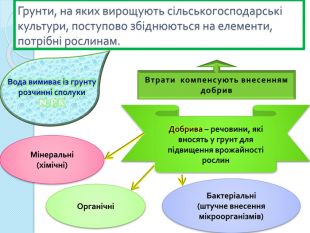
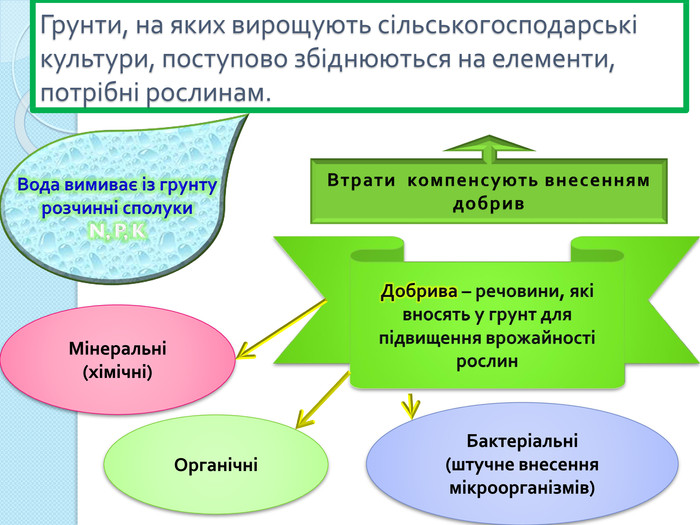
Грунти, на яких вирощують сільськогосподарські культури, поступово збіднюються на елементи, потрібні рослинам. Вода вимиває із грунту розчинні сполуки N, P, KВтрати компенсують внесенням добрив. Добрива – речовини, які вносять у грунт для підвищення врожайності рослин. Мінеральні(хімічні)ОрганічніБактеріальні(штучне внесення мікроорганізмів)
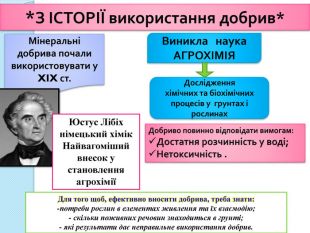
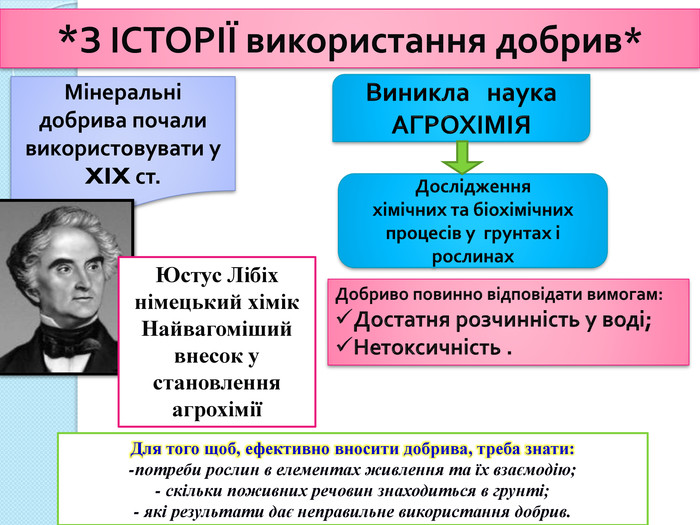
Дослідженняхімічних та біохімічних процесів у грунтах і рослинах*З ІСТОРІЇ використання добрив*Мінеральні добрива почали використовувати у XIX ст. Виникла наука. АГРОХІМІЯЮстус Лібіхнімецький хімік. Найвагоміший внесок у становлення агрохіміїДобриво повинно відповідати вимогам: Достатня розчинність у воді;Нетоксичність . Для того щоб, ефективно вносити добрива, треба знати:-потреби рослин в елементах живлення та їх взаємодію;- скільки поживних речовин знаходиться в грунті;- які результати дає неправильне використання добрив.
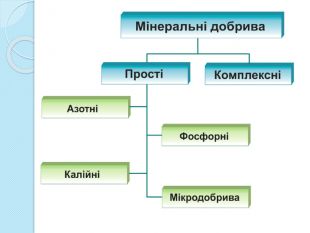
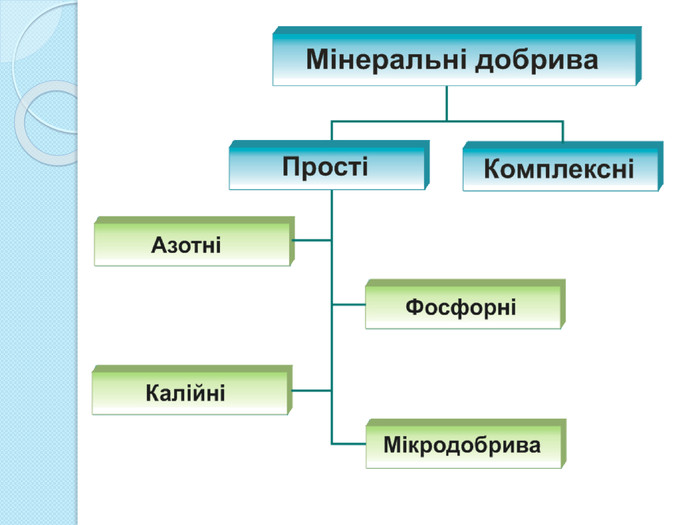
Мінеральні добрива. Добуті з надр чи промислово отримані хімічні сполуки Містять основні елементи живлення: Нітроген, Фосфор, Калій;Важливі для життєдіяльності мікроелементи: Купрум, Бор, Манган та ін. ПРОСТІКОМПЛЕКСНІМістять тільки один з основних елементів живлення. Містять не менше двох основних елементів живлення
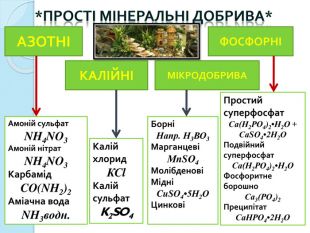
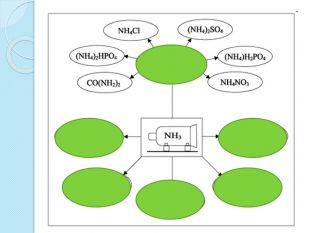
*ПРОСТІ МІНЕРАЛЬНІ ДОБРИВА*Амоній сульфат. NH4 NO3 Амоній нітрат. NH4 NO3 Карбамід. CO(NH2)2 Аміачна вода. NH3водн. АЗОТНІКАЛІЙНІФОСФОРНІМІКРОДОБРИВАКалій хлорид. КСl. Калійсульфат. K2 SO4 Простий суперфосфат. Са(Н2 РО4)2•Н2 О +Са. SО4•2 Н2 ОПодвійний суперфосфат. Са(Н2 РО4)2•Н2 ОФосфоритне борошно. Са3(РО4)2 Преципітат. Са. НРО4•2 Н2 ОБорніНапр. Н3 ВО3 МарганцевіМn. SО4 МолібденовіМідні Cu. SO4•5 Н2 ОЦинкові
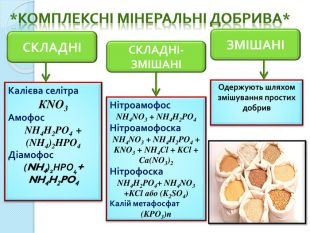
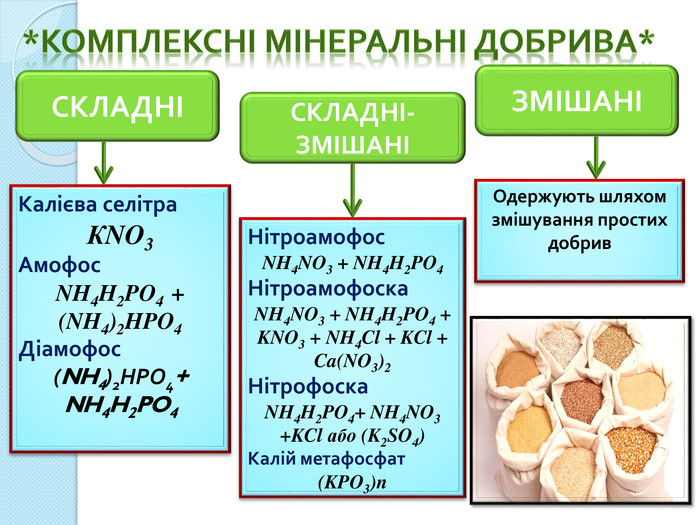
*Комплексні мінеральні добрива*СКЛАДНІСКЛАДНІ- ЗМІШАНІЗМІШАНІКалієва селітра. КNO3 Амофос. NH4 H2 PO4 + (NH4)2 HPO4 Діамофос(NH4)2 НРО4+NH4 H2 PO4 Нітроамофос. NH4 NO3 + NH4 H2 PO4 Нітроамофоска. NH4 NO3 + NH4 H2 PO4 + KNO3 + NH4 Cl + KCl + Ca(NO3)2 Нітрофоска. NH4 H2 PO4+ NH4 NO3 +KCl або (K2 SO4)Калій метафосфат(KPO3)n. Одержують шляхом змішування простих добрив
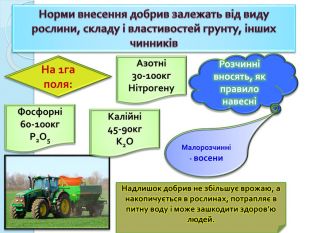
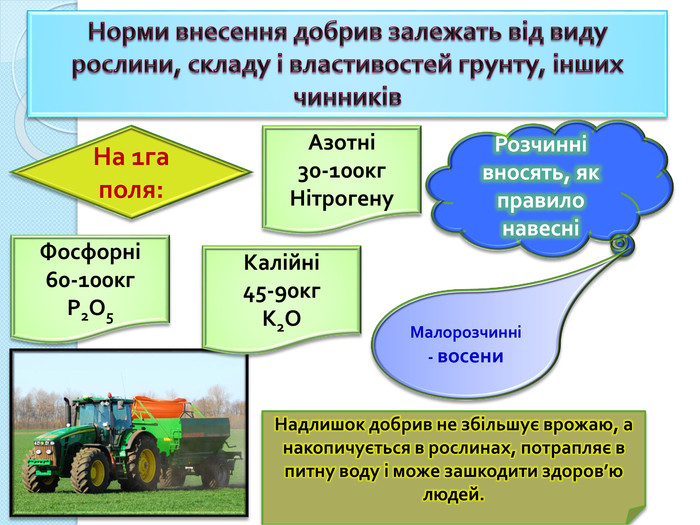
Норми внесення добрив залежать від виду рослини, складу і властивостей грунту, інших чинників На 1га поля: Азотні30-100кг. Нітрогену. Калійні45-90кг. К2 ОФосфорні60-100кг. Р2 О5 Розчиннівносять, як правило навесніМалорозчинні - восени. Надлишок добрив не збільшує врожаю, а накопичується в рослинах, потрапляє в питну воду і може зашкодити здоров’ю людей.
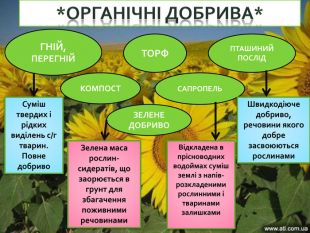
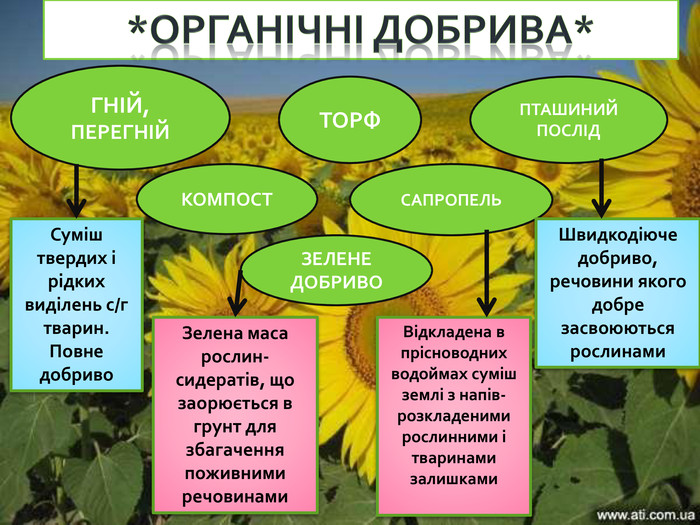
*ОРГАНІЧНІ ДОБРИВА*ГНІЙ,ПЕРЕГНІЙТОРФПТАШИНИЙ ПОСЛІДКОМПОСТСАПРОПЕЛЬЗЕЛЕНЕДОБРИВОСуміш твердих і рідких виділень с/г тварин. Повне добриво. Швидкодіюче добриво, речовини якого добре засвоюються рослинами. Відкладена в прісноводних водоймах суміш землі з напів- розкладеними рослинними і тваринами залишками. Зелена маса рослин-сидератів, що заорюється в грунт для збагачення поживними речовинамиrr
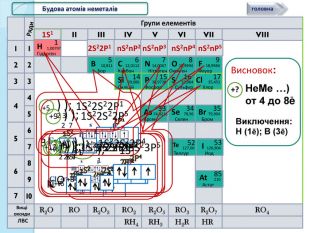
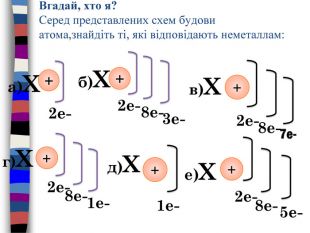
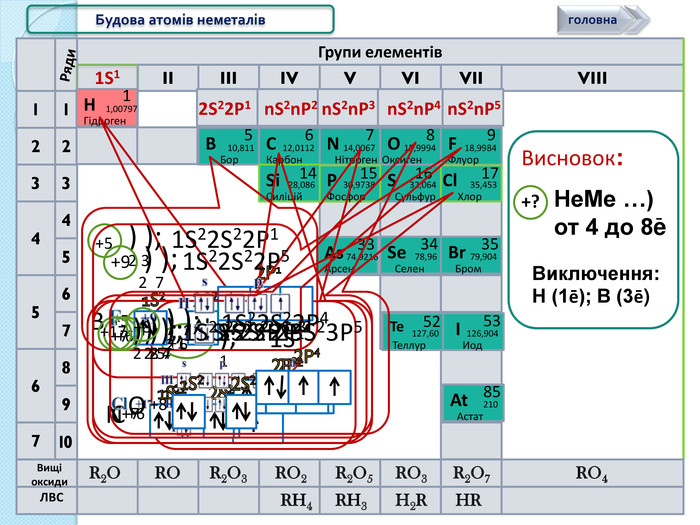
Периоды2134567128439567 IIVIVIIIIVVIIIГрупи елементів. VIISi1428,086 Силіцій30,9738 Р15 Фосфор S32,064 Сульфур16 Cl1735,453 Хлор 10 Ряди. N15,999418,9984 С12,01126 Бор10,811 Карбон5 ВF14,0067 Нітроген78 OОксиген. Флуор9 Br79,904 Бром35 I126,904 Иод53 Se78,96 Селен34 At210 Астат85 Te127,60 Теллур52 As74,9216 Арсен33 R2 OROR2 O3 RO2 R2 O5 RO3 R2 O7 RO4 RH4 RH3 H2 RHRВищі оксиди. ЛВСН1,00797 Гідроген1 Будова атомів неметалів1 S12 S22 P1n. S2n. P2n. S2n. P3n. S2n. P4n. S2n. P5 Не. Ме …) от 4 до 8e Висновок:+?Виключення: Н (1ē); В (3ē)1 S1+1);1 S1 Н +112 P12 S21 S21 S22 S2+5) );1 S22 S22 P1 В +52 32 P22 S21 S21 S22 S2+6) );1 S22 S22 P2 C +62 42 P32 S21 S21 S22 S2+7) );1 S22 S22 P3 N +72 5+9) );2 71 S22 S22 P5+17) ) ); 1 S22 S22 P63 S23 P52 8 7головна2 P42 S21 S21 S22 S2+8) );1 S22 S22 P4 O +82 6
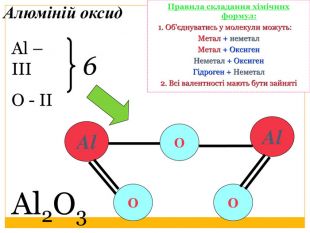
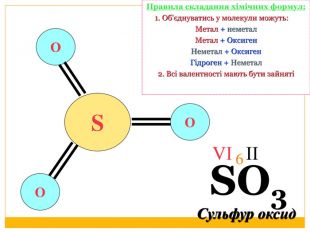
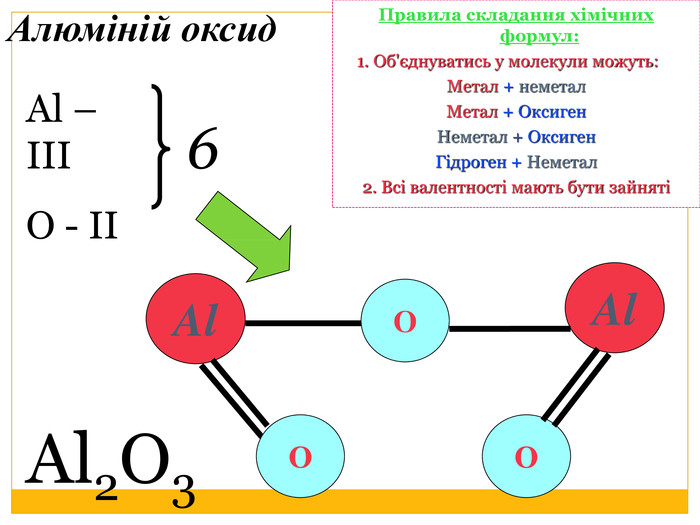
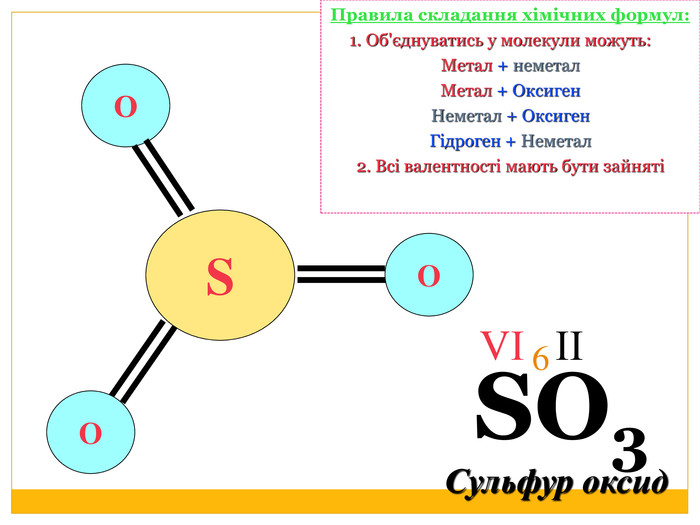
4. Визначити і записати найменше спільне кратне валентностей для двох елементів5. Розрахувати валентність невідомого елемента (Найменше спільне кратне / кількість атомів елемента з невідомою валентністю) Сульфур оксид. Визначення валентностей хімічних елементів за формулами речовин. SO3 Записати формулу речовини. Позначити відомі валентностіЗаписати загальну кількість валентностей відомого елемента (число валентностей х кількість атомів відповідного елемента)ІІ6 VІЗКВ (О) = 2 х 3 = 6 В(S) = 6 / 1 = 66
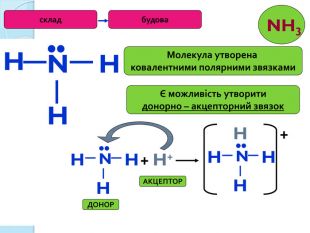
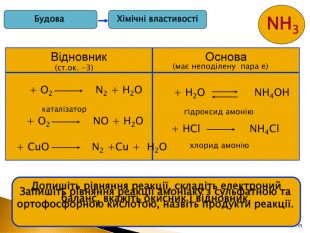
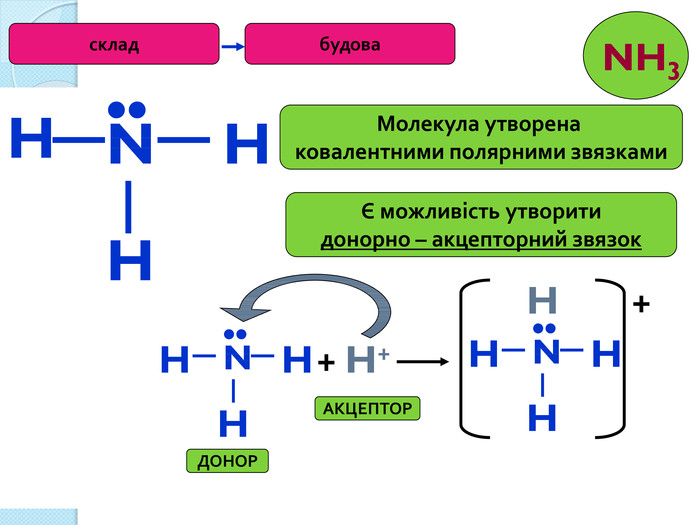
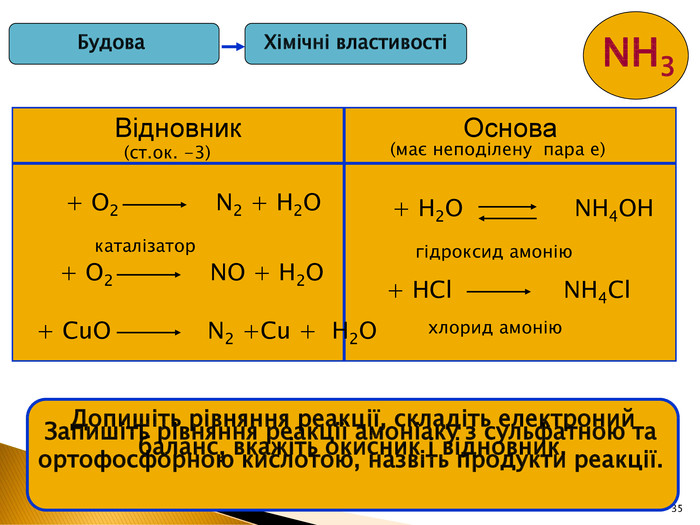
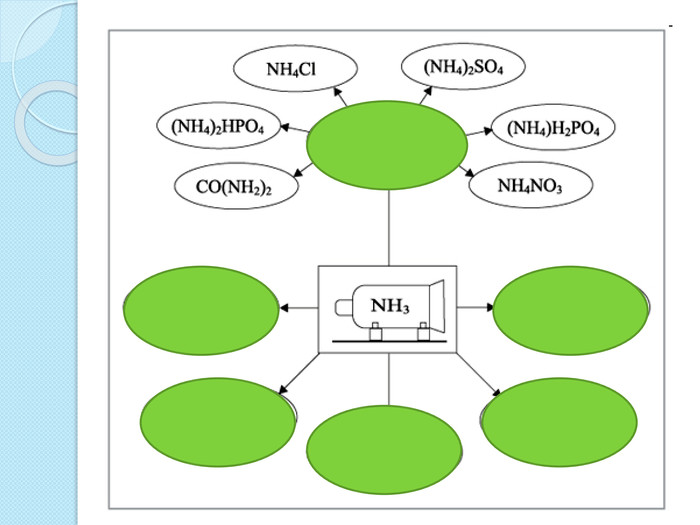
35 Хімічні властивостіБудова NH3 Відновник Основа (ст.ок. -3)(має неподілену пара е)+ О2 N2 + Н2 О+ О2 NО + Н2 Окаталізатор+ Cu. О N2 +Cu + Н2 ОДопишіть рівняння реакції, складіть електроний баланс, вкажіть окисник і відновник.+ HCl NH4 Cl+ H2 O NH4 OHгідроксид амоніюхлорид амонію. Запишіть рівняння реакції амоніаку з сульфатною та ортофосфорною кислотою, назвіть продукти реакції.
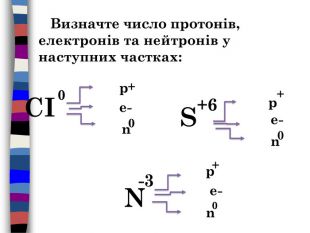
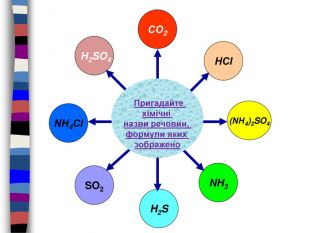
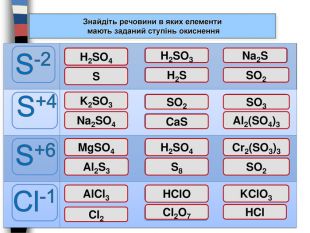
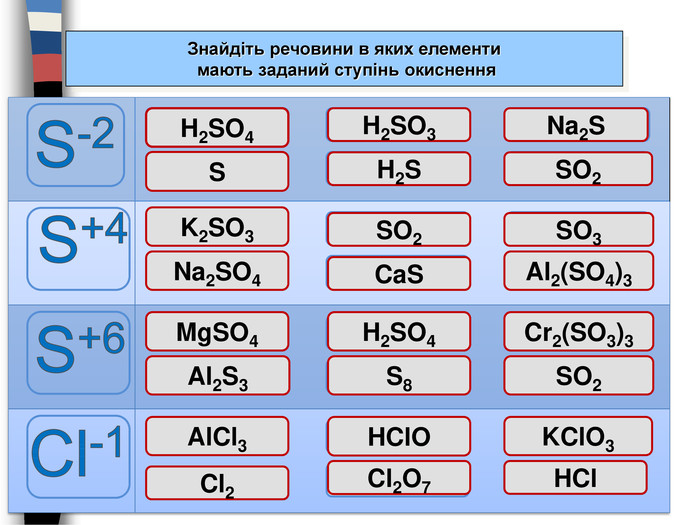
{3 C2 FFA5 D-87 B4-456 A-9821-1 D502468 CF0 F}S-2 S+4 S+6 Cl-1 Знайдіть речовини в яких елементи мають заданий ступінь окисненняпомилкавірновірнопомилкапомилкавірновірнопомилкапомилкапомилкавірнопомилкавірнопомилкапомилкапомилкавірнопомилкапомилкапомилкапомилкавірно. H2 SO3 Na2 SH2 SSO2 Na2 SO4 SO2 SO3 K2 SO3 Ca. SAl2(SO4)3 Mg. SO4 H2 SO4 Cr2(SO3)3 Al2 S3 S8 SO2 Al. Cl3 HCl. OKCl. O3 Cl2 Cl2 O7 HClпомилка. H2 SO4помилка. S
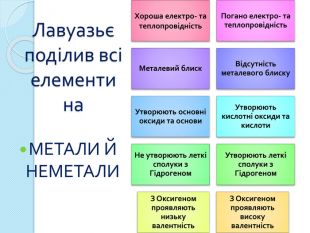
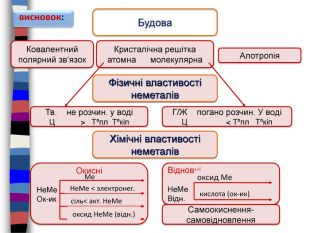
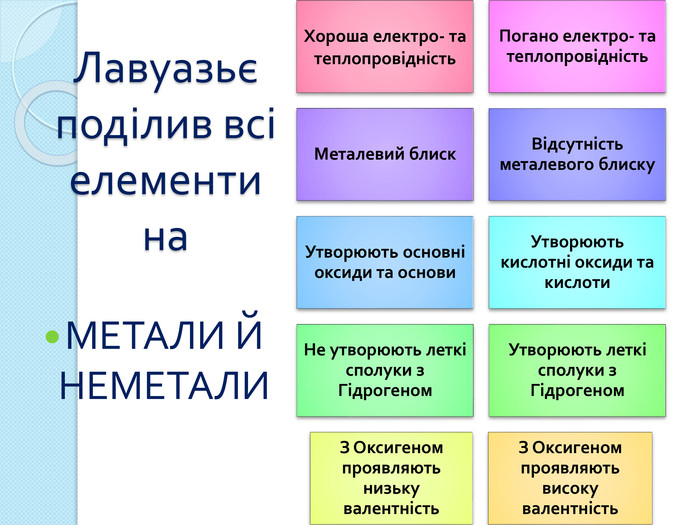
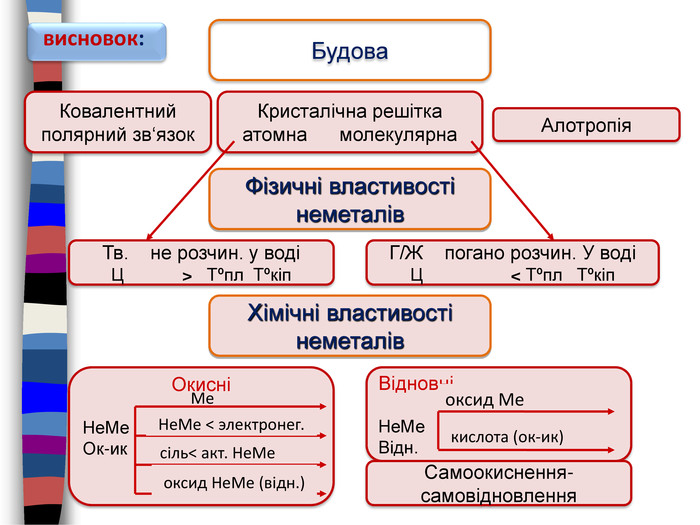
висновок: Будова Ковалентний полярний зв‘язок. Кристалічна решітка атомна молекулярна. Алотропія. Фізичні властивості неметалів. Тв. не розчин. у водіЦ > Tºпл Tºкіп. Г/Ж погано розчин. У водіЦ < Tºпл Tºкіп. Хімічні властивості неметалів. ВідновніНе. Ме. Відн.оксид Мекислота (ок-ик)ОкисніНе. Ме. Ок-ик. Ме. Не. Ме < электронег.сіль< акт. Не. Меоксид Не. Ме (відн.)Самоокиснення-самовідновлення
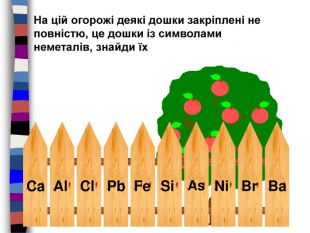
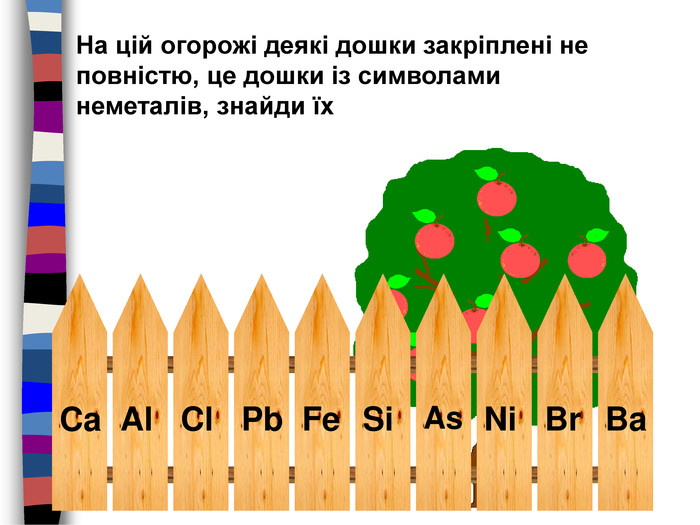
Pb. На цій огорожі деякі дошки закріплені не повністю, це дошки із символами неметалів, знайди їх. Ca. Cl. Fe. Si. As. Ni. Br. Al. Bastyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrr
Які геометричні фігури заховані в даних лабіринтах?{69 CF1 AB2-1976-4502-BF36-3 FF5 EA218861}Ba. Na. SCa. Al. Zn. Cl. Mg. NMn. Li. FFe. PAg. Co. OGa. Se. Pb. Cu. Au. Si. Cr. Ni{69 CF1 AB2-1976-4502-BF36-3 FF5 EA218861}Ba. Na. Mg. Ca. Al. Zn. Cl. SNMn. Li. FFe. PAg. Co. OSi. Se. Pb. Cu. Au. Ga. Cr. Ni


про публікацію авторської розробки
Додати розробку