Використання компьютера на уроках хімії. Добування кисню в лабораторії. Поняття про каталізатор.
Використання комп’ютера на уроках хімії.
Розробка уроку «Добування кисню в лабораторії з пероксиду водню.
Поняття про каталізатор».
За допомогою комп’ютера можна проводити уроки-лекції, уроки вивчення нового матеріалу, уроки узагальнення і контролю знань, уроки – міні проекти, уроки закріплення і вдосконалення знань, комбіновані уроки тощо.
На уроках доцільно використовувати презентації.
Комп’ютерна презентація – це файл, у якому зібране ідеї, плани, розробки для демонстрації аудиторії.
В презентаціях я указую мету уроку, цілі, завдання, очікувані результати. Також презентація відображає зміст матеріалу, наочність, демонстраційні експерименти, різні завдання , висновки, домашнє завдання. За допомогою презентації я також проводжую рефлексію і вправи - тренінги. Обов’язково проводжу рефлексію.
Алгоритм уроку вивчення нового матеріалу може бути таким:
![]() Тема
Тема
![]() Девіз уроку
Девіз уроку
![]() Мета
Мета
![]() Рефлексія
Рефлексія
![]() Очікувані результати
Очікувані результати
![]() Актуалізація
Актуалізація
![]() Вивчення
Вивчення
![]() Закріплення
Закріплення
![]() Висновки
Висновки
![]() Рефлексія
Рефлексія
Домашнє завдання
На кожному етапі уроку можна використовувати комп’ютер.
Наприклад: урок 7 класу «Получение кислорода в лаборатории разложением пероксида водорода. Понятие о катализаторе». Урок проводиться російською мовою.
Ход урока:
I. Мотивационный этап.
- Приветствие
- Проверка готовности
- Мотивация.

- Сегодня у нас не обычный урок, а урок-исследование. Что это значит? Это значит, что мы проведем лабораторную работу и узнаем, как получают кислород в лаборатории, что такое «катализатор». А еще мы побываем на рыбалке и пообщаемся с мотыльками! Вы готовы к уроку? Тогда , начинаем!
- Откройте тетради, запишите тему урока.
- На парте у каждого из вас есть лист саморрекции и самоконтроля, на котором вы будете отмечать все этапы урока. Подпишите их. Работать сегодня будем и индивидуально и в группах. В каждой группе есть руководитель, который направляет работу группы, назначает спикера, т.е. человека, который будет отвечать на вопросы, выходить к доске. Каждый из вас сегодня поработает и самостоятельно, напишет химический диктант. В листе самоконтроля мы будем делать отметки после каждого этапа урока, оценивая свои знания и выбирая пути коррекции знаний при необходимости.
-Руководители групп, получите задания для урока и маршрутный лист группы! (Руководитель групп получают задания).
- Девиз урока: Услышанное сто раз не сравнится с тем, что увидел хотя бы однажды. (Японская пословица).
- Сегодня мы не только увидим, как получают кислород в лаборатории, но и сами проведем эту химическую реакцию!

- Упражнение «Древо знаний».
- Ребята, на доске есть «Древо знаний», но оно потеряло все листочки! Зазеленеет ли оно вновь, зависит только от вас! У каждого на парте есть зеленый листочек. Напишите на листочке, что вы ожидаете от урока (учитель помогает с выбором варианта), подпишите его и приклейте под дерево. В конце урока, мы увидим, появятся ли эти листочки на веточках нашего дерева или нет.
II.Сообщение темы, цели, задач урока.
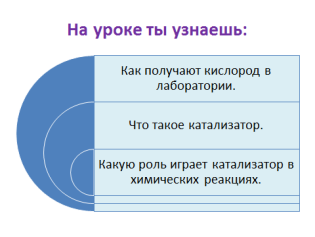
Тема нашего урока –«Получение кислорода в лаборатории. Катализатор». Значит, сегодня на уроке мы должны узнать:
- Как получают кислород в лаборатории.
- Что такое катализатор.
- Какую роль играет катализатор в химических реакциях.
- Катализаторы, только природные, есть и в наших организмах, потому важно знать, для чего он нужен .
- Чтобы это выяснить мы и проведем лабораторную работу.
- Психологический тренинг. Упражнение на положительный настрой на урок.
Ребята! Чтобы все новое заповнить лучше, мы проведем психологический тренинг, как спортсмены перед стартом, на положительный настрой к уроку. Повторяем все вместе!
Учащиеся все вместе повторяют за учителем :
Люблю я свій разум, внимание , пам'ять,
Работает мозг мой, учусь я старательно!
Учу я все новое, мыслю логічно,
Учителя слово исполню практично!


III. Актуализация опорных знаний. Проверка домашнего задания.
- Проанализируем теперь, а что мы знаем по этой теме, что не знаем, надо ли нам эту информацию знать? (Учащиеся высказываются). Сделайте отметки в листах самоконтроля: если вы уже что-то знаете , то поставьте «+», если хотите узнать, поставьте «+», а узнаете вы или нет, выясним в конце урока.

В листах самоконтроля:
Знаю Не знаю Хочу узнать Узнал
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\BEL0JE8F\original_smiley_face[1].png](/uploads/files/351509/119684/131143_html/images/119684.013.png)
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\U8KU9TQD\sad-smiley-picture[1].jpg](/uploads/files/351509/119684/131143_html/images/119684.014.jpg)
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\FZK0E3F4\small-questioning-face-small-webview[1].jpg](/uploads/files/351509/119684/131143_html/images/119684.015.jpg)
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\J528SO1E\danceW13[1].gif](/uploads/files/351509/119684/131143_html/images/119684.016.png)
Дети делают отметки в листах самоконтроля и самокоррекции.
- А проверить ваши знания мне поможет мудрая тетушка Сова! Для каждой группы она приготовила загадки! Давайте их отгадаем!

Загадка для группы № 1.

Адрес точный, если спросят:
32, 16, 8.
(Кислород).
Оксигена в периодической Обсуждение, что обозначают цифры 32, 16, 8, делаем ссылку на положение системе, его относительную атомную и относительную молекулярную массы.
Загадка для группы №2.
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без ……………
(Кислорода.)
Обсуждаем загадку, делаем вывод о роли кислорода для жизнедеятельности живых организмов, распространенности в природе.

Загадка для группы № 3.

Я коварный поджигатель, Вы
Огня хотите – нате! Я
Всесильный окислитель (если
Только дров дадите)…….
(Кислород).
Обсуждение свойств кислорода, условий горения.
Загадка для группы № 4.
Гулять в грозу – какой резон?
Подышим воздухом , дружище.
В природе словно стало чище,
Повсюду в воздухе …………….
(Озон).

Обсуждение состава молекул кислорода и озона, сравнение их физических свойств. Пояснить роль озонового слоя для Земли.


Игра «Рыбалка».

- Молодцы, ребята! Тетушка Сова вами довольна и приглашает вас на рыбалку! Правда, эта рыбалка не совсем обычная. Мы будем ловить не рыбу, а правильные ответы. Желающие пойти на рыбалку могут выйти к доске! По 1 учащемуся из команды выходят к доске и выполняют задание , по очереди перетаскивая слова, объясняя свой выбор.
Правильные ответы:
- О – Оксиген, 16, элемент, № 8, II, вода.
- О2 – кислород, дыхание, 32, воздух, горение, простое вещество.
Молодцы капитаны! А на рыбалке, на природе так много всего интересного: рыбки, птички, бабочки! И к вам прилетели мотыльки! Да не простые, а с заданиями и хотят проверить вашу эрудицию. Покажем им, что мы знаем?
Игра мотылек.

- Руководители групп, возьмите из пакета лист с игрой «Мотылек». Каждой группе мотылек принес вопрос. 1 минута на обсуждение. Отвечать будут
спикеры, которых назначит руководитель.( После обсуждения спикеры у доски дают ответы с пояснением)




![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\J528SO1E\189_1_main[1].jpg](/uploads/files/351509/119684/131143_html/images/119684.031.jpg)
Для ответов у каждой группы имеется шаблон, который дети заполняют при обсуждении.
ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА.
Кислород – это ………...... ( агрегатное состояние)
Цвет…………………………………………………
Запах………………………………………………..
Вкус……………………………………………………
В 1, 11 раза тяжелее…………………………………..
В воде………………………………………………….
При охлаждении …………………………………….
ПОЛУЧЕНИЕ КИСЛОРОДА
Кислород в лаборатории получают при помощи разложения …………………
…………………………………………………., например ……………………….
…………………………………………………………………………………….
Уравнение реакции:………………………………………………………………
Реакция разложения – это реакция, при которой из ………………………….
вещества получается ……………………………………………………………
КАК СОБРАТЬ КИСЛОРОД?
Кислород собирают двумя способами.
1. Вытеснением ………………., так как кислород нерастворим в …………….
2. Вытеснением …………………, так как кислород тяжелее…………………..
КАК ОБНАРУЖИТЬ КИСЛОРОД?
Кислород поддерживает дыхание и ……………………………….. Поэтому его можно обнаружить при помощи……………………………лучинки.
- Учащиеся отвечают у доски, используя слайд 15 и карточки, заполненные при обсуждении:

-Молодцы, ребята! Мотыльки очень довольны вашими ответами и могут лететь дальше. Пожелаем им счастливого пути!
Следующее задание: расставь коэффициенты в химических уравнениях.

Учащиеся по желанию из каждой группы у доски расставляют коэффициенты.
Химический диктант.
- Ну что же, вы хорошо поработали в группах, а теперь наступило время для самостоятельной работы. У нас химический диктант! Руководители групп, раздайте тексты по вариантам. На выполнение работы – 3 минуты.


Самопроверка. (Учащиеся самостоятельно проверяют работу. Каждый правильный ответ – 2 балла).
- Подсчитайте свои баллы. Поставьте себе оценку.

Рефлексия.
На листах самоконтроля и самокоррекции сделаем отметки в таблице и поставим отметку за диктант.
1. Проверка домашнего задания .
|
Тема |
Знаю ли я |
Да «+» Нет « - « |
Умею ли я |
Да «+» Нет « - « |
Пути самокоррекци
|
|
Химические уравнения
|
Определение, что называется химическим уравнением? |
|
Составлять уравнения химической реакции и уравнивать его. |
|
П.16, стр.128 № 5,7.
|
|
Что называется реагентами? |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
П.15, ст. 116 |
|
|
Что называется продуктами реакции? |
|
|
|
П.15, ст.116 |
|
|
Оксиген. Кислород. |
Характеристику элемента Физические свойства |
|
Указывать положение в ПСХЭ |
|
П.17
|
|
Записывать уравнение реакции получения кислорода из перманганата калия
|
|
П.18, ст. 136
П.18, ст.135 рис.18.3, ст.137, рис. 18.5. ст. 136, рис.18.4 |
|||
|
Получение в лаборатории |
|
||||
|
|
Как собрать кислород Как обнаружить кислород |
|
|||
|
Как собрать кислород Как обнаружить кислород |
|
2. Химический диктант. На шкале отметь свою оценку:
 1 2 3 4 5 6 7 8 9 10 11 12
1 2 3 4 5 6 7 8 9 10 11 12
IV. Изучение нового материала.
- Возьмите листочки с уравнениями. Посмотрите, что в этих уравнениях общего? ( Это реакции разложения (Какие реакции называются реакциями разложения?). В результате этих реакций выделяется кислород. )
- Значит, кислород можно получать не только разложением перманганата калия. Второй способ получения кислорода в лаборатории – разложение перекиси водорода.
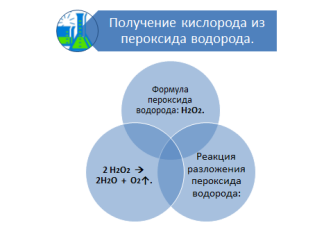
- А кто знает, где применяется перекись водорода? ( В медицине.)
- На ваших столах в наборе для лабораторной работы стоят бутылочки с перекисью водорода. Перекись водорода продают в аптеках в темных бутылочках, так как на свету перекись водорода разлагается по уравнению:
2Н2О2 2Н2О + О2 ↑.
Учащиеся записывают уравнение реакции.
- При попадании на ранку, перекись водорода шипит, пузырится, так как выделяется кислород, который обеззараживает ранку. Это происходит потому, что кровь содержит вещества, которые ускоряют разложение перекиси водорода. Какой можно сделать вывод? (Есть вещества, которые ускоряют химическую реакцию).
- Но есть и другие вещества, которые ускорят этот процесс: например, оксид марганца (IV) MnO2. Проведем лабораторную работу и узнаем, какую роль выполняет оксид марганца (IV) реакции разложения перекиси водорода.
Для этого выполним лабораторную работу. Руководители групп, достаньте карточку-инструкцию из пакета.
Дети по желанию читают тему и цель лабораторной работы, уясняют, что надо узнать:
- получить кислород разложением перекиси водорода;
- изучить роль катализатора: ускоряет ли он химическую реакцию? Расходуется ли катализатор во время химической реакции?

Проведение лабораторной работы. (Карточки - инструкции для каждой группы находяться на партах.)

1. Повторим правила техники безопасности.

Правила техники безопасности.
- Лабораторную работу проводить в халате.
- Эксперименты проводить только под руководством учителя.
- Химические реактивы не брать руками , не пробовать на вкус.
- Работать аккуратно, соблюдая правила техники безопасности.
- Поддерживать порядок на рабочем столе.
- После окончания работы наведите порядок на рабочем столе, помойте лабораторную посуду.
2. Проведение лабораторной работы по инструкции.
Ход работы.
1. В пробирку налейте 2 мл пероксида водорода. Что наблюдаете?
2. Добавьте к пероксиду водорода немного оксида марганца (IV). Что наблюдаете?
3. Приготовьте бумажный фильтр и отфильтруйте содержимое в другую пробирку. Что наблюдаете?
4. Сделайте выводы. По результатам работы заполните таблицу.
|
№ оп. |
Что делал?
|
Что наблюдал? |
Уравнение химической реакции
|
|
1.
2.
3.
|
|
|
|
Выводы:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________

Вывод:
- Что произошло, когда в пробирку с перекисью водорода добавили оксид марганца (IV) MnO2 ? (Реакция пошла быстрее).
- Что можно сказать про оксид марганца (IV) MnO2 после фильтрования? (Он не израсходовался).
- Вывод: оксид марганца (IV) MnO2 ускорил реакцию, но не вошел в состав продуктов реакции. Такие вещества называются катализаторами.
- Запишите определение ( учебник, стр. 137).
Видеофрагмент реакции разложения перекиси водорода. Мы видим на уровне макромира выделение пузырьков газа. А что же происходит на уровне микромира? (Вывод: сущность химической реакции в перегруппировке атомов).
Катализаторы в природе.
- Есть катализаторы и в нашем организме: стр. 138, 2-ой абзац.
Вывод: в организме человека есть природные катализаторы – ферменты.
V. Закрепление.
- Повторите определения.
Дети повторяют, что такое катализаторы, ферменты.

- Выполните тест.

Отвечает по очереди каждая группа.
При необходимости учитель проводит коррекцию знаний.
VI. Подведение итогов.
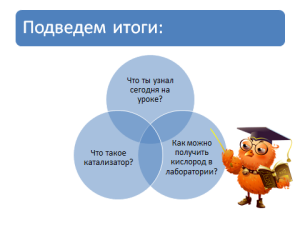
- Учащиеся (5 – 6 человек из разных групп) отвечают на вопросы.
Рефлексия этапа.
- В листах самоконтроля поставьте «+», если вы выполнили задание урока, узнали, как получают кислород разложением перекиси водорода, что такое катализаторы, ферменты.
Знаю Не знаю Хочу узнать Узнал
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\BEL0JE8F\original_smiley_face[1].png](/uploads/files/351509/119684/131143_html/images/119684.013.png)
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\U8KU9TQD\sad-smiley-picture[1].jpg](/uploads/files/351509/119684/131143_html/images/119684.014.jpg)
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\FZK0E3F4\small-questioning-face-small-webview[1].jpg](/uploads/files/351509/119684/131143_html/images/119684.015.jpg)
![C:\Users\user\AppData\Local\Microsoft\Windows\INetCache\IE\J528SO1E\danceW13[1].gif](/uploads/files/351509/119684/131143_html/images/119684.016.png)
VII. Рефлексия урока.
1. Заполните таблицу в листе самоконтроля.

3. Итоги урока.
|
Тема |
Узнал |
Да Нет |
Научился |
Да Нет |
Домашнее задание |
|
Получение кислорода в лаборатории. Катализатор. |
Получение кислорода разложением пероксида водорода. Что такое катализатор. |
|
Записывать уравнение реакции.
Объяснять роль катализатора в реакциях и организме. |
|
П.18, ст.135, 139.
П.18, ст.137. Ст.140 № 1, 9, 10. |
2. Оцени свою работу на уроке: постав от метку на шкале.
4. Рефлексия. Оцени свою работу на уроке:
 1 2 3 4 5 6 7 8 9 10 11 12
1 2 3 4 5 6 7 8 9 10 11 12
3. Проведение психологического тренинга.
- Ребята, как прошел урок? (Выслушать мнения детей.) Если ваши ожидания от урока оправдались, приклейте листочки к веточкам «Древа знаний». Как наше дерево? Зазеленело? Значит мы хорошо поработали! Давайте поаплодируем себе за урок! (Аплодисменты).
VIII. Домашнее задание.

Учитель поясняет, что на листах самоконтроля и самокоррекции у каждого появилось свое, индивидуальное задание.
Спасибо за сотрудничество, я и мудрая тетушка Сова, желаем успехов в изучении химии!

Висновок: використання комп’ютера на уроці дозволяє вивчити більший обсяг навчального матеріалу .

про публікацію авторської розробки
Додати розробку
