Вода під прицілом хіміків, біологів та екологів
Анотація
Проблема води існувала увесь період розвитку людини. В даній роботі розрізнені погляди на воду хіміків, біологів та екологів об'єднані в одне ціле. Робота містить в собі програму гуртка, календарні плани та рекомендації до проведення занять першого та другого років навчання. Теоретичний матеріал даний у вигляді плану, в якому висвітлюються основні питання заняття. Дослідницька частина, практичні заняття дані більш поширено: тут наведені методики проведення всіх дослідів, можливих у кожній темі.
Робота розрахована на вчителів загальноосвітніх шкіл, керівників гуртків у школі та Центрах творчості дітей та юнацтва, студентів старших курсів вищих навчальних закладів.
Скородистицька загальноосвітня школа
Чорнобаївської райдержадміністрації Черкаської області
Вода під прицілом хіміків,
біологів та екологів
(Програма гуртка та методичні розробки занять)
Автор: Загубинога Оксана Олексіївна – учитель хімії, біології з основами екологічних знань, учитель вищої кваліфікаційної категорії, вчитель – методист.
Зміст
|
№ з.п. |
Назва розділу |
Сторінки |
|
Розділ 1
|
Програма гуртка «Хімія, біологія та екологія води» |
4 – 19 |
|
Розділ 2 |
Календарний план першого року занять |
20 – 22 |
|
Розділ 3 |
Методичні розробки занять першого року навчання |
23 – 96 |
|
Розділ 4 |
Календарний план другого року занять |
97 – 99 |
|
Розділ 3 |
Методичні розробки занять другого року навчання |
100 - 131 |
|
|
Список використаних джерел |
132 - 133 |


Пояснююча записка
Тема занять гуртка є між предметною. Вона дає можливість учням побачити всезагальне взаємовідношення живого і неживого у природі.
Мета роботи гуртка :
- Поглиблювати і розширювати знання учнів з хімії, екології та біології, наближати навчання до життя, розвивати інтерес до природничих предметів та сприяти вихованню екологічної компетентності молоді.
- Розвивати взаємозв’язок хімії з екологією, біологією, розкрити хімізм біологічних процесів, вивчення біологічного значення неорганічних речовин.
Програма розрахована на 2 роки навчання для учнів 8 - 9 або 10 - 12 класів. Учні 8 класу вивчають біологічне значення води як середовища життя організмів та як необхідного продукту для життя і діяльності людини.
Учні 9 класу вивчають водні ресурси, їх багатства та вплив діяльності людини на гідросферу.
Під час занять обох років навчання проводиться велика кількість досліджень води у природі та хімічній лабораторії. Учні знайомляться з лабораторним обладнанням та методикою проведення лабораторних досліджень, знайомляться з елементами якісного та кількісного аналізу, з приладами і обладнанням, що необхідні для цього. Вони оволодіють навиками , які їм необхідні для роботи в лабораторії, навчаться брати проби води для аналізу, користуватися технохімічними вагами, готувати розчини, познайомляться з
методикою титрування розчинів, методами очистки речовин. Методи кількісного аналізу вимагають ознайомлення з математичною стороною процесів дослідження.
Робота гуртка включає в себе розв’язування задач, екскурсії, конференції, вікторини, турніри по розгадуванню головоломок, шифрограм, кросвордів, фотосесії в природі.
В процесі роботи учні іще раз ознайомляться з питаннями охорони водних багатств як джерела життя, з глобальними питаннями діяльності людства, пов’язані із використанням, забрудненням та очищенням природної води. Вони набудуть екологічних знань, навчаться відчувати відповідальність за довкілля, вироблять шанобливе ставлення до одночасно найдешевшого та найдорожчого і найнеобхіднішого мінералу на нашій планеті – до води.
Робота гуртка розрахована на 35 річних занять, тобто 1 година на тиждень.
Уміння, які будуть формуватися і закріплюватися в учнів.
- Користування нагрівальними приладами, електронагрівачем для пробірок.
- Проведення нагрівання.
- Користування металевим штативом та штативом для пробірок.
- Користування пробіркотримачем.
- Збирання приладів згідно опису їх або малюнка.
- Користування мірним посудом і мірними приладами..
- Розчинення.
- Випарювання в фарфоровому посуді і на склі..
- Виготовлення і користування фільтром.
- Фільтрування.
- Зважування.
- Збирання газів.
- Знаходження речовини, якісні реакції на іони, їх проведення.
- Проведення хімічних реакцій.
- Одержання речовин в одну і кілька стадій.
- Спостереження і аналіз дослідів.
- Складання плану проведення досліджень.
- Акуратність і точність в роботі.
- Підтримання чистоти на робочому місці.
- Оформлення результатів досліджень.
Примірний розподіл часу на вивчення тем занять гуртка
Перший рік навчання
|
№ П. п |
Назва і основні питання теми |
Всього годин |
Теоретичні заняття |
Практичні заняття |
|
1 |
Вступ. Обладнання хімічної лабораторії. Правила роботи з обладнанням |
3 |
2 |
1 |
|
2 |
Біологічна роль води в природі. |
6 |
2 |
4 |
|
3 |
Фізичні властивості води. Склад молекули води |
6 |
2 |
4 |
|
4 |
Хімічні властивості води. |
4 |
1 |
3 |
|
5 |
Органолептичний та хімічний аналіз води |
11 |
4 |
7 |
|
6 |
Екскурсії, польові дослідження. Збір матеріалу народознавчого характеру з теми занять Підсумок роботи за рік |
5 |
- |
5 |
|
Всього |
|
35 |
11 |
24 |
Другий рік навчання.
|
№ п. п |
Назва і основні питання теми |
Всього годин |
Теорети чні заняття |
Практичні заняття |
|
1 |
Водні ресурси. Гідросфера. Місцеві водні ресурси. |
6 |
2 |
4 |
|
2 |
Солона і прісна вода. Мінеральні води. |
2 |
1 |
1 |
|
3 |
Аналіз води різних джерел |
6 |
1 |
5 |
|
4 |
Забруднення води. |
6 |
4 |
2 |
|
5 |
Очищення води. Очисні споруди підприємств. |
4 |
2 |
2 |
|
6 |
Водопостачання населення. |
4 |
1 |
3 |
|
7 |
Охорона водних багатств |
5 |
3 |
2 |
|
8 |
Підсумок роботи за рік |
2 |
- |
2 |
|
Всього |
|
35 |
14 |
20 |


Перший рік навчання
Тема 1. Вступ. Обладнання хімічної лабораторії. Правила роботи з обладнанням
Вода – колиска і еліксир життя.
Вода як основна сировина багатьох виробництв. Проблема прісної води на планеті.Застосування води людиною. Завдання роботи гуртка.
Обладнання хімічної лабораторії. Правила роботи з лабораторним обладнанням. Правила роботи в кабінеті чи лабораторії. Ознайомлення з розміщенням аптечки, куточка пожежної безпеки. Основні прийоми підготовки речовин до досліджень. Основні прийомами лабораторних робіт – подрібнення речовин, розчинення речовин, нагрівання речовин, їх випарювання у фарфоровій чашці та на предметному склі. Вимірювання в хімії.
Практичні роботи:
1. Основні прийоми лабораторної роботи: подрібнення, розчинення.
2. Визначення маси речовини, густини, об'єму, температури.
Досліди:
Дослід 1. Подрібнення твердої речовини
Дослід 2. Розчинення твердої речовини у воді, збовтування рідини
Дослід 3. Нагрівання речовин
Дослід 4. Випарювання у фарфоровій чашці
Дослід 5. Випарювання на годинниковому скельці або скляній пластинці
Дослід 6. Визначення маси речовини
Дослід 7. Визначення густини рідин ареометром
Дослід 8. Вимірювання певного об’єму води.
Дослід 9. Вимірювання температури досліджуваної рідини
Додаткові матеріали:
- Вислів Антуан де Сент Екзюпері про воду.
- Вислів академіка О.Є.Ферсмана
- Вікторина «Пробна»
- Прислівя та приказки про воду
Тема 2. Біологічна роль води у природі.
Значення води для живих істот. Вода і можливості життя. Кількість води в рослинних організмах. Поняття про осмос і тургор. Надходження води в рослину і її рух по стеблу. Поняття про плач рослин. Гутація. Виділення води рослинами. Відношення рослин до дефіциту води.
Баланс води в живому організмі. Вміст води в тканинах і органах тварин та людини. Вода і можливості життя тварин і людини. Функції води в організмі – споживання і виділення. Шляхи використання води в організмі людини. Ендогенна вода у жителів пустель. Вода і склад крові. Поняття спраги.
Досліди:
Дослід 10. При диханні рослина виділяє водяну пару.
Дослід 11. Дихання плодів і насіння.
Дослід 12. Визначення кількості води, яку виділяють рослини.
Дослід 13. Осмотичний тиск
Дослід 14. Всмоктування води коренями рослин.
Дослід 15 . Рух води по стеблу рослин.
Дослід 16. Явище гутації у рослин.
Практичні роботи:
№1. Дослідження вмісту води в рослинах.
Дослід 17. Визначення вмісту вологи у досліджуваних об’єктах шляхом висушування зразка.
Дослід 18. Визначення вмісту вологи у досліджуваних зразках об’ємним (карбідним) методом.
№2. Розв’язування задач та ігор з теми «Біологічна роль води»
Тема 3. Фізичні властивості води. Склад молекули води.
Історична довідка про вивчення складу води. «Мертва і жива вода» з народних казок. Склад молекули води. Графічна та електронна формули води. Ізотопи Гідрогену – Дейтерій і Тритій. Поняття «Важка вода». Важка вода та її вплив на живі організми. Яка іще буває вода? («Окислена вода» «вапняна вода», «баритова вода», «тверда вода», «м’яка вода» «солона вода», «прісна вода».)
Фізичні властивості води: - агрегатний стан, температура плавлення і кипіння, густина води, поверхневий натяг. Аномалії води. Будова льоду. Замерзання водойм і життя під льодом. Температура води та її вплив на розвиток живого, на розмноження водних тварин. Поняття «тала вода» і «жива вода». Вода як розчинник. Карстові печери.
Вміст розчинених у воді солей. Поняття твердість води. Визначення твердості води. Усунення твердості води. Життя організмів та твердість води.
Практичні роботи:
№1.Дослідження складу води.
№2. Розв’язування задач і вправ з теми «Розчинність речовин у воді».
Досліди:
Дослід 19. «Синтез води» Вибух гримучого газу.
Дослід 20. Вивчення складу води.
Дослід 21. Вимірювання температури води.
Дослід 22. Вимірювання температури води у водоймі.
Дослід 23. Вимірювання густини води.
Дослід 24. Що відбувається з водою при нагріванні і охолодженні.
Дослід 25. Вимірювання температури кипіння води.
Дослід 26. Речовини, розчинні і нерозчинні у воді. (сіль, сода, річковий пісок, глина)
Дослід 27. Дослідження поверхневого натягу води.
Дослід 28. Дослідження розчинених газів у воді.
Дослід 29. Виявлення розчинних у воді солей.
Дослід 30. Дослідження солей водопровідної води.
Дослід 31. Визначення карбонатної твердості води.
Дослід 32. Визначення загальної i сталої твердості води.
Дослід 33. Відношення твердої i м'якої води до мильного розчину.
Дослід 34. Пом'якшення води за допомогою катіоніту.
Додаткові матеріали:
№1. Казка про воду.
№2.Фрагмент з роману Ж. Верна «Таємничий острів».
№3.Золото з води.
№4. Хімічний гігрометр.
Тема 4: Хімічні властивості води.
Взаємодія води з оксидами металів. Вапняна та баритова вода. Взаємодія води з оксидами неметалів. Газована вода. Взаємодія води з металами. Дисоціація води. Поняття константи дисоціації. Водневий показник.
Добування води реакцією синтезу її з водню та кисню. Розклад пероксиду. Реакція нейтралізації. Розклад нерозчинних основ. Розклад їжі в організмі людини і тварин. Дисиміляція вуглеводів.
Практичні роботи:
Дослід 35. Виготовлення гашеного вапна і вапняної води.
Дослід 36. Виготовлення баритової води.
Дослід 37. Взаємодія води з лужними металами.
Дослід 38. Визначення реакції середовища розчину.
Цікаві досліди:
Дослід 39. Вогонь від краплини води. (лужні метали).
Дослід 40. Вогонь від краплини води. (алюмінієва пудра).
Дослід 41. Незгораюча хустинка.
Дослід 42. Каталітичний разклад пероксиду водню.
Дослід 43. Яйце – водяна дзиґа.
Тема 5. Органолептичний та хімічний аналіз води
Правила взяття проб води для аналізу. Поняття про польові та лабораторні дослідження Органолептичний аналіз води. Фізико – механічні властивості води( прозорість, смак, колір, запах) – способи їх визначення.
Поняття про біоіндикаційний метод аналізу якості води. Аналіз води по присутності в ній нижчих організмів. Аналіз води по присутності в ній вищих організмів. Аналіз води по присутності навколо водних організмів.
Реакція води. Водневий показник. Твердість води. Визначення твердості води.
Хімічний аналіз проб води. Поняття про калориметричний метод аналізу та метод титрування. Визначенням деяких катіонів та аніонів у воді. (Визначення заліза, нітритів, нітратів, фосфатів, сульфатів, хлоридів.)
Визначення вмісту розчиненого у воді кисню. Вміст різних речовин у воді.
Практичні заняття, дослідження:
Дослід 44. Визначення прозорості води.
Дослід 45. Визначення кольору води.
Дослід 46. Визначення температури води.
Дослід 47. Визначення запаху води.
Дослід 48. Визначення смаку і присмаку води.
Практичні роботи:
№1. Вивчення стану чистоти водойм з використанням біоіндикаторного методу (наявність раків, молюсків у водоймах).
№2. Вивчення стану чистоти водойм з використанням біоіндикаторного методу (наявність одноклітинних у водах Кременчуцького водоймища).
№3.Хімічний аналіз води:
Дослід 49. Визначення заліза.
Дослід 50. Визначення нітритів.
Дослід 51. Визначення нітратів.
Дослід 52. Визначення фосфатів.
Дослід 53. Визначення хлоридів.
Дослід 54. Визначення сульфатів.
Додаткові матеріали:
№1. «Цвітіння води».
№2. Одноклітинні жителі забрудненої води.
№3. Одноклітинні жителі чистої води.
Тема 6. Екскурсія до місцевої водойми.
Польові дослідження води місцевої водойми (річки, озера, ставка чи колодязя).
Тема 7. Захист проекту
1. «Вода у народній творчості (приказки, прислів’я, пісні, загадки, казки.)»
2. «Вода у творах поетів, художників, композиторів»


Другий рік навчання
Тема 1. Водні ресурси. Гідросфера. Місцеві водні ресурси.
Людина і світовий океан. Запаси води на планеті Земля. Різноманітність природних вод, їх об’єм на планеті. Водна оболонка Землі – гідросфера.
Місцеві водні ресурси. Характеристика водойм, джерел води. Вивчення нових понять: поняття „водойма”, класифікація водойм, природні водойми (моря, річки, озера, болота), штучні водойми (ставки, канали, водосховища).
Водойми - середовище життя риб.
Дніпро і річки його басейну. Водосховища на Дніпрі. Це цікаво: цифрові дані про Дніпро та його притоки, про водосховища та їх характеристики.
Основні частини річки. Рух води в річках. Течія. Визначення швидкості течії річки. Вимір глибини. Прозорість води, способи її визначення. Схема опису річки.
Практична робота з картою:
№1. Відшукування річок за даною назвою, простеження її течії.
№2. Вимірювання глибини і швидкості річки, визначення її прозорості.
№3. Опис водойми.
№4. Цікаві ігри: Розгадування головоломок, кросвордів.
Екскурсія . Вивчення водойм своєї місцевості
Екскурсія. Джерело – потічок – річечка = ріка.
Тема 2. Мінеральна і морська вода.
Вміст розчинених у воді солей. Поняття морська (солона) вода і прісна. Поняття мінеральна вода. Загальні відомості про відкриття мінеральних вод. Класифікація мінеральних вод за вмістом солей. Використання мінеральних вод людиною. Мінеральні води нашої країни. Бальнеологічні курорти України і світу.
Практичні роботи:
№1. Дослідження змісту написів на етикетках мінеральних вод. Склад мінеральної води.
№2. Дослідження даних про газованість води. Визначення оксиду карбону(IV) у воді. (Дослід 53. Визначення оксиду карбону(IV) у воді.)
№3. Дослідження даних про солодкі газовані напої.
Тема 3. Аналіз води різних джерел
Способи взяття і зберігання проб води для аналізів. Реєстрація результатів аналізу досліджуваних зразків.
Практичні роботи:
№1. Взяття проб води для аналізів
№2.Аналіз води з водопроводу і колодязів. Дослідження природної води в умовах шкільної лабораторії хімії.
Екскурсія в районну чи міську санепідемстанцію.
Контроль за якістю води у місті (районі).
Тема 4. Забруднення води в природі та внаслідок діяльності людини.
Всі шляхи ведуть до водойм. Наслідки використання мінеральних добрив та пестицидів у сільському господарстві. Стічні води промислових підприємств. Забруднення вод – природне, мікробіологічне, хімічне, фізичне. Детергенти у водному середовищі. Нафта і нафтопродукти у водоймах.
Екскурсія до місцевого сільгосппідприємства , підприємства промислового чи побутового напрямку роботи.( забруднення води)
Тема 5. Очищення води. Очисні споруди підприємств.
Контроль за рівнем забрудненості води. Способи очистки стічних вод: механічні і біологічні. Очисні споруди підприємств. Безстічні виробництва. Безвідходні виробництва.
Практичне заняття: Способи очищення забрудненої води.
Екскурсія до місцевого сільгосппідприємства , на очисні об’єкти підприємств промислового чи побутового напрямку роботи.( способи очистки води)
Тема 6. Водопостачання населення.
Забезпечення водою населення в різні епохи історичного розвитку людства. Криниця – джерело життя. Артезіанські колодязі. Водопроводи, їх призначення і схематична будова. Водозабірні та водоочисні станції. Схема міського чи сільського водопроводу. (По можливості – екскурсія.)
Екскурсії, дослідницька робота:
№1.Віртуальна екскурсія до музею води в м. Києві.
№2.Екскурсія до міського (сільського) водопроводу, колодязя, джерела-кринички.
№3.Дослідницько – практична робота над проектом « Криниця в житті українців».
Тема 7. Охорона водних багатств
Закон України про охорону водних багатств. Контроль за чистотою водойм. Участь «Голубих патрулів» у охороні водойм. Коротко з історії охорони водойм. Міжнародні організації по захисту водного середовища. Охорона води у моєму регіоні.
Практичні заняття:
№1. Охорона водних багатств. Ознайомлення із державними заповідниками, заказниками по охороні водного середовища, рослинного і тваринного світу водойм. Нанесення на контурну карту охоронних територій. Місцеві території, що охороняються , нанесення їх на схематичну карту регіону. Ознайомитися з роботою учнівських природоохоронних організацій, зокрема «Голубих патрулів», участь у акціях по охороні водних багатств.
№2. Охорона водних багатств. Ознайомлення із можливими джерелами забруднення місцевої водойми. Допомога дорослим у охороні водних багатств – упорядкування джерел, колодязів, очищення берегів річок чи інших водойм від сміття, насаджування рослин у прибережній смузі, проведення рейдів контролю за чистотою водойм, ведення роз’яснювальної роботи серед учнів з даного питання, підготовка виступу агітбригади.
Захист проектів
- « Криниця в моєму дворі»
- «Річка мого дитинства».


Календарний план першого року занять .
|
№пп |
Назва теми, занять |
К – сть годин |
Дата |
Прим. |
|
1 |
Тема 1. Вступ. Обладнання хімічної лабораторії. Правила роботи з обладнанням. |
3 |
|
|
|
|
Заняття 1. Вступ. Правила роботи в кабінеті чи лабораторії. (Теоретичне) |
1 |
|
|
|
|
Заняття 2. Основні прийоми лабораторних робіт. (Теорія з використанням лабораторних робіт) |
1 |
|
|
|
|
Заняття 3. Вимірювання в хімії. (Теоретичне з використанням лабораторних робіт учнів) |
1 |
|
|
|
2 |
Тема 2. Біологічна роль води. Вода і рослинні організми. |
6 |
|
|
|
|
Заняття 4. Біологічна роль води. Вода і рослинні організми. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 5. Дослідження води в рослинах. |
1 |
|
|
|
|
Заняття 6. Біологічна роль води для рослин (Практичне заняття) |
1 |
|
|
|
|
Заняття 7 Вода в рослинах. (Практичне заняття) Заняття 8 Вода в організмі тварин і людини. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 9. Розв’язування задач та ігор з теми «Біологічна роль води» |
1 |
|
|
|
3 |
Тема 3. Фізичні властивості води. |
6 |
|
|
|
|
Заняття 10. Склад води. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 11. Дослідження складу води. (Практичне заняття) |
1 |
|
|
|
|
Заняття 12 Фізичні властивості води. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 13 – 14. Дослідження фізичних властивостей води.(Практичне заняття) |
2 |
|
|
|
|
Заняття 15. Розв’язування задач і вправ з теми «Розчинність речовин у воді» (Практичне заняття) |
1 |
|
|
|
|
Заняття 16. Твердість води. (Теоретичне заняття з виконанням лабораторних дослідів) |
1 |
|
|
|
4 |
Тема 4. Хімічні властивості води. |
4 |
|
|
|
|
Заняття 17. Хімічні властивості води.(Теоретичне заняття) |
1 |
|
|
|
|
Заняття 18 - 19. Хімічні властивості води (Практичне заняття) |
2 |
|
|
|
|
Заняття 20. Виділення води під час хімічних реакцій. (Теоретичне заняття з проведенням демонстраційних дослідів) |
1 |
|
|
|
5 |
Тема 5. Органолептичний та хімічний аналізи води. |
11 |
|
|
|
|
Заняття 21. Органолептичний аналіз води. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 22 - 23 Органолептичний аналіз води. (Практичне заняття). |
2 |
|
|
|
|
Заняття 24 . Біоіндикаційний метод аналізу води. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 25 - 26. Біоіндикаційний метод аналізу води (Практичне заняття)Заняття |
1 |
|
|
|
|
Заняття 27- 28. Хімічний аналіз води(Теоретичне заняття з демонстрацією дослідів) (Практичне заняття) |
2 |
|
|
|
|
Заняття 29 - 32. Хімічний аналіз води (Практичне заняття) |
4 |
|
|
|
6 |
Екскурсії, польові дослідження. |
5 |
|
|
|
|
Заняття 33 - 34.(2год.) Екскурсія до місцевої водойми . Дослідження води в польових умовах. |
2 |
|
|
|
|
Заняття 35. Захист проекту « Збір матеріалів народознавчого характеру про воду: прикмети, пісні, загадки, казки.» Підсумок роботи за рік
|
1 |
|
|


Тема 1: Вступ. Обладнання хімічної лабораторії. Правила роботи з обладнанням.
Рекомендована література з теми.
- Практичні роботи з хімії. за ред. Н.М.Буринської. К. «Освіта» 1974.С.3 - 39
- І.М.Чертков,П.Н.Жуков. Хімічний експеримент з малими кількостями реактивів.М. «Просвещение» 1980.С.9 – 28, 47 - 55
- П.І. Воскресенський, А.М. Неймарк. Основи хімічного аналізу. М.: «Просвещение», 1971. С.3 – 24
- Ф.А. Деркач. Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 3 – 30
- О.І. Астахов. Цікаві роботи з хімії. К.: Рад. Шк..1980. С. 6 – 10
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 111 – 128
- М.А. Прокофьев(редак.). Єнциклопедия Школьника. Неорганическая химия. М. Сов.Энц. 1975 С. 98 - 105
Заняття 1. Вступ. Правила роботи в кабінеті чи лабораторії.(Теоретичне)
Мета: Ознайомити учнів із завданнями і планом роботи гуртка, повторити правила роботи учнів у кабінеті хімії, правила виконання лабораторних і практичних робіт.
План
- Вода – еліксир життя.
- Використання води людиною.
- Ознайомлення з основними питаннями, які будуть вивчатися під час занять у гуртку.
- Організація роботи. Вимоги до учнів. Вибір старости гуртка, лаборантів.
3. Правила роботи в кабінеті чи лабораторії.
4. Ознайомлення з розміщенням аптечки, куточка пожежної безпеки.
5. Основні прийоми підготовки речовин до досліджень.
Допоміжні матеріали:
«Вода, в тебе ні кольору, ні смаку, тебе неможливо описати, тобою насолоджуються, не відаючи, що ти таке. Не можна сказати, що ти необхідна для життя. Ти – саме життя. Ти наповнюєш нас радістю, яку не пояснити нашими почуттями. З тобою повертаються до нас сили, з якими ми вже попрощалися.»
Французький письменник АНТУАН де СЕНТ – ЕКЗЮПЕРІ.
« Прісна вода – найважливіший мінерал на Землі, без якого немає життя».
Академік О.Є. ФЕРСМАН.
Вікторина
- Яку воду називають «важкою»?
- Яку воду називають «живою»?
- Яку воду називають «мертвою»?
- Яку воду називають «звичайною»?
- Назвіть найбільшу річку світу, України?
- Назвіть річки, що протікають територією нашого району?
- Які речовини додають у воду для її очищення та знезараження?
- Яка кількість води міститься в організмі людини?
Відповіді.
- Це вода в якій нормальний Гідроген заміщений важким Дейтерієм.
- Снігова, тала – в ній міститься менша кількість важкої води.
- Так названо воду яка виникає під час руху корабля при наявності на поверхні морської води шару прісної води. Вона повністю може зупинити корабель.
- Це вода з нормальним атомом Гідрогену у своєму складі.
- Це річка Дніпро.
- Територією нашого району протікає річка Ірклій, Коврай.
- Для очищення води додають речовини – коагулянти, а для знезараження – хлор , озон.
- В організмі людини міститься 67% води
Робота в лабораторії:
Вимоги до учнів.
Перш ніж виконувати будь-який хімічний дослід, необхідно уважно прочитати його опис, скласти чітке уявлення про мету даного досліду, умови і порядок його проведення, підібрати необхідні реактиви, матеріали, посуд, а якщо треба — зібрати прилад.
У процесі виконання досліду необхідно суворо додержувати інструкції. Перед виконанням хімічного експерименту слід уважно прочитати правила техніки безпеки.
Категорично забороняються будь-які порушення умов виконання хімічних дослідів.
Уважна і охайна робота позбавить вас від опіків гарячими предметами чи концентрованими кислотами й лугами.
У процесі експериментальної роботи необхідно уважно стежити за ходом досліду і враховувати всі його особливості — випадання або розчинення осадів, змінений забарвлення розчину, виділення газоподібної речовини, теплові ефекти тощо. Результати досліду треба одразу після його закінчення записати у спеціальний зошит для практичних робіт. Форма запису може бути різною. Інколи пропонується заповнити наведену таблицю, але частіше звіт про виконану практичну роботу складається у довільній формі. При цьому бажано додержувати такої послідовності:
1. Тема практичного заняття, його номер, дата виконання.
2. Назва досліду.
3. Короткий опис ходу досліду і ваших спостережень з обов'язковою відповіддю на запитання, які є в тексті інструкції.
4.Пояснення спостережень і наведення відповідних рівнянь хімічних реакцій.
5. Малюнок приладу (якщо він використовувався).
6. Розрахунки (якщо вони були).
7. Висновки (записати з абзацу і підкреслити). Після складання звіту про практичну роботу (його пишуть у класі) зошит треба здати лаборанту або вчителю і обов'язково ретельно вимити руки.
Правила поведінки учнів у хімічному кабінеті
Учні зобов'язані:
1) входити до кабінету хімії і лаборантської тільки з дозволу вчителя;
2) входити і виходити з кабінету спокійно, щоб випадково не перекинути хімічний посуд з приладдям чи склянки з реактивами, що стоять на столах;
3) сидіти в кабінеті завжди за одним і тим самим робочим місцем і не переходити на інше місце без дозволу вчителя;
4) підтримувати чистоту і порядок на своєму робочому місці, не залишати на столі сміття, збирати його і викидати в установлені місця (урни або спеціально поставлені на столах банки), після роботи мити за собою посуд;
5) під час роботи не тримати на столі нічого зайвого; на ньому можуть бути підручник, задачник, довідник, зошит і письмове приладдя;
6) дбайливо ставитись до обладнання кабінету;
7) виконувати всі досліди самостійно, за винятком тих, які за вказівкою вчителя виконуються трупами з 2—4 учнів;
8) не приступати до роботи, поки не перевірено, чи є все необхідне для дослідів, і не продумано послідовність виконання кожного з них;
9) працювати сидячи, швидко, але без зайвої квапливості, під час роботи додержувати тиші;
10) записувати хід виконання досліду в зошиті і робити запис всіх спостережень, рівнянь реакцій, висновків відразу ж після виконання досліду;
11) додержувати правил користування водопроводом, газом і електрикою, не відкривати без необхідності крани, не засмічувати раковини, вмикати електричні прилади в міру необхідності;
12) знати і додержувати правил нагрівання, поводження з розчинами кислот і лугів, вогненебезпечними, вибухонебезпечними та отруйними речовинами.
13) знати місцезнаходження в кабінеті протипожежних засобів, аптечки і вміти користуватися при нещасних випадках.
Практична робота 1 Правила техніки безпеки при роботі в хімічному
кабінеті. Прийоми поводження з сухим пальним, газовим пальником,
електронагрівачем пробірок;
Для роботи необхідні:
обладнання і хімічний посуд:, нагрівальні прилади, пробірка, хімічний стакан, фарфорова чашка, піпетка, штатив для пробірок, пінцет, сірники, м'яка тонка ганчірка або губка.
Порядок виконання роботи
І. Ознайомлення з правилами роботи в хімічному кабінеті і основними застережними заходами ( Повторення правил роботи)
ІІ. Прийоми поводження із сухим пальним
1.Покладіть таблетку сухого пального (уротропіну або гексаметилентетраміну) на керамічну плитку або іншу негорючу підставку.
2. Запаліть сухе пальне.
3. Погасіть полум'я ковпачком від спиртівки або фарфоровим тиглем, або термостійким хімічним стаканом ємкістю не більше 50 мл. 4. Покладіть брикет, який недогорів, у витяжну шафу.
III Прийоми поводження з електронагрівачем
1. Ознайомтеся з будовою електронагрівачів, які є у кабінеті. Приведіть їх у дію, суворо додержуючись вимог безпеки при роботі з електронагрівачем 2. Ознайомтеся з вимогами безпеки при роботі 1 з електронагрівачем.
Перед вмиканням електронагрівача в мережу необхідно перевірити, чи не пошкоджена ізоляція електричного проводу нагрівача.
Вмикати прилад треба тільки в ту мережу, вольтаж якої відповідає вольтажу приладу.
Якщо при вмиканні електронагрівача в мережу не відбувається нагрівання, треба звернутися до вчителя. Не можна торкатися руками розжарених електроспіралей.
При роботі з електронагрівачем не можна допускати забруднення спіралі розжарювання.
Не слід допускати перегріву електронагрівача, щоб не перегоріла спіраль нагрівального елемента.
Не можна залишати хімічний посуд у нагрівальному модулі після його охолодження (через 2.—3 хв після відключення елемента).
Заняття 2. Основні прийоми лабораторних робіт.
(Теорія з використанням лабораторних робіт )
Мета: Ознайомитись та оволодіти практично основними прийомами лабораторних робіт – подрібненя речовин, розчинення речовин, нагрівання речовин, їх випарювання у фарфоровій чашці та на предметному склі.
Практична робота 1. Основні прийоми лабораторної роботи: подрібнення, розчинення,
Для роботи необхідні:
реактиви: кухонна сіль, крейда, цукор, питна сода, дистильована вода;
обладнання і хімічний посуд: фарфорова ступка з товкачиком; підставка з картону чи фанери або пластика, шпатель, ложечка, пробірка, хімічний
стакан, колба, фарфорова чашка, лійка, промивалка, скляна паличка з гумовим наконечником, мензурка чи мірний циліндр; гумові пробки,
Порядок виконання роботи
Дослід 1. Подрібнення твердої речовини
1. Покладіть під ступку підставку з твердого матеріалу (картону, фанери, пластика тощо), щоб зберегли лабораторний стіл.
2. Насипте в ступку шпателем або ложечкою речовину, яку необхідно подрібнити (наприклад, кухонну сіль, крейду) так, щоб ступка була заповнена не більше як на 1/3 її об'єму.
Не можна насипати речовину до країв ступки, бо при подрібненні речовина випадатиме з неї!
3. Розкришіть натиском товкачика великі шматочки речовини або кристали. Якщо розкришити не вдасться, розбийте їх обережними легкими ударами товкачика до розмірів горошини. Потім, притискуючи ступку лівою рукою до столу, правою повільно розітріть речовину коловими рухами. При цьому притискуйте товкачик не дуже сильно до стінок ступки. У міру подрібнення швидкість руху товкачика можна збільшити, але так, щоб частинки речовини не випадали зі ступки. Час від часу зчищайте шпателем подрібнену речовину з внутрішньої стінки ступки і з товкачика, збирайте її до середини і після цього продовжуйте подрібнення.
4. Закінчіть подрібнення як тільки речовина досягне достатнього ступеня розтирання. Зчистіть шпателем від порошку спочатку товкачик, потім внутрішню стінку до середини ступки. Пересипте подрібнену речовину на папір або в спеціально заготовлену банку.
5. Вимийте ступку і товкачик водою.
Дослід 2. Розчинення твердої речовини у воді, збовтування рідини
1. Виберіть відповідний хімічний посуд — пробірку, хімічний стакан або колбу.
2. Перенесіть в пробірку (хімічний стакан) шпателем або ложечкою речовину (наприклад, кухонну сіль, цукор, питну соду). В колбу перенесіть речовину через лійку; дрібні частинки, що пристали до скла, змийте струменем води з промивалки. Потім налийте в посуд мензуркою або мірним циліндром трохи дистильованої води.
3. Збовтайте рідину для прискорення розчинення.
Якщо розчинення проводять у пробірці, її беруть трьома пальцями лівої руки біля отвору. Потім пробірку струшують скісними ударами середнього пальця по нижній частині. Не можна закривати отвір пробірку пальцем і колб при збовтуванні рідини.
Якщо рідина займає більше половини об’єму пробірки, рідину перемішують скляною паличкою, опускаючи і піднімаючи її, або пробірку закривають пробкою і кілька разів перевертають, притримуючи пробку. На кінець скляної палички надівають невеликий шматочок гумової трубки. Трубка повинна щільно триматися на паличці і трохи виступати за її кінець. Тоді при розмішуванні вдарятиметься об скло не сама паличка, а гумовий наконечник, і пошкодження посудини не відбуватиметься. Паличка повинна виступати назовні на 2—3 см.
У хімічному стакані його вміст перемішують скляною паличкою з гумовим наконечником, здійснюючи нею колові рухи.
У колбі рідину перемішують коловими рухами або струшуванням і багаторазовим перевертанням колби, щільно закритої корком.
4. Доливайте невеликими порціями дистильовану воду і перемішуйте вміст посудини до повного розчинення речовини.
Дослід 3. Нагрівання речовин
1. Ознайомтеся з правилами нагрівання.
У полум'ї можна нагрівати речовини тільки в тонкостінному хімічному посуді (пробірках, колбах, стаканах) і у фарфоровому посуді (випарювальних чашках, тиглях). Посуд зовні повинен бути сухим, тому що крапельки води створюють умови для нерівномірного нагрівання і можуть призвести до його розтріскування.
При нагріванні пробірку з речовиною не можна тримати рукою. Треба закріпити її в тримачі для пробірок або в лапці штатива. Затискачі повинні бути біля отвору пробірки. Це дасть змогу нагрівати пробірку по всій її довжині.
Пробірки, круглодонні колби, фарфорові чашки з речовинами можна нагрівати на голому вогні, плоскодонні колби і стакани — на металевому розсікачі полум'я.
При нагріванні розчинів у пробірках їх заповнюють не більше як на 1/3 місткості.
Хімічний посуд треба нагрівати у верхній, третині полум'я, бо саме це — найгарячіша його частина. Спочатку треба обігріти всю пробірку, а потім, | виймаючи з полум'я — тільки ту частину її, де міститься речовина. Не можна нагрівати пробірку вище рівня рідини або тільки біля дна. У першому випадку пробірка може тріснути, у другому—можливе викидання рідини.
При нагріванні слід тримати або закріплювати пробірку похило, слідкуючи за тим, щоб її отвір був спрямований у бік від себе і тих, хто працює поруч бо рідина при перегріванні може бути викинута з посуду. Порушення цього правила призводить до опіків. Нагріваючи речовини у скляному посуді на спиртівці не можна торкатися ним ґнота, бо гніт холодний і вологий, через що посуд може тріснути.
Гарячу пробірку треба ставити в штатив для пробірок, а інший гарячий посуд — тільки на спеціальні підставки, щоб не псувати лабораторний стіл.
2. Нагрійте у пробірці 1 мл води до кипіння, користуючись спиртівкою (газовим пальником, сухим пальним).
3. Нагрійте в пробірці 5 мл води до кипіння, користуючись електронагрівачем з модулями № 2 або № 3. Для цього встановіть у нижню розетку корпусу електронагрівача модуль № 2. Закріпіть пробірку з водою в тримачі. Увімкніть електронагрівач у мережу. В розжарену чашку спіралі електронагрівача помістіть пінцетом шматочок сухого пального
величиною з півгорошини. Як тільки відбудеться займання пального від стикання його зі спіраллю, електронагрівач вимкніть.
Встановіть модуль № 3 у верхню розетку електронагрівача, а потім у ньому похило розмістіть пробірку з водою. Увімкніть електронагрівач у мережу. Пробірка контактуватиме з розжареною спіраллю, що забезпечить прогрівання пробірки ділянкою 25 мм від дна. Для регулювання кипіння води міняйте положення пробірки відносно спіралі, зсуваючи її в пружинному тримачі.
4. Доведіть до кипіння 20 мл води в хімічному стакані місткістю 50 мл, користуючись елекгронагрівачем з модулем № 1. Для цього встановіть у нижню розетку електронагрівача модуль № 1. Вкладіть у модуль опорну шайбу і поставте хімічний стакан з водою. Увімкніть електронагрівач і нагрійте воду до початку кипіння.
Дослід 4. Випарювання у фарфоровій чашці
У фарфорову чашку налийте розчину кухонної солі, цукру або питної соди не більше 1/3 її місткості. Не можна наливати розчину більше, бо під час кипіння він виливатиметься через край чашки.
2. Поставте фарфорову чашку з розчином на кільце, штатива без розсікача полум'я або на модуль 1 шкільного лабораторного нагрівача.
3. Нагрівайте фарфорову чашку з розчином до початку утворення кашки з кристалів. Розчин періодично перемішуйте скляною паличкою, розбиваючи кірку кристалів, що утворюються на поверхні чашки Паличку весь час залишайте в чашці. Нагрівання під час випарювання регулюйте так, щоб розчин не розбризкувався. Особливо енергійно помішуйте рідину наприкінці випарювання, коли починають бурхливо утворюватися кристали речовини.
Якщо в чашці ще є деяка кількість розчину і треба підлити нову порцію його, то розчин наливають по скляній паличці не на стінки чашки, а в рідину, щоб чашка не тріснула.
Не нахиляйтеся над фарфоровою чашкою і не припускайте її сильного нагрівання, щоб запобігти можливому розбризкуванню рідини і розкиданню розжарених кристалів речовини (небезпека опіків обличчя і очей)!
4. Припиніть нагрівання, коли води залишиться так мало, що виділена тверда речовина вже не покривається нею. Продовжуючи помішування скляною паличкою, дайте залишкам води випаритись від теплоти нагрітої чашки.
5. Зніміть фарфорову чашку, обітріть її низ м'якою ганчіркою або паперовою серветкою і зчистіть шпателем або ложечкою кристали речовини зі стінок і дна чашки. Висипте добуту речовину в підготовлений посуд.
Дослід 5. Випарювання на годинниковому скельці або скляній пластинці
|1. Перенесіть скляною паличкою (піпеткою з гумовим наконечником або капілярною піпеткою) 1—2 краплі розчину кухонної солі, цукру або питної соди на годинникове скельце або скляну пластинку.
Щоб перенести краплі розчину скляною паличкою, необхідно опустити паличку в розчин, потім швидко вийняти паличку і, тримаючи її похило, перенести краплі в потрібне місце. Для перенесення крапель розчину піпеткою з гумовим наконечником, необхідно здавити гумовий наконечник і, розтиснувши пальці, набрати рідину в піпетку. Потім, стискуючи наконечник, видавити потрібну кількість крапель розчину. Якщо краплі рідини переносять капілярною піпеткою, необхідно опустити піпетку в розчин і щільно закрити її отвір вказівним пальцем правої руки.
Вийняти піпетку з розчину, доторкнувшись кінчиком до стінки пробірки, щоб злився розчин із зовнішньої поверхні піпетки. Перенести піпетку з розчином, не віднімаючи пальця, і лише тоді, злегка послабивши палець, що
закриває верхній отвір піпетки, випустити потрібну кількість крапель.
2. Випарюйте краплі рідини з великою обережність підтримуючи слабке і рівномірне нагрівання всієї поверхні годинникового скельця або скляної пластинки. При сильному нагріванні скло може тріснути. Щоб цього не сталося, тримайте годинникове скельце або скляну пластинку тигельними щипцями на висоті 6—7 см над полум'ям і весь час рухайте ними упоперек полум'я. Що спостерігається?
3. Розгляньте утворені кристали речовини.
Заняття 3 Вимірювання в хімії.
(Теоретичне з використанням лабораторних робіт учнів)
Мета: Повторити, закріпити вміння учнів зважувати речовини, користуватися технохімічними терезами, ареометром, мірним посудом, термометрами.
Практична робота: Визначення маси речовини, густини, об'єму, температури
Для роботи необхідні:
реактиви: кухонна сіль, цукор, питна сода, пісок, дистильована вода, розчин гліцерину, олія;
обладнання і хімічний посуд: технохімічні терези, важки, комплект ареометрів, мірні циліндри, мензурки, термометри на 100 і 150 °С, лабораторний штатив з лапкою, нагрівальний прилад, пробірка, сірники, фільтрувальний папір, м'яка тонка ганчірка.
Порядок виконання роботи
Дослід 6. Визначення маси речовини
Пригадайте з курсу фізики правила зважування на технохімічних терезах і зважте певну масу (наприклад, 0,5 г) кухонної солі, цукру, питної соди або піску.
Дослід 7. Визначення густини рідин ареометром
Пригадайте з курсу фізики правила визначення густини рідин.
Налийте досліджувану рідину (наприклад, воду, розчин гліцерину, олію) в мірний циліндр місткістю не менше 0,5 л так, щоб її рівень не доходив до краю циліндра на кілька сантиметрів.
3. Опустіть плавно ареометр в розчин, щоб він набув вертикального положення. Слідкуйте, щоб він знаходився саме посередині циліндра і не торкався його стінок.
4. Визначте на шкалі показники, як тільки ареометр установиться. Під час спостереження очі і меніск повинні за ходитися на одному рівні. Для прозорих рідин відлік ведеться за нижнім мі піском, а для непрозорих — за верхнім.
5. Підніміть на 1—2 см ареометр і знову опустіть його в розчин. Визначте ще раз показники і запишіть їх у зошит.
6. Вилийте рідину у склянку. Вийміть ареометр з води, витріть його і покладіть у футляр.
Дослід 8. Вимірювання певного об’єму води.
1. Візьміть мірний циліндр і визначте ціну його поділки.
2. Налийте в мірний циліндр або мензурку стільки води, щоб нижній меніск вимірювального посуду досяг рівня бажаної поділки. При спостереженні рівня меніска мірний циліндр або мензурку потрібно розмістити на столі так, щоб око спостерігача було в одній горизонтальній площині з потрібною поділкою вимірювального посуду.
Слід враховувати, що густина води при 4 °С дорівнює одиниці, її об'єм чисельно дорівнює масі.
Дослід 9. Вимірювання температури досліджуваної рідини
1. Налийте в пробірку 3—4 мл води, закріпіть у лапці штатива або електронагрівача. Нагрійте воду до кипіння.
2. Опустіть обережно в досліджувану речовину кульку і частину трубки термометра. Слідкуйте, щоб він не торкався дна і стінок посудини. Тільки при додержанні цих умов термометр показуватиме температуру правильно.
3. Почекайте кілька хвилин поки зупиниться рівень стовпчика в капілярі, а потім запишіть показання термометра. Око спостерігача повинно знаходитись на одній лінії з рівнем рідини в капілярі.
Тема 2 Біологічна роль води. Вода і рослинні організми.
Рекомендована література до теми.
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 111 – 128
- М.А. Прокофьев(редак.)Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 98 – 105
- Ф.А. Деркач Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 55
- Практичні роботи з хімії . за ред.. Н.М.Буринської. К. «Освіта» 1974. С.3 - 39
- Л.В. Туріщева. Енциклопедія хімічних розваг. Х. ВГ «Основа».2003. С. 45 – 47
- Я.Л.Гольдфарб, Ю.В. Ходаков, Ю.Б. Додонов. Збірник задач і вправ з хімії 8 – 11 класи. К.: Рад. Шк. 1983 С. 19 – 20.
- Авторські задачі з екології
- Г.О.Казидуб. Зв'язок викладання хімії з сільським господарством. К.Рад. шк.. 1987. С.22 – 28
- І.Х.Сухарєва. Фізіологія рослин. К. Рад.шк. 1972 С. 64 – 79.
- Рик Моррис. Тайны живой природы. М. «РОСМЭН» 1997 С.58 – 59
- І.М. Григора і ін. Курс загальної ботаніки. К. Фітосоціоцентр 2003.
С. 120, 147 – 157, 445 – 446.
12. Є.М. Федій. Фізіологія тварин. К. Рад.шк. 1971. С. 79 – 82, 87 – 89.
13. Методичні рекомендації до лабораторних занять з дисципліни «Фізіологія рослин». К. Фітосоціоцентр. 2000. С. 19 – 33
14. П.А. Генкель. Физиология растений. М. Просвещение. 1970. С. 68 – 87
15. В.О. Корчагіна. Біологія 6 - 7 класи. К. Рад.шк. 1991. С.40,82 – 83.
Заняття 4 Біологічна роль води. Вода і рослинні організми.(Теоретичне заняття)
Мета: Показати значення води для живих організмів взагалі та рослинних організмів зокрема.
План
- Значення води для живих істот.
- Вода і можливості життя.
- Кількість води в рослинних організмах.
- Поняття про осмос і тургор.
- Надходження води в рослину і її рух по стеблу.
- Поняття про плач рослин. Гутація.
- Виділення води рослинами.
- Відношення рослин до дефіциту води.
Заняття 5. Дослідження вмісту води в рослинах.
(Практичне заняття)
Мета: навчитися визначати вміст вологи у зразках рослинного характеру, закріпити і відновити знання про роль води у житті рослин, навчитися практично застосовувати дані знання при вирощуванні рослин та поводжені з ними.
Дослід 10. При диханні рослина виділяє водяну пару.
Під скляний ковпак або в скляну посудину з кришкою поміщуємо кілька стеблин свіжо зрізаних рослин. Через деякий час на стінка посудини будемо спостерігати крапельки води. Отже, рослинний організм виділяє вологу.
Дослід 11 Дихання плодів і насіння.
Той же дослід можна проводити з помішуванням рослин у поліетиленовий пакет і щільно його зав’язати. Через 1 – 2 години ( краще дослід закласти на одній з перших перерв між уроками, щоб до заняття гуртка залишалось 4 – 5 годин) відкрити пакет і перевірити стан рослин. Вони стануть вологими і на стінках пакета теж виділиться волога.
Варіанти досліджень:
- Плоди теж виділяють вологу. В поліетиленовий пакет можна помістити фрукти – яблука, груші, лимони – кожний вид окремо чи всі разом. Спостерігається теж зволоження стінок пакета.
- Здавалося б насіння рослин сухе, але після помішування його в закриту скляну посудину чи в сухий поліетиленовий пакет на 1 – 2 доби на стінках пакета чи склі теж видно сліди водяної пари.
Дослід 12. Визначення кількості води, яку виділяють рослини.
У скляну посудину поміщуємо гілочку рослини. Верх посудини закриваємо (обв’язуємо) водонепроникною плівкою з поліетилену, паперу. Підготовлену посудину з рослиною зважуємо на терезах. Можна залишати рослину на шальці терезів на весь час досліджень. Спостерігати за тим, як шалька терезів з рослиною почне підніматися, її маса зменшуватиметься. Для певності рівень води на початку досліду відмічаємо на стінках посудини. Теж зробимо і під кінець досліджень. Через 2 доби ми можемо знову зрівноважити шальки терезів, добавляючи важки на шальку з рослиною. Кількість добавлених грамів чи міліграмів і буде масою виділеної вологи з посудини. Для того, щоб добре було помітно зміну рівня води в посудині з рослиною, дослід продовжимо іще на 1 – 2 доби. У звичайній посудині ми можемо судити тільки про зміну висоти рівня води під час проведення досліду. Якщо взяти для досліджень мірний циліндр чи мензурку, то можна від слідкувати і об’єм випаруваної води рослиною.
Варіант досліду: якщо замість гілочки рослини взяти великий листок і визначити його площу за допомогою палетки, то можна обчислити кількість вологи, яку виділяє 1 см2 поверхні листка за певний час ( за добу чи дві доби).
Заняття 6. Біологічна роль води для рослин
(Практичне заняття)
Мета: Розширити поняття про осмотичний тиск і тургор рослин, всмоктування води рослинами з грунту та виділення надлишкової води рослинами.
Дослід 13. Осмотичний тиск
Для ознайомлення з явищем осмотичного тиску служить спеціальний прилад . Він складається з форштоса та скляної трубки діаметром 3—5 мм і довжиною не менше 1 м. Широкий отвір форштоса щільно затягнутий бичачим пузирем, який служить напівпроникною перетинкою.
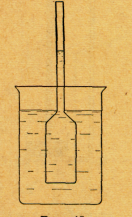 Налийте у форштос доверху насиченого розчину цукру, підфарбованого фуксином або червоним чорнилом. Верхній отвір форштоса з'єднайте резиновою трубкою з довгою скляною трубкою, закріпленою в затискачі штатива. До другого кінця скляної трубки приєднайте таким самим способом другу, зігнуту скляну трубку з закріпленим на ній м'яким дротом невеличким стаканчиком.
Налийте у форштос доверху насиченого розчину цукру, підфарбованого фуксином або червоним чорнилом. Верхній отвір форштоса з'єднайте резиновою трубкою з довгою скляною трубкою, закріпленою в затискачі штатива. До другого кінця скляної трубки приєднайте таким самим способом другу, зігнуту скляну трубку з закріпленим на ній м'яким дротом невеличким стаканчиком.
Приготовлений для досліду прилад занурте в широкий стакан з водою, як показано на рисунку, і залишіть на кілька днів. Вода буде просочуватися в прилад через напівпроникну перетинку і підфарбований розчин поступово підніметься в трубці. Через кілька днів розчин підніметься до самого верху і краплями виливатиметься через зігнуту трубку в стаканчик.
Дослід 14. Всмоктування води коренями рослин.
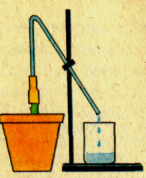 Переконаймося в тому, що корені вбирають з грунту воду з розчиненими в ній речовинами. Зріжемо кімнатну рослину бальзамін або три-чотиритижневий проросток соняшника чи квасолі так, щоб лишився пеньок заввишки 2—3 см. На пеньок надінемо гумову трубку завдовжки 3 см, наллємо в неї трохи води і на її верхній кінець надінемо скляну трубку
Переконаймося в тому, що корені вбирають з грунту воду з розчиненими в ній речовинами. Зріжемо кімнатну рослину бальзамін або три-чотиритижневий проросток соняшника чи квасолі так, щоб лишився пеньок заввишки 2—3 см. На пеньок надінемо гумову трубку завдовжки 3 см, наллємо в неї трохи води і на її верхній кінець надінемо скляну трубку
заввишки 20—25 см, зігнуту так, як зображено на малюнку . Через якийсь час вода в скляній трубці підніметься і витікатиме назовні. Звідки береться вода, що витікає з трубки? Воду з грунту вбирає корінь. Судинами кореня вона під тиском надходить у пеньок, а потім у трубку. Цей тиск називають кореневим. Кореневий тиск сприяє надходженню води з кореня в стебло.
Якщо грунт у горщику із зрізаною рослиною полити теплою водою, вода почне швидше підніматися по трубці й витікати з неї. А після поливання грунту дуже холодною водою вода перестане підніматися. Отже, вбирання коренем води залежить від температури.
Дослід 15 . Рух води по стеблу рослин.
Воду і мінеральні речовини корінь вбирає з грунту. Але ці речовини не залишаються в корені, а піднімаються судинами вгору й надходять у стебло, 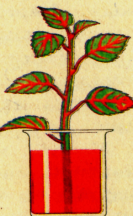 листки, квітки, плоди і насіння. Яким шляхом вода й мінеральні речовини потрапляють з кореня в інші органи рослини?
листки, квітки, плоди і насіння. Яким шляхом вода й мінеральні речовини потрапляють з кореня в інші органи рослини?
Поставимо у посудину з водою гілочку бальзаміну або підсніжник. Воду забарвимо чорнилом для кращого спостереження шляху води у рослин.
Розглянемо зріз пагона з гілки, поставленої у воду з чорнилом. Чорнило забарвило тільки деревину.
У досліді чорнило ніби замінювало мінеральні речовини, розчинені у воді. Розчини цих речовин, як і забарвлена вода, піднімаються від кореня вгору всередині стебла судинами деревини.
Якщо ж у воду, забарвлену чорнилом, ви поставите листки герані з довгими черешками або гілочки кімнатної рослини бальзаміну, то можна побачити, як вода піднімається по стеблу в листки, забарвлюючи їхні жилки .
Дослід 16. Явище гутації у рослин.
Зовнішнім проявом кореневого тиску є так званий плач рослин. Навесні, якщо зрізати гілочку берези, клена чи винограду виступають краплини вологи.
Спостерігати виділення краплин вологи можна і у кімнатних рослин бальзаміну, калли, монстери. На кінчиках листової пластинки часто помітні краплі води.
Заняття 7.Вода в рослинах
(Практичне заняття).
Мета: практично визначити вміст вологи в рослинах різних місць зростання методом висушування зразка та ознайомитися з використанням методу карбідного для визначення вологості у зразках.
Дослід 17. Визначення вмісту вологи у досліджуваних об’єктах шляхом висушування зразка.
Дослід краще проводити з використанням сушильної шафи. При її відсутності можна використати і таку методику проведення досліду.
Для роботи необхідні: обладнання і хімічний посуд: зразок досліджуваного матеріалу (рослини) лабораторний штатив з кільцем, дротяний трикутник, нагрівальний прилад, технохімічні терези, важки, фарфоровий тигель, ножиці, тигельні щипці, ексикатор, фільтрувальний папір, сірники, м'яка ганчірка.
Порядок виконання роботи
1. Прожарте чистий фарфоровий тигель у полум'ї протягом 2 хв, тримаючи його тигельними щипцями. Охолодіть тигель в ексикаторі .
2. Зважте тигель на технохімічних терезах з точністю до 0,01 г. Запишіть масу пустого тиглю.
3. Зважте в тиглі 1—1,3 г дрібно порізаних рослин. Запишіть масу тиглю з наважкою рослинної маси.
4. Помістіть тигель у дротяний трикутник на кільці штатива, прожарте вміст протягом 8—10 хв. Що спостерігаєте?
5. Охолодіть тигель з наважкою в ексикаторі. Чому не можна тигель з наважкою охолоджувати на повітрі? Зважте тигель і запишіть його масу із наважкою після прожарювання.
6. Знову прожарте тигель з наважкою протягом 4— 5 хв.
7. Охолодіть тигель і знову зважте його з наважкою. Якщо маса буде майже такою самою, як і в першому випадку, прожарювання припиніть. У іншому разі тигель прожарте ще раз.
8. Обчисліть: а) масу води, яка випарилася
б) масову частку води в наважці рослин.
9. Оформіть звіт про виконану роботу.
Форма запису спостережень і розрахунків
Маса пустого тиглю — т1 г............... .
Маса тиглю з наважкою рослин — т2 г..........
Маса наважки рослин т1— т2 г ..........
Маса тиглю з наважкою після першого і другого прожарювання — т3 і — т4 г ..........
Постійна маса тиглю з наважкою т5 г..........
Маса рослин — т2 — т5 г .......
Маса води ( т1— т2 )—( т2 — т5 )г . . . .
Масова частка води в наважці рослин ................
Дослід 18 Визначення вмісту вологи у досліджуваних зразках об’ємним (карбідним) методом.
Теоретичні дані:
Пропонований метод визначення вогкості є об’ємним методом. Він простий, зручний, точний, вимагає значно менше часу. Обов'язкове при ваговому визначенні вогкості довготривале висушування і багатократне зважування тут замінюється одним зважуванням. За допомогою об'ємного методу вологість можна визначити в газах, рідинах і в твердих речовинах.. В основу об'ємного методу визначення вологості покладено відома взаємодія води з карбідом кальцію
СаС2 + 2Н2О = Са(ОН) 2 + С2Н2
З рівняння видно, що 36 г води (вологи) еквівалентні при нормальних умовах 22,4 л ацетилену. В таблиці 2 наведені об'ємні величини ацетилену, відповідні різним кількостям води в досліджуваній наважці. Кількість води в досліджуваному зразку
|
Кількість води в досліджуваному зразку (вмг)
|
Об'єм ацетилену , що виділився, за нормальних умов (в мг |
Об'їм того, що виділився ацетилену при 20° С (в мл) |
|
|
1000 |
620 |
843 |
|
|
100 |
62 |
84,3 |
|
|
10 |
6,2 |
8,43 |
|
|
1 |
0,6 |
0,8 |
|
З таблиці видно, що 1 мг вологи еквівалентний 0,8 мл (при 20°С) ацетилену, що виділяється.
З досліджуваної речовини при відважуванні 1 г і вмістом вологи 1 мг виділяється 0,8 мл ацетилену, тобто об'єму, що виділяється при вологості в 0,1%. При відважуванні досліджуваної речовини в 1 г і граничному вмісті вологи до 100% кількість необхідного карбіду кальцію визначається з рівняння:
2Н 2О + СаС 2 = Са(ОН) 2 + С2Н2
Розрахунки показують, що 2 г карбіду кальцію достатні для будь-якого випадку, якщо наважка досліджуваної речовини не більше 1г. У разі малого вмісту вологи в досліджуваній речовині точність визначення може бути забезпечена збільшенням наважки досліджуваної речовини.
В таблиці 3 наведені наважки досліджуваної речовини залежно від передбачуваної вогкості, що рекомендуються.
Таблиця 3
|
Передбачувана вологість |
Дослідна наважка |
|
досліджуваної речовини (в °/0) |
речовини (в г) |
|
100 |
1 |
|
75 |
1 5 |
|
50 |
2 |
|
25 |
4 |
|
10 |
10 |
|
5 і нижче |
20 |
Обладнання і матеріали. Терези з наважками, бюретка на 100 мл, воронка, гумова трубка 50 см, дві пробірки діаметром 3 см, два трійники, затискач Гофмана, карбід кальцію, розчин кухонної солі.
Хід роботи.
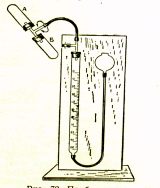 При визначенні вологості наважка досліджуваної речовини поміщається в пробірку А. В пробірку Б насипають порошок карбіду кальцію , що зберігався в склянці з притертою пробкою.
При визначенні вологості наважка досліджуваної речовини поміщається в пробірку А. В пробірку Б насипають порошок карбіду кальцію , що зберігався в склянці з притертою пробкою.
Для зручності дослідження пробірки А і Б повинні бути широкими і короткими з діаметром 3 см і завдовжки 10 см). Бюретку наповнюють насиченим водним розчином кухонної солі до нульової поділки. Пробірки
зєднуються з трійником з широкою сполучною горловиною 1,5 см в
діаметрі. Зажим на трійнику у бюретці закривається тоді, коли все підготовлено до досліду і рівень розчину установлено на нулі.
Взаємодія досліджуваної речовини з карбідом кальцію здійснюється за рахунок обертання трійника з пробірками. При цьому наважка змішується з карбідом кальцію і, контактуючи з ним, втрачає вологу. У разі визначення вологості в рідких продуктах при змішуванні з карбідом кальцію вони легко обтікають і втрачають вологу протягом 1 хв. У разі визначення вологості твердих речовин заздалегідь подрібнених до сипкого стану повнота взаємодії досягається обертанням трійника з пробірками протягом 3—5 хв.
Точність об'ємного методу досягає 0,1%. Не дивлячись на те, що при ваговому методі може бути досягнута ще більша точність, по швидкості він поступається об'ємному методу в 10—15 разів. Там, де при ваговому методі для визначення вологості потрібно 1,5год., при об'ємному методі витрачається тільки 5—8 хв.
Заняття 8 Вода в організмі тварин і людини.
(Теоретичне заняття)
Мета: показати біологічну роль води для тваринних організмів і людини, розширити знання учнів про функції води в організмах, дати поняття ендогенна, каналізаційна вода, показати пристосування живих організмів до життя в пустелі.
План
1.Баланс води в живому організмі.
2. Вміст води в тканинах і органах тварин та людини.
- Вода і можливості життя тварин і людини.
- Функції води в організмі – споживання і виділення.
- Шляхи використання води в організмі людини.
- Ендогенна вода у жителів пустель.
- Вода і склад крові.
- Поняття спраги.
Заняття 9. Розв’язування задач та ігор з теми
«Біологічна роль води»
Мета: закріпити знання учнів з вивченої теми, навчати використовувати їх при розв’язуванні різного виду завдань.
 Завдання 1. В якому лісі стежинка після дощу довше буде вологою і чому?
Завдання 1. В якому лісі стежинка після дощу довше буде вологою і чому?
Відповідь. Довше буде вологою стежинка в листяному лісі, бо листяні юроди дерев випаровують приблизно в 8-10 разів більше води, ніж хвойні, тому повітря там буде більш вологим.
Задача № 1.
У складі рослин від 40% до 90% вологи. Визначте, яка маса води міститься у рослинах масою 112 кілограмів, зібраних з 1 гектара пустелі. Оводненість рослин у даному випадку становить 30%. Порівняйте результати, коли таку ж масу рослин зібрати на болоті, де оводненість рослин становить 70%.
Задача № 2.
Верблюди витримують втрату маси тіла до 27%. Яка маса жиру з горбів верблюда масою 300 кілограмів повинна розкластися щоб поповнити запас вологи, якщо 1 грам жиру при розкладі дає 0,6 грама води?
Задача № 3.
Добова потреба у воді для підтримання життєдіяльності людини становить 2 літри. На господарські потреби людина витрачає в середньому 170 літрів води на добу. Визначте скільки споживають води жителі села (4500 осіб) для підтримання життя і для ведення господарства за добу, за рік.
Задача № 4.
Кенгуровий пацюк в лабораторних умовах з’їдаючи 100 грамів сухої крупи на місяць утворює води 54 грами. Яка маса води може утворитися за все життя його, що триває в середньому 3 роки.
Задача №5.
На вирощування 1 тонни пшениці потрібно витратити 1500 тонн води. Яка маса води витрачається на отримання річного врожаю з полів усієї України якщо було зібрано 10 мільйонів тонн пшениці? Яку масу води потрібно для вирощування врожаю пшениці 60 центнерів на 1 гектарі? Якої б товщини був шар води коли б її розлити на цій території?
Задача № 6.
При вирощуванні 1 тонни пшениці, рису та бавовнику витрачається води відповідно 1500 тонн, 7000 тонн, 10000 тонн. Людина для задоволення своїх потреб витрачає 170 літрів води на добу. Скільки води витрачає людина за своє життя ( 75 років)? Порівняйте дані по витратах води при вирощуванні 1 тонни пшениці, рису, бавовнику.
Задача № 7.
Для людини втрата 10% маси тіла ( зневоднення організму) – смертельна. Верблюд витримує 27 % втрати маси, вівця – 23%, собака – 17%. Визначте втрати в масі від зневоднення організму людини вагою 70 кілограмів, верблюда вагою 650 кілограмів, вівці вагою 60 кілограмів та собаки вагою 20 кілограмів.
Задача № 8.
У плодах кавуна є 94% води. Визначте, яка маса води може бути у кавунах вирощених на 5 гектарах , якщо врожайність з 1 гектара 820 центнерів. Якої висоти з площею 1 м2 основи утворився б стовп даної води?
Тема 3: Фізичні властивості води
Рекомендована література з теми:
- Б.В. Некрасов. Основы общей химии.М.Химия. 1973 Т.ІІ С. 106, 131 - 139 , 504, 511
- М.Д. Василева . Цікава хімія. К.: Рад.шк. 1980. С..55 – 56, 83 – 84
- Л.А Кульский. Вода, её использование в настоящем и будущем. К. Общ.»Знание» 1977. С. 8 - 18
- В.А.Крицман (составитель) Книга для чтения по неорганической химии. Т.І. : М.Просвещение. С.33 – 39
- В.А.Крицман (составитель) Книга для чтения по неорганической химии. Т.І І. : М.Просвещение. С.163 – 181
- О.І.Астахов. Цікаві роботи з хімії. К.: Рад.шк. 1968. С. 36
- М.А.Иванов. Химический демонстрационний експеримент. М. Висшая школа. 1969. С. 16 – 18
- В.С. Полосин, В.Г. Прокопенко. Практикум по методике преподавания химии. М.Просвещение 1989. С. 122 – 126, 195
- М.А. Прокофьев(редак.)Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 98 - 105
- І.М.Чертков,П.Н.Жуков Хімічний експеримент з малими кількостями реактивів.М. «Просвещение» 1980.С.71, 92 - 93
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 111 – 128, с. 80
- М.М.Скаткін. Природознавство. Підручник 5 клас.К.: Рад.шк. 1989. С. 41 – 43
- М.Г. Голованов. Чудеса сучасної хімії. К.: Рад.шк. 1968. С. 80
- Л.В. Туріщева. Енциклопедія хімічних розваг. Х. ВГ «Основа».2003.
- С. 45 – 47
- Я.Л.Гольдфарб, Ю.В. Ходаков, Ю.Б. Додонов. Збірник задач і вправ з хімії 8 – 11 класи. К.: Рад. Шк. 1983 С. 19 – 20.
- Ф.А. Деркач Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 250 – 251
- Ж. Верн. Таємничий острів
- Антуан де Сент Екзюпері. Планета людей.
- Боковой Микола, Тюкова Уляна( Туріщева Л.В. Енциклопедія хімічних розваг с 23)
Заняття 10. Склад води.
(Теоретичне заняття)
Мета: дати поняття про історію вивчення складу води різними вченими, про будову молекули води з точки зору сучасних досягнень хімії та фізики, поняття «важка вода» та її вплив на живі організми.
План
1. Історична довідка про вивчення складу води. «Мертва і жива вода»
з народних казок.
2. Склад молекули води.
3. Графічна та електронна формули води.
4. Ізотопи Гідрогену – Дейтерій і Тритій.
5. Поняття «Важка вода».
6. Важка вода та її вплив на живі організми.
7. Яка іще буває вода?
«Окислена вода»
«Окисленою водою» назвав пероксоводень французький хімік Л. Тенар, вперше добувши його у 1818 р. Дослідника вразило те, що нова сполука нагадувала воду, але розкладалася з утворенням звичайної води і газоподібного кисню, від якого спалахувала жевріюча скалка.
Розведені розчини «окисленої води» в лабораторії можна добути з пероксидів натрію чи барію. У техніці пероксоводень добувають гідролізом пероксодисульфатної кислоти Н2S2О8:
Н2S2О8 + 2Н2О = 2Н2SО4 + Н2О2.
Пероксоводень можна добути розкладом органічних пероксосполук, а також прямим синтезом з газоподібних водню та кисню в присутності каталізаторів.
Безводний Н2О2 замерзає при —1,7° С, а кипить під звичайним тиском при 151° С. При цьому рідина швидко розкладається, а нерідко й вибухає. Папір, вата, тирса та інші горючі речовини від зіткнення з безводним або висококонцентрованим Н2О2 спалахують. Концентрований пероксоводень обпікає шкіру, при цьому вона біліє і на ній утворюються тріщини.
Пероксоводень, як і звичайна вода, добре розчиняє чимало солей. Цікаво, що чисті Н2О2 і Н2О замерзають близько 0° С, а їх розчини, навпаки, замерзають при дуже низькій температурі. Так, 60-процентний розчин Н2О2 твердне при —53° С.
Концентрований Н2О2 зберігають у бутлях з темного скла, бо він на світлі розкладається. Швидко розкладають «окислену воду» навіть незначні домішки таких металів, як мідь, залізо, марганець тощо. Ще швидше розкладає пероксоводень фермент каталаза. Вона завжди є в клітинах організму. Без неї організм загинув би від отруєння пероксоводнем, який утворюється в організмі як проміжний продукт окислення. Отож, якщо рану змочити 3-процентним розчином пероксоводню, він раптово «закипає». Це спрацювала каталаза.
Виготовлення гашеного вапна і вапняної води
Оксид кальцію перенесіть у фарфорову чашку і додайте невеликими порціями воду, поки вона не перестане вбиратися. Спостерігайте розпушення оксиду кальцію (негашеного вапна) і перетворення його в пухкий порошок гідроксиду кальцію (пушонка). Зверніть увагу на нагрівання реагуючої суміші. Одержаний порошок розмішайте з водою до утворення однорідної тістоподібної маси (гашеного вапна).
Гашене вапно перенесіть у стакан і додайте води з розрахунку 50 мл води на 1 г оксиду кальцію. Старанно розмішайте суміш скляною паличкою до утворення однорідної суспензії гідроксиду кальцію (вапняне молоко). Профільтруйте його (або дайте відстоятись і злийте прозорий розчин з осаду). Розчин гідроксиду кальцію у воді називають вапняною водою.
Виготовлення баритової води
Відважте 1,5 г оксиду барію і розчиніть його в 50 мл дистильованої води. Розчин (баритова вода) профільтруйте і вилийте в склянку з притертою пробкою.
Заняття 11 . Дослідження складу води.
(Практичне заняття)
Мета: навчити практично проводити аналіз і синтез води, користуватися спеціальними приладами евдіометром та приладом Гофмана.
Дослід 19 « Синтез води»
(Обережно!)
Утворення і вибух гримучої суміші
Наповніть невеликий (100—150 мл) циліндр водою і, закривши його отвір скляною пластинкою, поставте у водяну ванну. Наповніть циліндр на 1/3 об'єму киснем з газометра і на 2/з — воднем з апарата Кіппа. Закрийте його скляною пластинкою і вийміть з води, тримаючи догори дном. Обгорніть циліндр рушником, залишивши вільним тільки отвір, відкрийте і піднесіть до полум'я пальника. Спалювання суміші супроводжується сильним вибухом.
Вибух гримучого газу
У дні високої залізної бляшанки — місткістю 0,5— 1 л шилом або цвяхом пробивають невеликий отвір. Отвір щільно закривають кусочком сірника і бляшанку наповнюють воднем, витискуючи з неї повітря. Газоподібний водень слід пропускати 5—6 хв. Бляшанку ставлять на стіл і підпалюють кусочок сірника палаючою скіпкою або свічкою, прикріпленою до дротини. Сірник згоряє і підпалює водень, що витікає з бляшанки через отвір. Водень горить майже безбарвним полум'ям. Та ось, через кілька хвилин чується протяжний свист, а потім — гучний вибух, від якого бляшанка підстрибує і перевертається.
Це явище пояснюється досить просто. Водень, що виривається назовні, згоряє спокійним безбарвним полум'ям. Натомість у бляшанку знизу надходить повітря. І в той момент, коли об'ємне співвідношення між воднем і киснем повітря становить 2:1, суміш вибухає внаслідок розгалуженої (лавинної) ланцюгової реакції:
Н2 + О2 = 2НО*,
НО* + Н2 = Н2О + Н*,
Н* + О2 = НО* + О*,
О*+ Н2 = НО* + Н* і т. д.
При цьому розвивається висока температура, яка і спричиняє раптове розширення значного об'єму водяної пари.
(Описаний дослід слід ретельно проробити кілька разів, щоб на занятті гуртка він виглядав ефектно.)
(Цікава хімія с 142)
Дослід 20. Вивчення складу води.
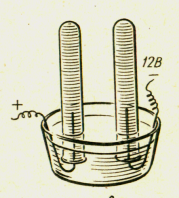
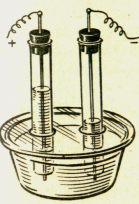 Розклад води електричним струмом проводять з допомогою приладу Гофмана або саморобного приладу, який можна скласти з деталей НДХП. Для електролізу води використовують постійний електричний струм напругою 10 – 12 вольт. В прилад заливають 5% розчин гідрооксиду натрію, так як практично чиста вода не проводить електричний струм.
Розклад води електричним струмом проводять з допомогою приладу Гофмана або саморобного приладу, який можна скласти з деталей НДХП. Для електролізу води використовують постійний електричний струм напругою 10 – 12 вольт. В прилад заливають 5% розчин гідрооксиду натрію, так як практично чиста вода не проводить електричний струм.
Після отримання газів у пробірках прилад відключають від джерела струму , закривають отвори пробірок і проводять дослідження газів. Кисню виділяється у 2 рази менше, ніж водню. Підносять до отворів пробірок тліючу, а потім запалену скіпки. У посудині з киснем тліюча загориться, а горюча може запалити водень, якщо він чистий ми почуємо звук «пах» втягуваного у пробірку повітря, якщо водень був у суміші з повітрям.
Казка про воду
Жила-була Молекула води. Мала вона легковажний характер, який змінювала залежно від температури. Частіше за все вона приємно дзюрчала, була спокійною, але дуже непосидючою, оскільки ніяк не могла набути постійної форми. При температурі 0 °С вона ставала твердою, упертою та в суперечках з іншими ставала білою. При температурі 100 °С вона набувала легкого характеру, легко пристосовувалась до оточуючих.
Мала Вода слуг: двох близнюків Гідрогена та Оксигена. Куди б не пішла Вода, слуги завжди були поряд з нею. Один від одного вони далі, ніж на два кроки, відійти не могли, якась сила утримувала їх поряд. Слуги хотіли жити своїм життям і ні від кого не залежати. Часто мріяли вони про те, як два Гідрогени відкриють свою фірму з виробництва водневого пального, а Оксиген — фірму з виробництва оксидів. Але вони знали, що їхні мрії навряд чи здійсняться.
Аж ось одного разу розігралася негода. Піднявся вітер, пішов дощ, який перетворився на страшну грозу з громом і блискавками. Вода дивилася на грозу, й тут електричний розряд поцілив прямо в неї. І... вода зникла. У ту саму мить два Гідрогени й Оксиген розлетілися в різні боки. «Ура! Воля!» — кричали вони.
Через деякий час на симпозіумі, присвяченому екологічним проблемам, два директори фірм зустрілися. Два Водні заснували не лише фірму «Водневе пальне», але й фірми «Амоніак», «Метиловий спирт». А Кисень, будучи директором найпопулярнішої та найвідомішої фірми «Оксиди», був засновником фірм «Кисневе дуття», а також — спонсором лікарень. Так мрії колишніх слуг втілились у життя.
Боковой Микола, Тюкова Уляна( Енцикл. Х. розв с 23)
Фрагмент з роману Ж. Верна «Таємничий острів»
«— Яке паливо замінить вугілля?
- Вода,— відповів інженер.
- Вода? - перепитав Пенкроф...
- Так, але вода, розкладена на складові частини,- пояснив Сайєрс Сміт. - Без сумніву, це буде робитися за допомогою електрики, яка в руках людини стане могутньою силою. Так, я впевнений, що настане день, і вода замінить паливо; Гідроген і Оксиген, які входять до її складу, будуть застосовуватись і окремо; вони будуть невичерпним і таким потужним джерелом тепла і світла, що вугіллю до них далеко! Настане день, друзі мої, і в трюми пароплавів будуть завантажувати не вугілля, а балони з двома цими стиснутими газами, і вони будуть згоряти з велетенською тепловою віддачею... Вода - це вугілля наступних століть».
Заняття 12. Фізичні властивості води.
(Теоретичне заняття)
Мета: розширити знання учнів про фізичні властивості води, дати поняття «аномалії води» та їх значення для живих організмів, поняття «розчинність речовин» у воді та роль води у рельєфотворчих процесах.
План.
- Фізичні властивості води: - агрегатний стан, температура плавлення і кипіння, густина води, поверхневий натяг.
- Аномалії води.
- Будова льоду.
- Замерзання водойм і життя під льодом.
- Температура води та її вплив на розвиток живого, на розмноження водних тварин.
- Поняття «тала вода» і «жива вода».
- Вода як розчинник. Карстові печери.
Золото з води
Давня мрія алхіміків — перетворення елементів — здійснилася тільки в наш вік, вік атомної енергії: штучне золото можна добути в атомних реакторах внаслідок ядерних процесів. Правда, практичного значення поки що цей спосіб не має, але у ядерної хімії ще все попереду...
Та хіміки обрали інший шлях — вони зацікавилися золотом,, що є у воді. Так, так, у воді. Навіть у найчистішій джерельній воді хіміки знаходять олово, стронцій/ ванадій, золото, уран — мало не всі елементи таблиці Менделєєва. Нічого дивного: природа не знає зовсім нерозчинних речовин. Невелика брила граніту, наприклад, може розтати на річковому перекаті за 10—20 років.
1 кубометр річкової води містить в середньому 0,25 міліграма золота. Волга, наприклад, виносить у море за рік 252 кубічних кілометри води і разом з ними 640 тонн золота. Чи багато це? Судіть самі, якщо наприкінці минулого століття в царській Росії добувалося лише 35 тонн золота на рік.
Вчені підрахували, що в кубічному кілометрі води океану міститься 5,5—5,7 тонни золота, а загалом у морях і океанах золота має бути понад 200 мільярдів тонн. Для того щоб перевезти таку кількість золота, потрібно близько 500 мільйонів вагонів. З цього золота можна було б скласти 200 пірамід Хеопса, кожна з яких мала б висоту 147 метрів і площу основи 40 000 квадратних метрів. Якби золото, що міститься в морській воді, рівномірно розподілити серед населення земної кулі, то на кожного мешканця нашої планети припало б по 2 тонни цього благородного металу.
(Чудеса суч х с 80 – 83)


Питання для географів. Чому показники термометрів, які опущено в киплячу воду, у випадках, що зображено на рисунках, є різними? Чи можна за цими показниками визначити висоту гори?
Відповідь. Температура кипіння залежить від атмосферного тиску. На горі атмосферний тиск нижчий, ніж на рівні моря, тому вода на горі закипить за більш низької температури. У шахті точка кипіння є більш високою внаслідок збільшеного атмосферного тиску.
Для визначення висоти гори можна використовувати такий факт: на кожний кілометр підйому відносно рівня моря температура кипіння води зменшується на 3 °С.
Заняття 13 – 14 . Дослідження фізичних властивостей води.(Практичне заняття)
Дослід 21. Вимірювання температури води.
1. Налийте в пробірку 3—4 мл води. Можна використати високий мірний циліндр, тоді води наливаємо 1/3 його місткості.
2. Опустіть обережно в досліджувану речовину кульку і частину трубки термометра. Слідкуйте, щоб він не торкався дна і стінок посудини. Тільки при додержанні цих умов термометр показуватиме температуру правильно.
3. Почекайте кілька хвилин поки зупиниться рівень стовпчика в капілярі, а потім запишіть показання термометра. Під час вимірювання температури води термометр у ній повинен знаходитися 5 – 7 хв. Око спостерігача повинно знаходитись на одній лінії з рівнем рідини в капілярі.
Дослід 22. Вимірювання температури води у водоймі.
Температуру зручно вимірювати за допомогою термометра, прикріпленого до стрижня, завдовжки 50 см. Термометри витримують у воді не менше 5 хв.
Проводять достатню кількість вимірювань на поверхні, на глибині, біля берегів, посередині потоку, а потім підраховують середню температуру.
Дослід 23. Вимірювання густини води
1. Налийте досліджуваної рідини в циліндр не менше 0,5 л так, щоб її рівень не доходив до краю циліндра на кілька сантиметрів.
2. Опустіть плавно ареометр в розчин, щоб він набув вертикального положення, як показано на малюнку
Слідкуйте, щоб він знаходився саме посередині циліндра і не торкався його стінок.
3. Визначте на шкалі показники, як тільки ареометр установиться. Під час спостереження очі і меніск повинні знаходитися на одному рівні. Для прозорих рідин відлік ведеться за нижнім меніском, а для непрозорих — за верхнім.
4. Підніміть на 1—2 см ареометр і знову опустіть його в розчин. Визначте ще раз показники і запишіть їх у зошиті
5. Вилийте рідину у склянку. Вимийте ареометр водою, витріть його і покладіть у футляр.
 Дослід 24. Що відбувається з водою при нагріванні і охолодженні.
Дослід 24. Що відбувається з водою при нагріванні і охолодженні.
Дослід А. Наповніть колбу водою, підфарбованою чорнилом. Закрийте її пробкою з трубкою. Частина води зайде в трубку. На трубку в тому місці,
до якого дійшла вода, приклейте папірець. Поставте колбу в гарячу воду (мал. 26). Через якийсь час вода в трубці підніметься. Це тому, що від нагрівання вода розширюється.
Дослід Б. Поставте колбу в тарілку із снігом. Вода в трубці незабаром почне опускатися. Це то му, що від охолодження до + 4 °С вона стискується. Коли воду охолоджувати далі, вона знову розширюватиметься.
Дослід В . У великий мороз надвір виставте щільно закриту пляшку з водою. Коли вода замерзла, пляшка лопнула й розпалася на куски . Це сталося тому, що вода, замерзаючи, розширилася. Такий же дослід можна провести з невеликою кількістю води і влітку. Набрану в посудину воду закривають щільно пробкою, обгортають тканиною і кладуть у морозильну камеру. Коли вода замерзає і розриває посудину, її скалки залишаються в тканині. Обережно виймають тканину з льодом і скалками посудини з холодильника , розглядають. Для вдалого проведення досліду бажано брати тонкостінну посудину.
Дослід 25. Вимірювання температури кипіння води.
1. Налийте в пробірку 3—4 мл води, закріпіть у лапці штатива або електронагрівача. Нагрійте воду до кипіння.
2. Опустіть обережно в досліджувану речовину кульку і частину трубки термометра. Слідкуйте, щоб він не торкався дна і стінок посудини. Тільки при додержанні цих умов термометр показуватиме температуру правильно.
3. Почекайте кілька хвилин поки зупиниться рівень стовпчика в капілярі, а потім запишіть показання термометра. Око спостерігача повинно знаходитись на одній лінії з рівнем рідини в капілярі.
Дослід 26 Речовини, розчинні і нерозчинні у воді.
Дослід 1. Насипте в склянку з водою чистої солі й розмішайте її ложечкою. Спостерігайте, що відбувається з кристалами солі. Вони стають дедалі меншими й незабаром зовсім зникають. Та чи зникла сіль? Сіль не зникла. Вона розчинилась у воді. Ви дістали розчин солі.
Пропустіть розчин солі крізь фільтр. На фільтрі нічого не осідає. Розчин солі вільно пройшов крізь фільтр.
Дослід 2. Проведіть дослід з питною содою так само, як з сіллю. Чи розчиняється у воді сода?
Дослід 3. Проведіть такий самий дослід з річковим піском. Піщинки осідають на дно склянки й лежать там, не змінюючись. Пропустіть воду крізь фільтр. Вода пройшла крізь нього, а пісок залишився на фільтрі. З цього досліду можна зробити висновок, що пісок не розчиняється у воді.
Дослід 4. Спробуйте розчинити глину. Частинки глини плаватимуть у воді, яка стає від них каламутною. Якщо дати воді постояти, частинки глини осядуть на дно. Якщо воду збовтати, вони піднімуться, а потім знову опустяться.
Пропустіть каламутну воду крізь паперовий фільтр ода стане чистою й прозорою, а частинки глини залишаться на фільтрі. Глина, як і пісок, не розчиняється у воді.
Так само можна перевірити будь-яку речовину, розчиняється вона у воді чи ні.
Дослід 27 Дослідження розчинених газів у воді.
-
 Наповнимо пробірку до країв водою і закриємо її пробкою із зігнутою трубкою. В пробірці не повинно бути бульбашок, і вода повинна заповнювати частину зігнутої трубки .
Наповнимо пробірку до країв водою і закриємо її пробкою із зігнутою трубкою. В пробірці не повинно бути бульбашок, і вода повинна заповнювати частину зігнутої трубки .
- Утримуючи пробірку горизонтально і злегка похило (так, щоб дно пробірки було чуть вище отвору пробірки), нагріємо воду в пробірці. Бульбашки повітря почнуть підніматися і збиратися у верхній частині пробірки в одну велику бульбашку. Неможна воду нагрівати до кипіния, бо утворювана при цьому пара может викинути всю воду через трубку.
3. Бульбашка повітря, що утворилася в пробірці після нагрівання, містить кисень, яким дихають риби і інші водні організми.
Дослід 28 Дослідження поверхневого натягу води.
Якщо наповнити склянку майже до країв водю і обережно покласти на поверхню води кусочок фільтрувального паперу з голкою, то папір, як тільки намокне, потоне, а голка залишиться на поверхні. Можна навіть спостерігати , як поверхня води прогинається під голкою. Голка не тоне від того, що поверхня води покрита плівкою, яка не проривається, дякуючи малій масі голки.
Ця водна плівка утримує на своїй поверхні жука – водомірку, який бігає по її поверхні як по асфальту.
Заняття 15 Розв’язування задач і вправ з теми «Розчинність речовин у воді» (Практичне заняття)
Мета: Закріпити знання учнів з теми шляхом розв’язування різних задач і вправ.
4-1. Випарюванням досуха насиченого при 10 °С розчину хлориду натрію масою 200 г добуто сіль масою 52,6 г. Яка розчинність хлориду натрію у вод1 при 10 °С?
4-2. Розчинність нітрату натрію при 10 °С дорівнюе 80,5 г. Скільки грам1в ще сол1 можна розчинити у воді масою 250 г при 10 °С?
4-3. Є ненасичений розчин штрату калш. Якими трьома способами з цього розчину можна приготувати насичений розчин?
4-4. Є насичений при 10 °С розчин хлориду калію. Якими двома способами з цього розчину можна приготувати ненасичений розчин?
4-5. З насиченого при 15 °С водного розчину хлориду барію масою 12,8 г випарюванням води добуто кристалопдрат ВаС12•2Н2О масою 4,1 г. Визначте розчиншеть хлориду барш ВаС12 (тобто безводної солі). Перев1рте результат обчислення за малюнком «криві розчинності»
4-6. Для розчинення кристалопдрату SгС12 • 6Н2О масою 84 г при 15 °С потрібна вода масою 100 г. Обчисл1ть розчиншеть хлориду стронцію (безводно).
4-7. 3 яких солей можна приготувати розчин, що містить більше розчинеиої речовини, ніж розчинника?
4-8. Яка мінімальна маса води потрібна для розчинення сульфату калію масою 7,5 г при 45 °С?
4-9. Скшьки грам1в нітрату свинцю міститься в його насиченому при 50 °С розчині масою 277 г?
4-10. Буде насиченим чи ненасиченим 33,3-процентний розчин хлориду барію при температурах: а) 65 °С; б) 85 °С?
4-11. У якій кількості води слід розчинити нітрат калію масою 165 г, щоб утворився розчин, насичений при 36 °С?
4-12. При якій температурі розчинність нітрату калію і нітрату свинцю однакова?
4-13. Укаж1ть для кожного з наведених нижче прикладів, який це розчин — насичений чи ненасичений: а) хлорид натрію масою 33 г у 100 г води при 18 °С; б) нітрат калію масою 220 г у 200 г води при 60 °С.
1 
Задача 1
Внаслідок глобального потепління встановлено, що швидкість підвищення рівня океану за рахунок танення льодовиків становить 25 сантиметрів за 100 років. За який час можуть зникнути Шетландські острови(Англія), якщо найвища точка їх 448 метрів над рівнем моря, а інша – 293 метри над рівнем моря?
Цікавий дослід. Хімічний гігрометр
Щоб виготовити хімічний гігрометр, треба мати два розчини. У 200 мл води розчиніть по 1 г хлориду кобальту (II) СоС12-6Н2О, хлориду нікелю МіС12-6Н2О і хлориду натрію (І розчин), а в 20 мл води— 15 г желатини, нагріваючи на водяній бані (II розчин). Змішайте обидва розчини. Коли суміш охолоне, змочіть нею стрічку білої тканини. Стрічку, яка висохла, закріпіть на картоні або папері, надавши їй форму хвилі. На «хвилях» закріпіть паперовий кораблик. Гігрометр готовий.
За зміною кольору «морських хвиль» передбачають погоду: брудно-сірі хвилі вказують на невелику вологість повітря, що віщує суху погоду. Якщо хвилі зелені або синьо-зелені — буде вологе повітря.
Такий самий прилад можна виготовити і у вигляді букета квітів.
Як пояснити зміну кольору хвиль або квітів? Залежно від вологості повітря солі кобальту (і нікелю) містять різну кількість кристалізаційної (зв'язаної) води. Коли вологість повітря велика, кристалізаційна вода не виділяється, коли мала — виділяється.
Залежно від кількості кристалізаційної води хлорид кобальту має різний колір: СоС12 — яскраво-синій, СоС12-НгО — яскраво-синьо-фіолетовий, СОС12 • 2Н2О — темно-синьо-фіолетовий, СоС12-4Н2О — червоний,
СоС12-6Н2О — рожевий. Хлорид нікелю залежно від кількості кристалізаційної води має такі кольори: NiCl2 – золотисто-жовтий, NiCl2 • 2H2O - жовтий, NiCl2 • 4H2O та NiCl2 • 6H2O – зелений.
Гра 5
- Здатність речовин розчинятись у розчинниках називається . . . .
- Група речовин, які у таблиці розчинності позначені буквою М.
- На розчинність речовин впливає . . . .речовини.
- Група речовин, які у таблиці розчинності позначені буквою Р.
- Основний чинник, що прямо пропорційно впливає на розчинність твердих речовин і обернено пропорційно на розчинність газів.
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
6 |
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Група речовин, які у таблиці розчинності позначені буквою Н.
- На розчинність газів дуже впливає фізична величина, що позначається буквою Р.
Відповідь:
- - Розчинність, 2 – Малорозчинні, 3 – Природа, 4 - Розчинні, 5- Температура
6 - Нерозчинні, 7 - Тиск.
Гра 6
Рухаючись за годинниковою стрілкою та пропускаючи весь час однакову кількість складів ви прочитаєте одне з хімічних визначень. Закінчіть речення та назвіть дану властивість речовин.
|
Здат |
ти |
ність |
ся |
ре |
у |
|
це .. |
|
|
|
|
чо |
|
ня |
|
|
|
|
роз |
|
ках |
чи |
ни |
роз |
чин |
вин |
Відповідь: . . .Розчинність.
Заняття 16. Твердість води. (Теоретичне заняття з виконанням лабораторних дослідів)
Мета: Дати учням поняття «тверда і м’яка вода», способи її визначення, усунення та вплив на організми.
План.
1.Вміст розчинених у воді солей.
2. Поняття твердість води.
3. Визначення твердості води, її вимірювання.
4. Усунення твердості води.
5. Життя організмів та твердість води.
Дослід 29. Виявлення розчинних у воді солей.
|1. Перенесіть скляною паличкою (піпеткою з гумовим наконечником або капілярною піпеткою) 1—2 краплі водопровідної чи річкової води на годинникове скельце або скляну пластинку.
Щоб перенести краплі води скляною паличкою, необхідно опустити паличку в розчин, потім швидко вийняти паличку і, тримаючи її похило, перенести краплі в потрібне місце. Для перенесення крапель води піпеткою з гумовим наконечником, необхідно здавити гумовий наконечник і, розтиснувши пальці, набрати рідину в піпетку. Потім, стискуючи наконечник, видавити потрібну кількість крапель розчину. Якщо краплі рідини переносять капілярною піпеткою, необхідно опустити піпетку в воду і щільно закрити її отвір вказівним пальцем правої руки.
Вийняти піпетку з води, доторкнувшись кінчиком до стінки пробірки, щоб злилася вся рідина із зовнішньої поверхні піпетки. Перенести піпетку з водою, не віднімаючи пальця, і лише тоді, злегка послабивши палець, що
закриває верхній отвір піпетки, випустити потрібну кількість крапель.
2. Випарюйте краплі рідини з великою обережність підтримуючи слабке і рівномірне нагрівання всієї поверхні годинникового скельця або скляної пластинки. При сильному нагріванні скло може тріснути. Щоб цього не сталося, тримайте годинникове скельце або скляну пластинку тигельними щипцями на висоті 6—7 см над полум'ям і весь час рухайте ними упоперек полум'я. Що спостерігається?
3. Розгляньте утворені кристали речовин.
Дослід 30. Дослідження солей водопровідної води.
1. На охолоджену пластинку із осадом солей з попереднього досліду капніть 1 – 2 краплі хлоридної кислоти. Відбудеться реакція, що супроводжується виділенням газу. До складу осаду входять солі карбонатної кислоти, які реагуючт з хлоридною кислотою виділяють вуглекислий газ.
Твердість води
Для роботи noтpiбнi: апарат Kiппa (для діоксиду вуглецю), ділильна лійка, бюретка на 100 мл, катіоніт (сульфовугілля, пермутит тощо), мильний розчин (2-проц.), лужна суміш (50% 0,1 н. NaOH i 50% 0,1 н. К 2 СО3), розчини оксалату амонію (насичений), карбонату натрію (2 н.), хлоридної кислоти (0,1 н. титрований).
Дослід 31. Визначення карбонатної твердоеті води
В суху або сполоснуту дистильованою водою колбу Ерленмейера на 200-250 мл налийте піпеткою 100 мл водопровідної води (піпетку сполосніть досліджуваною водою) i додайте кілька крапель розчину метилоранжу до появи жовтуватого забарвлення.
Наповнпъ бюретку титрованим розчином хлоридної кислоти (0,1 н.), причому кінчик бюретки повинен бути заповнений кислотою i не містити пухирців повітря. Після цього в колбочку з досліджуваною водою, додайте з бюретки невеликими порціями кислоту, постійно збовтуючи колбу, поки вода від одної краплини кислоти не змінить свого забарвлення з жовтого на оранжеве.
Запишітъ об'ем витраченої кислоти. Повторіть титрування з новою nopцiєю води. Результати титрування не повинні відрізнятися один від одного більше ніж на +0,05 мл. За одержаними даними обчисліть карбонатну (тимчасову) твердість води.
Дослід 32. Визначення загальної i сталої твердості води
Налийте шпеткою в дві колби Ерленмейера по 100 мл водопровідної води, додайте в кожну з них (піпеткою) по 20 мл лужної cyмiшi (50% 0,1 н. розчину їдкого натрію i 50% 0,1 н. розчину карбонату натрію) i кип'ятіть протягом 3—5 хв. Проільтруйте розчин у дв iншi колби Ерленмейера, промийте осади на фільтрі 2—3 рази дистильованою водою, додавши промивну воду до відповідних розчинів. Після цього долийте в кожну колбу по кілька крапель розчину метилоранжу i протитруйте розчини 0,1 н. хлоридною кислотою. Проробітъ те саме з іншими порціями води. За одержаними даними обчисліть загальну твердість води. Знаючи загальну твердість i карбонатну (за даними попереднього досліду), обчисліть сталу твердість води.
Дослід 33. Відношення твердої i м'якої води до мильного розчину
Налийте в пробірку 5 мл розчину хлориду кальцію (хлориду магнію або їx cyмiшi) i додайте однаковий об'єм розчину карбонату натрію.
Спостерігайте утворення осаду. Нагрійте розчин з осадом до кипіння, дайте розчину охолонути і відстоятись, потім злийте з осаду рідину, промийте його, долийте 10 мл дистильованої води і пропустіть діоксид вуглецю до повного розчинення осаду. Розлийте одержаний розчин порівну у дві
пробірки і вміст одної з них прокип'ятіть протягом 3—5 хв. Що при цьому спостерігається?
Налийте в третю пробірку 5 мл дистильованої води, додайте піпеткою кілька крапель мильного розчину, збовтуючи вміст пробірки після кожної краплі, поки не утвориться стійка піна. Запишіть кількість витрачених крапель мильного розчину. Проробіть те саме з твердою водою в обох пробірках. Порівняйте кількості крапель мильного розчину, витрачених на утворення піни в кожній з трьох пробірок, і зробіть відповідні висновки Напишіть рівняння реакцій.
Дослід 34. Пом'якшення води за допомогою катіоніту
Покладіть на дно сухої бюретки з краном кусочок вати, наповніть її до половини сухим катіонітом (сульфовугіллям, пермутитом тощо) і закріпіть затискачем штатива. Закріпіть над бюреткою ділильну лійку, в яку налийте 100 мл водопровідної води. Підставте під бюретку конічну колбу на 200—250 мл. Відкрийте кран бюретки повністю, а кран ділильної лійки так, щоб вода з неї виливалася краплями. Перші 5—10 мл води, пропущеної через катіоніт, вилийте назад у ділильну лійку, а останні порції зберіть для дослідження. Катіоніт може бути використаний для багатократного пом'якшення води, тому одною порцією його можуть користуватися кілька разів.
Налийте в конічну колбу 100 мл водопровідної води, додайте 20 мл лужної суміші, прокип'ятіть розчин, відфільтруйте осад, а потім відтитруйте надлишок лугу 0,1 н. хлоридною кислотою в присутності метилоранжу .
Проробіть те ж саме з водою, пропущеною через катіоніт. Порівняйте між собою одержані результати і зробіть відповідні висновки.
Для якісного порівняння пом'якшуючої дії катіоніту на воду налийте в одну пробірку 2—3 мл водопровідної води, а в другу — пропущеної через катіоніт і додайте до кожної з них однакові об'єми розчину оксалату амонію. Поспостерігайте за змінами.
Тема 4: Хімічні властивості води
Рекомендована література з теми.
- Б.В. Некрасов. Основы общей химии. М. Химия. 1973 Т.ІІ С. 119, 212, 239 , 504, 511
- Д. Василева . Цікава хімія. К.: Рад. шк. 1980. С. 147 - 148
- О.І.Астахов. Цікаві роботи з хімії. К.: Рад. шк. 1968. С. 37
- М.А.Иванов. Химический демонстрационний експеримент. М. Высшая школа. 1969. С. 16 – 18
- А.Х.Гусаков, А.А. Лазаренко (составители). Учителю химии о внеклассной работе.М. Просвещение 1978. С. 127, 142
- М.А. Прокофьев(редак.) Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 98 - 105
- І.М.Чертков,П.Н.Жуков Хімічний експеримент з малими кількостями реактивів.М. «Просвещение» 1980.С.71, 92 - 93
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 111 – 128, с. 80
- Ф.А. Деркач Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 250 – 251, 270.
Заняття 17 Хімічні властивості води
(Теоретичне заняття)
Мета: розширити знання учнів про хімічні властивості води, показати роль води як каталізатора.
План.
- Взаємодія води з оксидами металів. Вапняна та баритова вода.
- Взаємодія води з оксидами неметалів. Газована вода.
- Взаємодія води з металами.
- Дисоціація води. Поняття константи дисоціації.
- Водневий показник.
Заняття 18 - 19 Хімічні властивості води
(Практичне заняття)
Мета: навчитися виготовляти для наступних досліджень вапняну, баритову води та проводити дослідження з реакційно небезпечними речовинами під тягою, користуватися різними індикаторами та приладом Алямовського для визначення середовища розчинів.
Дослід 35. Виготовлення гашеного вапна і вапняної води
Оксид кальцію перенесіть у фарфорову чашку і додайте невеликими порціями воду, поки вона не перестане вбиратися. Спостерігайте розпушення оксиду кальцію (негашеного вапна) і перетворення його в пухкий порошок гідроксиду кальцію (пушонка). Зверніть увагу на нагрівання реагуючої суміші. Одержаний порошок розмішайте з водою до утворення однорідної тістоподібної маси (гашеного вапна).
Гашене вапно перенесіть у стакан і додайте води з розрахунку 50 мл води на 1 г оксиду кальцію. Старанно розмішайте суміш скляною паличкою до утворення однорідної суспензії гідроксиду кальцію (вапняне молоко). Профільтруйте його (або дайте відстоятись і злийте прозорий розчин з осаду). Розчин гідроксиду кальцію у воді називають вапняною водою.
Дослід 36. Виготовлення баритової води
Відважте 1,5 г оксиду барію і розчиніть його в 50 мл дистильованої води. Розчин (баритова вода) профільтруйте і вилийте в склянку з притертою пробкою.
Дослід 37 Взаємодія води з лужними металами.(Тяга.)
1. Вийміть пінцетом з банки з гасом кусочок літію, покладіть його на фільтрувальний папір на сухій скляній пластинці, обсушіть від гасу фільтрувальним папером (руками не брати!) і зробіть ножем надріз. Зверніть увагу на поступове потемніння блискучої металічної поверхні свіжого надрізу і покриття пухкою плівкою продуктів окиснення.
2. Відріжте кусочок літію величиною з сірникову головку, покладіть його у фарфорову чашку з водою і накрийте скляною пластинкою. Спостерігайте перебіг реакції.
3. Проробіть те ж саме з натрієм і калієм. Який з лужних металів найбільш енергійно взаємодіє з водою? Напишіть рівняння реакцій.
Дослід 38. Визначення реакції середовища розчину
Приготуйте дев'ять чистих пробірок. Розмістіть їх у штативі серіями — по три пробірки в кожній серії. Налийте в кожну пробірку по 1—2 мл дистильованої води. Добавте в усі три пробірки першої серії по 1—2 краплі розчину лакмусу, в пробірки другої серії -V по стільки ж метилоранжу, а в пробірки третьої серії — фенолфталеїну. Після цього в три пробірки (по одній з кожної серії) додайте по 1—2 мл будь-якої розведеної кислоти, а в три інших пробірки (теж по одній, з кожної серії) — по стільки ж будь-якого розведеного розчину лугу.
Останні три пробірки залишіть для порівняння. Відмітьте в журналі колір індикаторів у різних середовищах за такою схемою:
|
Реакція середовища |
Колір індикатора |
||
|
лакмусу |
метилоранжу |
фенолфталеїну
|
|
|
Нейтральна |
|
|
|
|
Кисла |
|
|
|
|
Лужна |
|
|
|
Дослідження реакції середовища розчину за допомогою універсального індикатора.
Обладнання: 3 пробірки або пластин з гніздами, розчини кислоти, лугу і чиста вода, універсальний індикатор.
У кожну пробірку наливаємо 2 – 3 мл досліджуваного розчину і додаємо краплями розчин універсального індикатора. Зміну кольору індикатора і середовище визначаємо за таблицею кольорів.
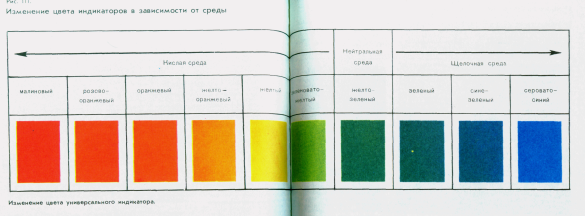
Кисле середовище: малиновий – рожево-оранжевий – оранжевий – жовто-оранжевий – жовтий – зеленувато-жовтий
Нейтральне середовище : жовто-зелений
Лужне середовище: зелений – синьо – зелений – фіолетово - синій
Цікаві досліди
Дослід 39. Вогонь від краплини води.
На металевій пластинці змішують приблизно однакові кількості пероксиду натрію Na2О2 і тирси. Цій суміші надають форму гірки, її вершину притискують пальцем і в ямку пускають з піпетки 1—2 краплі води. Суміш спалахує і згоряє. Спочатку вода реагує з Na2О2 — утворюються гідроксид натрію та безводний пероксоводень:
Na2О2 + 2Н2О = 2КаОН + Н2О2.
Безводний Н2Оа — надзвичайно сильний окисник і підпалює деревину. Потім горіння підтримується за рахунок безпосередньої реакції Na2О2 з деревиною.
Дослід 40. Вогонь від краплини води.
На суху металеву пластинку насипають купкою ретельно перемішану суміш алюмінієвої «пудри» (1 г) та добре розтертого йоду (12 г). На суміш з піпетки пускають кілька крапель води. Через невеликий проміжок часу відбувається бурхлива реакція — суміш згоряє. При цьому зайвина йоду випаровується у вигляді красивої фіалкової хмари (дослід треба проводити під сильною тягою або надворі). Після повного згоряння суміші на металі лишається біла речовина — йодид алюмінію. Вода в цьому процесі є каталізатором:
2А1 + ЗІ2=2А1І3 + Q (цікава х с. 147 – 148)
Дослід 41 Незгораюча хустинка.
Цілу бавовняну хустку (зручно використовувати чоловічу носову хустку) змочують водою, воду злегка віджимають. Хустку демонструють глядачам, а потім кладуть її на металевий піддон і обережно змочують ацетоном або діетиловим (медичним) ефіром. Склянки з ацетоном або ефіром негайно прибирають. Не гаючи часу, сірником або скіпкою підпалюють хустку на піддоні. Тримаючи хустку, що горить, щипцями, показують її тим, що вчаться. Після того, як полум'я згасне (до цього моменту чіпати хустку руками не можна), абсолютно цілу хустку демонструють глядачам.
Дослід оснований на тому, що випаровування води з тканини вимагає великих теплових витрат, а теплоти, що виділяється при горінні рідини, недостатньо для повного випаровування води. Волога тканина не спалахує
Дослід 42 Каталітичний разклад пероксиду водню.
Наливають в пробірку 5 мл розчину пероксиду і декілька крапель насиченого розчину хлориду заліза (III). Реакція розкладання пероксиду водню протікає спочатку поволі, але потім швидшає.
Хлорид заліза (III) є активним каталізатором розкладання пероксиду водню:
2Н2О2 = 2Н 2О + О2
Дослід 43. Яйце – водяна дзига
В дитинстві багатьом з вас, напевне, доводилось гратися різноманітними дзиґами. Дзиги приводилися в рух різними способами: від руки, за допомогою пружинки, їх підганяли батіжком тощо.
Користуючись хімічними реакціями, можна привести в рух дзиґу за допомогою газу. Цікавий вигляд має «хімічна дзига», зроблена з яйия. Звичайно, користуючись наведеним способом, можна зробити хімічну дзигу і з інших матеріалів.
Проколіть яйце товстою голкою з гострих кінців і видуйте його вміст. Коли шкаралупа висохне заповніть її до половини добре перемішаною сумішшю 3 перетертої на порошок виннокам'яної кислоти ( Н 2С 4 Н 6 Об) та питної соди (NаНСО3), взятих у рівній по вазі кількості. Проколи і отвори, через які була внесена суміш, обережно закрийте воском. Опустіть яйце в воду і помітьте з обох боків впоперек яйця, трохи нижче поверхні води дві симетричні точки. Витріть яйце і голкою проколіть у помічених точках невеликі отвори. Якщо тепер яйце опустити в воду, то воно почне обертатися. Вода, яка проникла в суміш через отвори шкаралупи, викликає реакцію:
Н2С4Н4О6 + 2NаНСО3 =Nа2С4Н4О6 + 2Н2О + 2СО2.
Вуглекислий газ, що виділяється під час реакції, виходить через отвір і викликає рух яйця.
Заняття 20 Виділення води під час хімічних реакцій.
(Теоретичне заняття з проведенням демонстраційних дослідів)
Мета: ознайомити учнів з способами добування води під час різних хімічних перетворень.
План
- Добування води реакцією синтезу її з водню та кисню.
- Розклад пероксиду .
- Реакція нейтралізації.
- Розклад нерозчинних основ.
- Розклад їжі в організмі людини і тварин. Дисиміляція вуглеводів.
Тема 5: Органолептичний та хімічний аналіз води
Рекомендована література з теми.
1.Г.Д. Поляков. Пособие по гидрохимии для рыбоводов. М. Пищепромиздат 1950. С. 5 – 84.
2. Н.В. Соболь Піклуємося про нашу річку. Журнал «Біологія» Х. ВГ «Основа» № 22 – 24 серпень 2007 С. 81 – 82
3. С.А. Заданчук. Химический кружок.М. Просвещение. 1964. С. 134 – 141
4. П.И. Воскресенський, А.М.Неймарк. Основи химического анализа. М.Просвещение. 1971. С. 128 – 137.
5. Ф.А. Деркач Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 60 – 61, 170, 175, 180.
6. І.М.Величко. Живі охоронці водойм. К.: Наукова думка. 1987. с. 24 – 25, 42 - 43.
7. Н.М.Чернова, А.М.Былова. Экология.Учеб. пособие для студентов биол. Спец. Пед. Ин-тов. – 2-е узд:, перераб. – М.: Просвещение, 1988. с. 63 – 70
Заняття 21. Органолептичний аналіз води.
(Теоретичне заняття)
Мета: ознайомити учнів з методами аналізу води та ширше розкрити поняття «органолептичний аналіз води», поняттями «польові» та «лабораторні дослідження».
План
1.Правила взяття проб води для аналізу.
2. Поняття про польові та лабораторні дослідження.
3. Органолептичний аналіз води.
4. Фізико – механічні властивості води( прозорість, смак, колір, запах) – способи їх визначення.
Головоломка-кросворд. “Характеристика води річок та озер”
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
@ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Запитання:
- Рух води в річці, озері.
- Властивість води, що залежить від розчинених в ній солей кальцію і магнію.
- Наявність донних відкладень.
- Видимість у товщі води.
- Газ, необхідний для дихання риб.
- Властивість води, що залежить від вмісту розчинених в ній різних речовин, водоростей.
- Фауна води.
- Наявність кухонної солі і інших солей у воді.
- Продукт дихання риб, “їжа” для рослин.
- Водна флора.
- Одна із характеристик води - буває кисла і лужна.
Закодоване слово – іще одна характеристика води.
Відповіді:
1 – течія, 2 – твердість, 3 – замулення, 5 – прозорість, 6 – кисень, 7 – колір,
8 – тварини, 9 – солоність, 10 – вуглекислий газ, 11 – рослини, 12 – реакція води
Закодоване слово – температура.
Заняття 22 - 23. Органолептичний аналіз води.
(Практичне заняття)
Мета: закріпити теоретичні знання учнів з теми та навчити практично виконувати органолептичні дослідження води.
Дослід 43. Визначення прозорості води.
1.Важливе значення в житті прісноводних тварин має освітлення води. Чим більша прозорість, тим глибше проникають сонячні промені. Частково сонячні промені вбираються водою і розсіюються.
2. Прозорість води залежить від вмісту в ній механічних домішок. її визначають за допомогою білого диска діаметром 30 см, (диск Секкі)
У затінку на шпагаті з поділками в сантиметрах диск опускають у воду і стежать, на якій глибині його не буде видно; глибину зникнення диска вважають за величину прозорості води.
3. Існує для цього і спеціальний прилад — пиранометр.
Освітлена сонячним промінням вода сприяє процесам фотосинтезу в зелених водяних рослинах, впливає на розвиток, рух та розміщення прісноводних тварин по вертикалі водойми.
Дослід 44. Визначення кольору води
Забарвлення воді надають речовини, які в ній розчинені або перебувають у колоїдному стані, а також рослинні і тваринні мікроорганізми.
Колір води визначають по шкалі Фореля-Уле, яка складається з 21 пробірки з рідиною, забарвленою в різний колір. Щоб визначити колір води, в неї опускають на певну глибину білий диск, на фоні якого колір води стає помітнішим. Шкалу з пробірками тримають над поверхнею води проти диска і визначають, рідина якої пробірки найбільше відповідає кольору води; номер цієї пробірки записують у щоденник спостережень. Визначають колір води і за калориметром Геніке.
Дослід 45. Визначення температури води
У житті і поширенні прісноводних тварин велике значення має температура води. У різних водоймах температурний режим неоднаковий, що залежить від пори року, глибини водойми, нагрівання сонцем, температури повітря, суші, від швидкості руху води тощо.
Температуру води визначають за допомогою водяного термометра в
дерев'яній оправі, який занурюють у воду за 2—3 м від берега на глибину до одного метра (дна термометр не повинен торкатись) і, протримавши три хвилини, швидко виймають: на шкалі буде зафіксована температура води.
Для більш точних даних вимірюють температуру води на середині, або в кількох місцях водойми (серед заростей, на мілині та на найбільшій глибині) спеціальними термометрами. Звичайними повітряними термометрами можна вимірювати температуру води тільки на поверхні водойми.
Дослід 46. Визначення запаху води

Чиста вода — прозора рідина, без запаху, кольору і смаку. Запах можливий лише при певних хімічних процесах, що відбуваються у воді.
Визначають його досить просто: в пляшку наливають три чверті води, закривають корком і відстоюють воду. Через деякий час пляшку відкривають і на нюх визначають запах.
У лабораторних умовах воду при температурі 15-20° наливають у колбу з широким горлом на 1/3 її об'єму (місткість колби 150—200 мм) і повторюють ті ж процеси, що й з пляшкою.
Запах визначають за таблицею:
А — ароматний П — пліснявий
Б — болотний Р — рибний
Г — гнилистий С — сірководний
Д — деревний Т — трав'янистий
З — земляний Н — незвичайний.
Запахи, утворені речовинами штучного походження, іменуються відповідно до назв речовин: фенольний, камфорний, газовий.
Оцінку інтенсивності запаху проводять під час нагрівання води від 15— 20° до 60°.
Дослід 47. Визначення смаку і присмаку води. (Обережно)
Визначаються як якісно, так і за інтенсивністю. Розрізняють чотири види смаку: солоний, гіркий, солодкий, кислий. Інші види смакових відчуттів називаються присмаками.
Смак і присмак води відкритих водойм (річки, ставка, джерела), сумнівних у санітарному відношенні, визначаються після кип'ятіння й охолодження води. 10-15 мл води набирають у рот, тримають декілька секунд, не ковтаючи. Кількісна характеристика присмаку визначається за відповідними ознаками: хлорний, рибний, металевий та ін. Інтенсивність смаку та присмаку визначають за п'ятибальною шкалою так само, як і запах.
Заняття 24. Біоіндикаційний метод аналізу води
(Теоретичне заняття)
Мета: ознайомити учнів з методами аналізу води та ширше розкрити поняття
«біоіндикаційний» метод аналізу води.
План
- Поняття біоіндикаційний метод аналізу якості води.
- Аналіз води по присутності в ній нижчих організмів.
- Аналіз води по присутності в ній вищих організмів.
- Аналіз води по присутності навколо водних організмів.
Заняття 25 - 26. Біоіндикаційний метод аналізу води
(Практичне заняття)
Тема: «Вивчення стану чистоти водойм з використанням біоіндикаційного методу (наявність раків у водоймах)»
Мета: Виявити, чи є раки в місцевих водоймах та зробити висновок відносно чистоти води у них згідно одного з елементів біоіндикаційного методу.
Об’єкти дослідження: місцеві водойми
Метод дослідження: опитування місцевих рибалок, жителів села.
Останнім часом багато говорять про якість води. Найбільшої уваги заслуговує класифікація стану води з врахуванням не тільки фізико-хімічних, а й біологічних показників. За цими показниками воду класифікують на групи:
- гранично чиста,
- чиста,
- задовільної чистоти,
- забруднена,
- брудна.
Тварини, які живуть у воді, можуть бути індикаторами забрудненості води. Вони є зручним об’єктом досліджень, бо живуть не один рік. На їх популяції можливо прослідкувати зміни якості води в річці. Такими організмами є раки, черви, личинки комах, молюски, тритони.
Методика досліджень.
Присутність раків у водоймах визначали шляхом опитування рибалок- любителів , що ловили рибу на берегах річки, озер та рибалок – професіоналів, що виловлюють рибу у Кременчуцькому водосховищі . По можливості, зловлених раків вимірювали, визначали стать, перевіряли наявність ікри у самок. Дослідження проводилися протягом кількох днів різними групами членів гуртка на різних об’єктах одночасно.
Тема: «Вивчення стану чистоти водойм з використанням біоіндикаційного методу (наявність одноклітинних у водах Кременчуцького водоймища.»
Мета: Виявити, чи є певні організми, зокрема нитчасті водорості, вольвокс, синьозелені водорості, місяцезірник козерогий, евглена зелена в місцевій річці і Кременчуцькому водосховищі та зробити висновок відносно чистоти води у ній згідно одного з елементів біоіндикаційного методу.
Метод: дослідження проб води з різних місцевих водойм за допомогою мікроскопа, виявлення в них одноклітинних організмів.
«Цвітіння води.»
В літню пору багато водойм, особливо з мало проточною водою «зацвітають». Вода в них втрачає свою прозорість і стає зеленою. Дослідження проб такої води під мікроскопом виявляє присутність в ній великої кількості одноклітинних організмів. Найчастіше там зустрічаються синьозелені водорості.
Масовим представником синьозелених водоростей є одноклітинна водорість мікроцистис, що утворює великі безформні скупчення — колонії завдяки слизу. Ці колонії в малопроточній воді ( ставках, водосховищах,) настільки активні, що викликають «цвітіння» води. Під час «цвітіння» маса
водоростей утворює густу зелену пасту. В одному кубометрі води маса водоростей досягає 10—36 кг. На поверхні води утримуються навіть металеві предмети (монети). При надмірному «цвітінні» води вміст кисню падає до нуля. Риба і безхребетні тварини гинуть від замору. Самі водорості також гинуть, бо їм потрібен кисень для дихання, але його запаси вичерпані. Від гниття і розкладу водоростей у воді нагромаджується велика кількість вуглекислого газу та органічних речовин. Деякі з них отруйні.
«Цвітіння» води має локальний характер, і в переважній більшості випадків навіть синьозелені водорості відіграють позитивну роль, збагачуючи воду киснем, споживаючи з неї різні органічні і мінеральні сполуки, тобто сприяють біологічному очищенню води.
 Одноклітинні забрудненої води
Одноклітинні забрудненої води
Показником забруднення води може служити розвиток у ній евглени зеленої. Вона живе в калюжах, у брудних водоймах поблизу тваринницьких ферм. Ця водорість здатна як до фотосинтезу, так і до тваринного способу живлення. Вона активно рухається з допомогою джгутика захоплює одноклітинні водорості, бактерії, інфузорії, а також детрит — мікроскопічні частинки відмерлих організмів, на яких оселились бактерії. Евглена їх ковтає через «горло» і перетравлює в травних вакуолях, що правлять їй за шлунок, з допомогою травних соків. Існує ще третій спосіб живлення евглени — поглинання всією поверхнею тіла розчинених органічних та мінеральних речовин. Таким чином евглена звільняє воду від розчинених та твердих органічних і мінеральних речовин, вуглекислого газу, бактерій, інфузорій, серед яких трапляються також хвороботворні, збагачує водойми киснем. На противагу синьозеленим та діатомовим водоростям евглена відіграє виключно позитивну роль у біологічному очищені водойм.

До вольвоксових належить хламідомонада — одноклітинна водорість з джутиком, яка віддає перевагу забрудненій воді, бо здатна поглинати розчинені в ній органічні речовини.
 Одноклітинні чистої води
Одноклітинні чистої води
 Серед зелених водоростей найбільш екзотичний представник — вольвокс, що інколи викликає «цвітіння» вод. Клітини з джгутиками розміщені на периферії порожнистої кулі, заповненої слизом, що немовби м'яч перекочується у воді . Вольвокс нагадує зелене пшоно, у діаметрі має 2—3 мм. Живе лише в чистій воді, його наявність є вірним показником її чистоти.
Серед зелених водоростей найбільш екзотичний представник — вольвокс, що інколи викликає «цвітіння» вод. Клітини з джгутиками розміщені на периферії порожнистої кулі, заповненої слизом, що немовби м'яч перекочується у воді . Вольвокс нагадує зелене пшоно, у діаметрі має 2—3 мм. Живе лише в чистій воді, його наявність є вірним показником її чистоти.
Нитчасту будову мають деякі зигнемові водорості, такі, як спірогіра з спіральним хроматофором та зигнема — з зірчастим.
Ці нитчасті водорості надзвичайно поширені у водоймах і відіграють велику екологічну роль. Вони будують своє тіло як за рахунок фотосинтезу, так і поглинання органічних речовин. Отже, очищають воду від органічних забруднень і збагачують її киснем.
Заняття 27. Хімічний аналіз води
(Теоретичне заняття з демонстрацією дослідів)
Мета: ознайомити учнів з методами аналізу води та ширше розкрити поняття «хімічний аналіз води», поняттями «польові» та «лабораторні дослідження», «калориметричний» та « метод титрування», розширити поняття «водневий показник» та показати способи його визначення.
План
- Реакція води. Водневий показник.
- Твердість води. Визначення твердості води.
- Хімічний аналіз проб води.
- Поняття про калориметричний метод аналізу та метод титрування.
- Визначенням деяких катіонів та аніонів у воді.
- Визначення вмісту розчиненого у воді кисню.
Заняття 28. Хімічний аналіз води
(Теоретичне заняття - продовження)
Мета: закріпити теоретичні знання учнів з теми та навчити практично виконувати хімічні дослідження води.
План.
- Вміст різних речовин у воді.
- Визначення заліза.
- Визначення нітритів.
- Визначення нітратів.
- Визначення фосфатів.
- Визначення сульфатів.
Заняття 29 - 32. Хімічний аналіз води
( Практичне заняття)
Дослід 48. Визначення заліза.
Залізо може бути присутнє у воді в двох формах: закисній (двовалентний іон Fе") і окисної (тривалентний іон Fе'"). Кисень швидко окислює закисне залізо в окисне; надлишок важкорозчинних сполук тривалентного заліза, що утворюються при цьому, випадає у вигляді характерного бурого осаду. Велика кількість у воді кальцію знижує вміст заліза через утворення погано розчинних карбонатів. Підвищена кислотність, навпаки, сприяє розчиненню заліза і накопиченню його у воді.
В прісних водах, не забруднюваних штучно, залізо міститься, звичайно, в кількості від сотих—десятих часток міліграма до декількох міліграмів на 1 л. У ряді підземних водних джерел і в придонних шарах деяких глибоких озер кількість заліза може досягати десятків міліграмів на 1 л.
Визначення
Визначення заліза засновано на утворенні яскраво забарвленої в червоний колір сполуки Fе (СNS) 3 при взаємодії розчинних роданових солей, наприклад NН4СNS, з тривалентним іоном Феруму:
При слабких концентраціях інтенсивність забарвлення розчину цієї сполуки пропорційна вмісту заліза. Якщо обробити роданистою сіллю досліджувану воду і воду із відомим вмістом заліза (розчин порівняння), а потім порівняти кольори рідин, можна розрахувати, скільки заліза міститься у випробовуваній воді: його в стільки ж разів більше або менше у випробовуваній воді, ніж в розчині порівняння, в скільки колір випробовуваної води яскравіший або слабший за колір розчину порівняння.
Попередня обробка випробовуваної води для окислення закисного заліза дозволяє провести визначення загального змісту заліза; у воді без такої обробки визначається одне окисне залізо, тому що закисне не дає забарвлення з родановими солями. Кількість закисного заліза розраховують по різниці між кількістю загального заліза і окисного.
Кількісне порівняння інтенсивності забарвлення випробовуваної води і розчину порівняння (інакше, — стандартного розчину) проводиться в особливих приладах — колориметрах. Найпростішим і в той же час самим споживаним колориметром є парні циліндри, з незабарвленого скла, з рівним дном, місткістю 100 мл кожний, забезпечені внизу скляними кранами і градуйовані на мілілітри. Діаметр і висота обох циліндрів повинні бути строго однаковими.
В один з циліндрів наливають до мітки забарвлений розчин порівняння (стандартний розчин) з наперед відомою концентрацією шуканої речовини, в іншій — така ж кількість випробовуваної води, обробленої, як і розчин порівняння.
Циліндри підводять над рівною білою поверхнею (фоном) і, дивлячись зверху вниз через весь шар рідини, визначаємо, в якому з них забарвлення більш інтенсивне (більш густе). Відкриваючи скляний кран, зливають інтенсивніше забарвлену рідину до тих пір, поки забарвлення не зрівняється. Помічають висоту шару стандартного розчину і висоту шару випробовуваної води, при яких рідини, що розглядаються зверху, здаються забарвленими однаково. Висота шарів обернено пропорційна інтенсивності забарвлення, а інтенсивність забарвлення прямо пропорційна концентрації забарвленої речовини; на цьому і засновані розрахунки
Хід аналізу.
Окисне залізо. Окисне залізо окремо від загального може бути визначено тільки в свіжо узятій пробі. Закисне залізо, якщо воно є в пробі, швидко окислюється, і результати визначення, проведеного через декілька годин після узяття проби, виявляються перебільшеними.
В один циліндр відміряють 100 мл добре перемішаної випробовуваної води.
В інший циліндр відміряють від 0,10 до 1,00 мл початкових стандартних розчинів (1 мл=0,1 мг Fе), залежно від очікуваного вмісту заліза у випробовуваній воді (частіше за все доводиться брати 0,50 мл стандартні розчини). Потім в цей же циліндр додається дистильована вода до мітки в 100 мл. Результат буде точніше, якщо стандартний розчин розбавити не в циліндрі, а в мірній колбі на 100 мл і лише потім перелити в циліндр. В обидва циліндри додають піпеткою по 2 мл хлоридної кислоти 1 : 1 і по 2 мл розчини роданового амонію. Перемішують рідини.
В циліндрі із стандартним розчином, а у разі наявності заліза — і в циліндрі з випробовуваною водою з'являється рожеве або червоне забарвлення.
Потім, проводять колориметрування, відливаючи з циліндра густіше забарвлену рідину, поки, при розгляді зверху, інтенсивність забарвлення в обох циліндрах не порівняється. Помічають висоту шарів стандарту і випробовуваної води.
Кількість окисного заліза обчислюють за фомулою:
окисне залізо в мг Fе"' на 1 л = hст. х n : hдосл.
де:
hст —висота шару стандарту;
hдосл — висота шару випробовуваної води
п — кількість мілілітрів стандартного розчину заліза (1 мл = 0,1 мг Fе), розбавленого в 100 мл дистильованої води.
Обчислення проводять з точністю до 0,01 мг заліза.
Дослід 49. Визначення нітритів.
Визначення азоту нітриту ( НNО2) краще всього проводити по методу, заснованому на здатності l-нафтиламіносульфанілової кислоти (реактив Грісса) реагувати з нітритною кислотою з утворенням речовини надзвичайної фарбувальної сили.
При малому вмісті нітритного азоту інтенсивність забарвлення рідини, обробленої цим реактивом, пропорційна концентрації нітритної кислоти, кількість якої визначається колориметричним порівнянням із стандартним розчином, обробленим аналогічним способом.
Хід аналізу.
Мірну колбу на 50 або 100 мл наповнюють до мітки випробовуваною водою. В іншій точно такій же колбі готують розчин порівняння, для чого відміряють градуйованою піпеткою від 0,1 до 1 мл розбавленого стандартного розчину натрію нітриту, 1 мл якого містить 0.005 мг N. і доводять об'єм рідини дистильованою водою до 100 мл. Кількість розбавленого стандартного розчину, що йде для приготування розчину порівняння, залежить від передбачуваного вмісту нітриту у випробовуваній воді; частіше за все доводиться брати 0,1—0,2 мл NаNО2 і одержувати розчин порівняння із вмістом нітритного азоту, рівним тисячним часткам міліграма 1 л води.
Третю мірну колбу наповнюють дистильованою водою з тієї ж порції, з якої бралася вода для приготування розчину порівняння. Це робиться для того, щоб мати нагоду обчислювати поправку, залежну від вмісту нітритної кислоти в дистильованій воді. Звичайна дистильована вода майже завжди містить сліди азотної кислоти, звільнитися від якої досить важко. У всі три колби додають по 4 мл (для колб об'ємом 100 мл) або по 2 мл (для колб об'ємом 50 мл) реактиви, перемішують вміст і нагрівають на водяній лазні до 60—70° С протягом 20—30 хвилин.
Вода, що містить азотну кислоту, забарвлюється в рожевий колір. Переливають рідини в циліндри і колориметрують звичайним способом, зливаючи густіше забарвлену рідину до зрівнювання відтінків при розгляді всього шару рідини на білому фоні. З одним і тим же розчином порівняння колориметрують як випробовувану, так і дистильовану воду, до якої доданий реактив.
Дослід 50. Визначення нітратів.
Метод заснований на утворенні інтенсивно забарвленої в жовтий колір сполуки при взаємодії солей нітратної кислоти з сульфофеніловим реактивом (суміш фенолу і сульфатної кислоти) у присутності амоніаку.
Кількість нітратів визначається колориметруванням випробовуваної води, обробленої сульфофеніловим реактивом, і стандартного розчину калій нітрату, обробленого аналогічним способом. Якщо випробовувана вода містить більше 30 мг хлор-іона в 1 л, визначення стає неточним; в цьому випадку треба заздалегідь осадити хлориди, додавши до 1 л випробовуваної води 10 мл 10%-ного розчину аргентум нітрату (АgNО3)
Хід аналізу.
Упарюють насухо у фарфоровій чашці на водяній бані 50 мл випробовуваної води. В іншій фарфоровій чашці упарюють від 0,1 до 1 (найчастіше 0,5 мл) стандартного розчину КNОз, 1 мл якого містить 0,1 мг N. Після охолоджування в обидві чашки додають піпеткою по 1 мл сульфофенілового реактиву і ретельно розтирають в ньому залишок від випарювання скляною паличкою. Через 5—10 хвилин в обидві чашки додають по 15 мл 10%-ного розчину амоніаку. Рідини, що забарвилися в жовтий колір, переливають в парні колориметричні циліндри, додають дистильованої води до мітки 100 мл, розмішують і колориметрують, зливаючи густіше забарвлену рідину до рівняння відтінків при розгляді зверху через весь шар рідини на білому фоні.
Дослід 51. Визначення фосфатів.
Фосфати слід визначати колориметрично по чутливому і нескладному методу, заснованому на здатності станум хлориду у присутності молібденовокислого амонію і фосфатної кислоти давати яскраво забарвлену в синій колір комплексну сполуку стануму з фосфатномолібденовою кислотою.
Хід аналізу.
В мірну колбу на 100 мл наливають до мітки випробовувану воду. В іншій такій же колбі готують розчин порівняння, для чого відмірюють градуйованою піпеткою точно 1 мл розбавленого стандартного розчину (1 мл містить 0;005 мг Р 2О5) і доводять дистильованою водою до об'єму 100 мл. В обидві колби додають піпеткою по 2 мл розчину молібденовокислого амонію і по одній краплі розчину станум хлориду. Перемішують вміст колб, .переливають його в циліндри і зрівнюють інтенсивність забарвлення розчину порівняння і випробовуваної води, зливаючи густіше забарвлену рідину.
Все визначення, починаючи з моменту додавання реактивів і закінчаючи колориметруванням, повинне продовжуватися не більше 10—15 хвилин, оскільки після цього інтенсивність і тон забарвлення починає змінюватися.
Якщо випробовувана вода має власне буре забарвлення визначення стає скрутним; в цьому випадку рекомендується під циліндр з розчином порівняння підкладати папірці, забарвлені в жовтувато-бурий колір певної густини, а під циліндр з випробовуваною водою —чистий білий папір.
Підбирати листи паперу, забарвлені в колір відповідної густини, треба наперед, до додавання реактивів. Для цього наливають в один з циліндрів випробовувану воду, в інший—дистильовану воду і, підкладаючи під циліндр з дистильованою водою різного кольору листи паперу, добиваються того, щоб відтінок обох стовпів рідини при розгляді зверху вниз був однаковим. Таким чином, власне забарвлення води виявляється компенсованим відповідним фоном і зрівняння кольору обох стовпів рідини після додавання реактивів стає зручним і достатньо точним.
Самі реактиви, навіть хімічно чисті, часто містять сліди фосфатів, унаслідок чого в дистильованій воді, яка абсолютно позбавлена фосфатної кислоти, може розвинутися синювате забарвлення після обробки її молібденовокислим амонієм і оловом. Тому треба перевіряти якість реактивів шляхом додавання їх до 100 мл дистильованої води в кількостях, вказаних вище (2 мл молібденовокислого амонію і одну краплю розчину станум хлориду). Якщо при цьому дистильована вода забарвиться в синюватий колір, треба проколориметрувати її з розчином порівняння для внесення відповідної поправки у формулу, по якій обчислюється кількість фосфатів у випробовуваній воді.
Дослід 52. Визначення хлоридів.
Хлориди визначають методом, суть якого зводиться до слідуючого. При титруванні випробовуваної води розчином аргентум нітрату (АgNО3)
хлориди зв'язуються іонами аргентуму і випадають у вигляді білого осаду аргентум хлориду (АgС1)
Коли всі хлориди виявляються витраченими, аргентум нітрат починає реагувати з наперед доданим в рідину хромовокислим калієм (К2СгО4), утворюючи червоно-бурий осад хромовокислого аргентуму (Аg2СгО4). Побуріння рідини і вказує на кінець титрування. Схеми протікаючих при цьому реакцій такі:
NaС1+ АgNО3 =АgС1+Nа NО3;
2 АgNО3 +К2СгО4=Аg2СгО4+2КNО3
Хід аналізу.
Відміряють в колбу або стакан для титрування 100 або, в крайньому випадку, 50 мл випробовуваної води, додають в неї 1 мл 10%-ного розчину хромовокислого калію і титрують рідину з бюретки розчином аргентум нітрату , 1 мл якого зв'язує 1 мл С1. Вже від перших крапель аргентум нітрату в рідині з'являється муть, але оскільки спочатку утворюється білий осад аргентум хлориду (Ат;С1), загальний тон залишається жовтим (жовтий колір рідини надає розчин хромовокислого калію).
Титрування продовжують до тих пір, поки не почне спостерігатися побуріння рідини. Для того, щоб краще уловити початок побуріння і не перетитрувать рідину, поряд з титруючою порцією води ставлять колбу з тією ж кількістю випробовуваної води, в яку доданий 1 мл хромовокислого калію. Цю останню порцію води не титрують; вона служить лише для порівняння.
Якщо хлоридів мало, титруюча рідина починає буріти, ще залишаючись майже прозорою; в цьому випадку ставити поряд воду з хромовокислим калієм для порівняння відтінків рідин особливо корисно.
Дослід 53. Визначення сульфатів.
Найточніший метод кількісного визначення сульфатів—-ваговий. Проте цей ваговий метод занадто громіздкий і складний для виробничих лабораторій і польових досліджень. Пропонований об'ємний метод дає достатньо точні результати для оцінки якості води.
Сульфати осаджують розчином барій хлориду (ВаС12). надлишок якого, у свою чергу, осаджується хромово кислим калієм (К2СгО4). Надлишок хромовокислого калію, що не вступив у реакцію з надлишком барій хлориду, визначається іодометрично, по кількості йоду, що виділяється хромовокислим калієм з. йодиду калію в кислому середовищі.
Схеми протікаючих при цьому реакцій такі:
Na2SO4 + ВаС12 = Ва SO4+2NаС1 осад
ВаС12+ К 2СгО4 =ВаСгО4 + 2КС1
К2СгО4. + 8НС1 + ЗKI == СгС13 + 4Н 2О + 5КС1 + 3I
Кількість йоду, що виділився, визначувана титруванням гіпосульфітом, буде тим більша, чим був більшим надлишок хромовокислого калію.; надлишок хромовокислого калію, у свою чергу, буде тим більший, чим менше пішло його на з’єднання барій хлориду , тобто чим більша частина барій хлориду виявилася витраченою на з’єднання сульфатів, іншими словами. чим більше сульфатів було у випробовуваній воді, Зрештою кількість йоду, що виділився, виявляється пропорційною вмісту сульфатів в пробі.
Хід аналізу.
В колбу або склянку відміряють 100 мл (в крайньому випадку, 50 мл) випробовуваної води і при енергійному струшуванні додають в неї 25 мл розчину барій хлориду (якщо для .аналізу узято 50 мл випробовуваної води, додається 12,5 мл розчину ВаС12).
Через 10 хвилин в колбу додають 25 мл (або 12,5 мл при об’ємі проби, рівному 50 мл) розчину хромовокислого калію. Після перемішування рідини дають їй відстоятися протягом ще 10 хвилин і потім фільтрують її через паперовий фільтр в мірну колбу на 100 мл (або на 50 мл для проби об’ємом 50 мл). Збирають точно 100 мл ( або 50 мл) фільтрату (до мітки колби).
З мірної колби рідину переливають в колбу або стакан для титрування, додають в неї 10 мл (або 5 мл для проби об’ємом 50 мл) 10%-ного розчину йодиду калію і 5 мл (або |3 мл) концентрованої хлоридної кислоти. Закривають колбу пробкою, дають їй постояти 10—15 хвилин, після чого титрують йод, що виділився, 0,01 N розчином гіпосульфіту до світложовтого відтінку.
Коли рідина стане світложовтою, додають в неї 1 мл розчину крохмалю і дотитровують гіпосульфітом до зникнення синього забарвлення від однієї (останньої) краплі реактиву.
В іншу колбу або склянку відміряють такий же об’єм дистильованої води, яким був об’єм проби, тобто 100 або 50 мл. Цю дистильовану воду обробляють точно так, як і випробовувану воду, тобто додають до неї ВаС12, К2СгО4), фільтрують, додають КІ і НС1 і титрують гіпосульфітом.
Заняття 33 – 34. (2год.) Екскурсія до місцевої водойми.
Тема: Польові дослідження води місцевої водойми (річки, озера, ставка чи колодязя).
Мета: практично закріпити вміння учнів проводити дослідження води у польових умовах, вміння визначати фізико - механічний склад води, вимірювати температуру, прозорість, визначати колір і запах.
Не Дніпро вона, не Волга -
Нею ти завжди гордився,
Незрівнянна, неповторна
Та ріка, де ти родився...
Рекомендована література з теми.
1.Г.Д. Поляков. Пособие по гидрохимии для рыбоводов. М. Пищепромиздат 1950. С. 5 – 84.
2. Н.В. Соболь Піклуємося про нашу річку. Журнал «Біологія» Х. ВГ «Основа» № 22 – 24 серпень 2007 С. 81 – 82
3. С.А. Заданчук. Химический кружок.М. Просвещение. 1964. С. 134 – 141
4. П.И. Воскресенський, А.М.Неймарк. Основи химического анализа. М.Просвещение. 1971. С. 128 – 137.
Заняття 35. Захист проекту
«Вода у народній творчості (приказки, прислів’я, пісні, загадки, казки.)»
Підсумок роботи за рік.
Мета: Вчити учнів працювати з додатковою літературою, записувати спогади місцевих жителів, опрацьовувати зібраний матеріал, робити сповіщення перед товаришами.
План
- Захист проектів членами гуртка (групова робота над проектами)
- Виставка робіт членів гуртка.
- Вікторина (Повторна), її аналіз.
- Дидактичні і інтелектуальні ігри.
- Нагородження кращих гуртківців.
Рекомендована література.
- Олекса Воропай. Звичаї нашого народу. АВПТ «Оберіг» 1993. С. 116 – 120, 297- 298, 315 – 327.
- Збірка «Закувала зозуленька». К. Веселка. 1989. С.431 – 548.
Вода
ПРИСЛІВ'Я
- З брудної води іще ніхто чистим не вийшов.
- Куди водиця тече, там травиця росте.
- Не виливай каламутну воду, доки чисту не знайдеш.
- Не спитавши броду, не сунься у воду.
- Прийшло з води, пішло з водою.
- Пролиту воду назад не збереш.
- Кепсько проти води плисти.
- Стояча вода — калюжа.
- Стоячій воді і риба не рада.
- Тиха вода високі береги підмиває.
- Тиха вода рве береги і нищить луги.
- Тиха вода людей топить, а бурхлива — тільки лякає.
- Тиха вода найглибша.
- Щоб спрагу вгасити, треба водиці попити.
- Вода і камінь довбає.
- Не тим крапля камінець довбає, що сильна, а тим, що часто падає.
Приказки, порівняння
- За холодну воду не візьметься.
- Ані в студеній воді не вмиєшся.
- Без води й борщу не звариш.
- Без води і не туди, і не сюди.
- Вода ума не мутить та й голови не смутить.
- Ваша вода мокра, ще й зимна.
- У воді стоїть, а води просить.
- По воді ходить і пити просить.
- Вивели його на чисту воду.
- Від великої води сподІвайся-шкоди.
- Він, як вода, скрізь просочиться.
- Він ані у воді не втоне, ані в огні не згорить.
- Із води сухим вийде.
- У ложці води мене втопив би.
- Він і на холодну воду дме.
- Товче воду в ступі.
- Вода греблю рве.
- Вода в решеті не встоїться.
- В решеті води не наносиш.
- Вода все криє, а береги риє.
- Вода все сполоще, крім лихого слова.
- Вода на мій млин.
- Вода — не нива, ні ореш, ні сієш, а не голий ходиш.
- Води хоч топитись, та нема де напитись.
- Вчорашньої води не доженеш.
- Водою не розлити.
- Всього не переймеш, що водою пливе.
- В глибокій воді велика риба.
- Глибока вода тихо пливе.
- Де вода, там і верба.
- За водою підеш, то й не вернешся.
Гра «Місцеві річки»
Запитання:
- Найбільша ріка України.
- Вона носить дорогоцінні метали.
- Притока Дніпра. Її ім’я схоже з назвою жалкої рослини.
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
д |
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
2 |
|
|
|
|
|
|
|
і |
|
|
|
|
3 |
|
|
|
|
|
|
|
п |
|
|
|
|
4 |
|
|
|
|
|
|
|
р |
|
|
|
|
5 |
|
|
|
|
|
|
|
о |
|
|
|
|
6 |
- Назва річки і села на Золотоніщині однакові. Впадає в річку Золотоношу.
- Притока річки Ірклій. Назва однакова з селом на Чорнобаївщині.
- Ім’я цієї річки складається з назви сема під м. Золотоноша і словом “сухо”.
Відповіді:
- Дніпро 2. Золотоношка 3. Ірклій 4. Кропивня 5.Коврай 6. Сухозгар
Вікторина (Повторна. З першого заняття.)
Мета: Проаналізувати відповіді учнів , отримані на першому занятті і в кінці року навчання у гуртку.
- Яку воду називають «важкою»?
- Яку воду називають «живою»?
- Яку воду називають «мертвою»?
- Яку воду називають «звичайною»?
- Назвіть найбільшу річку світу, України?
- Назвіть річки, що протікають територією нашого району?
- Які речовини додають у воду для її очищення та знезараження?
- Яка кількість води міститься в організмі людини?
Відповіді.
- Це вода в якій нормальний Гідроген заміщений важким Дейтерієм.
- Снігова, тала – в ній міститься менша кількість важкої води.
- Так названо воду яка виникає під час руху корабля при наявності на поверхні морської води шару прісної води. Вона повністю може зупинити корабель.
- Це вода з нормальним атомом Гідрогену у своєму складі.
- Це річка Дніпро.
- Територією нашого району протікає річка Ірклій, Коврай.
- Для очищення води додають речовини – коагулянти, а для знезараження – хлор , озон.
- В організмі людини міститься 67% води
Загадки - ігри.
- По якій дорозі їздять півроку на коні, а півроку – без коня.
- По якій дорозі півроку ходять, а півроку – їздять.
- Сани біжать, а голоблі стоять.
- Один біжить, другий лежить, а третій кланяється.
- Водою їхали пани, на них срібні жупани, хоч жупани – латка на латці, панам раді в кожній хатці.
Вікторина.
- Природний водний потік, що протікає в зниженнях рельєфу, створених її рухом. (річка)
- Територія, з якої річка збирає свої води. (басейн)
- Природна заглибина на суходолі, заповнена водою. (озеро)
- Межа, що відокремлює сусідні річкові басейни. (вододіл)
- Місце, де річка впадає в іншу річку, озеро чи море. (гирло)
- Найвищий рівень води в річці, який щороку в певний час. (максимуми)
- Частина річкової долини, що заливається водою в період повені. (пойма)
- Найнижчий рівень води в річці. (мінімуми)
- Раптові підйоми води викликані дощами чи таненням снігу. (паводок)
- Надмірно зволожена ділянка суходолу з шаром торфу. (болото)
Цікаві завдання
5. Головоломка „Прислів’я”
|
|
|
|
|
Л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У |
|
И |
|
О |
|
Ь |
|
В |
|
У |
|
О |
|
Ч |
|
С |
|
С |
|
Я |
|
У |
|
Д |
|
Відповідь: „Пильнуй чисту воду як свою вроду.”
6. Головоломка „Прислів’я”
Складіть літери, які написані однаковим шрифтом у слова, і ви прочитаєте народне прислів’я.
|
П |
п |
р |
Л |
м |
и |
Л |
о |
ш |
з |
|
а |
в |
Н |
и |
т |
У |
я |
ю |
ь |
Й |
|
к |
н |
о |
В |
г |
л |
О |
т |
а |
д |
|
ф |
Д |
і |
в |
а |
п |
р |
У |
о |
л |
|
й |
ц |
у |
Я |
к |
е |
н |
К |
г |
ш |
|
ч |
м |
С |
и |
т |
ь |
В |
б |
ю |
з |
|
є |
ж |
д |
л |
О |
о |
р |
п |
а |
в |
|
у |
к |
е |
н |
г |
ш |
щ |
Ю |
з |
х |
|
а |
п |
р |
В |
о |
л |
д |
ж |
є |
ї |
|
я |
с |
м |
и |
Р |
т |
ь |
б |
ю |
О |
|
е |
Д |
і |
в |
а |
п |
У |
р |
о |
л |
Відповідь: „Пильнуй воду як свою вроду.”
Прислів’я про воду.
1. У краплині води відбивається Всесвіт. Давнє арабське прислів’я
2. Не брудни криниці, бо схочеш водиці. Українське народне прислів’я
3. Пильнуй чисту воду як свою вроду. Українське народне прислів’я
4. Де вода - там верба. Українське народне прислів’я
Ребус
Відповідь: „Не брудни криниці, бо схочеш водиці.”
7. Головоломка „Прочитай прислів’я”
Знайди ключ і прочитай українське прислів’я.
Н Е Б Р У Д
Н И Р К И Н
И Ц І Б О С
В Ш Е Ч А Х
О Д И Ц І
Відповідь: „Не брудни криниці, бо схочеш водиці.”
Шифрограма „Прочитай прислів’я”
Замінюючи цифру на відповідну літеру українського алфавіту, ви прочитаєте прислів’я.
|
18 |
7 |
|
2 |
21 |
24 |
6 |
18 |
11 |
|
15 |
21 |
11 |
18 |
11 |
28 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
19 |
|
22 |
26 |
19 |
27 |
7 |
29 |
|
4 |
19 |
6 |
11 |
28 |
12 |
|
Відповідь: „Не брудни криниці, бо схочеш водиці.”
Шифрограма „Прочитай прислів’я”
Весь час рухаючись за годинниковою стрілкою і пропускаючи однакову кількість букв, ви прочитаєте українське прислів’я про бережне відношення до води.
|
І |
Р |
О |
. |
Н |
И |
Ч |
Е |
Н |
Е |
Б |
|
Х |
|
|
|
|
|
|
|
|
|
И |
|
К |
|
|
|
|
|
|
|
|
|
Ш |
|
Ц |
|
|
|
|
|
|
|
|
|
Р |
|
С |
|
|
|
|
|
|
|
|
|
Ц |
|
И |
И |
О |
Н |
Д |
Б |
Д |
О |
І |
У |
В |
Відповідь: „Не брудни криниці, бо схочеш водиці.”
Шифрограма „Голосні”
Вставте пропущені голосні літери, і ви прочитаєте народне прислів’я.
|
1 |
П |
|
Л |
Ь |
Н |
|
Й |
|
|
Ч |
|
С |
Т |
|
|
В |
|
Д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К |
|
С |
В |
|
|
|
В |
Р |
|
Д |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Відповідь: „Пильнуй воду як свою вроду.”


Календарний план занять.
|
№пп |
Назва теми, занять |
К – сть годин |
Дата |
Прим. |
|
1 |
Тема: Водні ресурси. Гідросфера. Місцеві водні ресурси. Вступ. |
5 |
|
|
|
|
Заняття 1. Водні ресурси Землі. Гідросфера |
1 |
|
|
|
|
Заняття 2- 3 Екскурсія (2год.) Вивчення водойм своєї місцевості. |
2 |
|
|
|
|
Заняття 4- 5 Екскурсія (2год.) Джерело – потічок – річечка = ріка. |
2 |
|
|
|
2 |
Тема Мінеральна і морська вода. |
2 |
|
|
|
|
Заняття 6. Солона і прісна вода. (Теоретичне заняття) |
1 |
|
|
|
|
Заняття 7. Мінеральні води та їх різноманітність.(Практичне заняття) |
1 |
|
|
|
3 |
Тема: Аналіз води з різних джерел. |
6 |
|
|
|
|
Заняття 8. Взяття проб води для аналізів(Теоретичне заняття). |
1 |
|
|
|
|
Заняття 9. Взяття проб води для аналізів(Практичне заняття). |
1 |
|
|
|
|
Заняття 10 – 11. Аналіз води з водопроводу і колодязів . |
2 |
|
|
|
|
Заняття 12 – 13. Екскурсія в санепідемстанцію. Тема: Контроль за якістю води у місті (районі). |
2 |
|
|
|
4 |
Тема: Забруднення води в природі та внаслідок діяльності людини. |
6 |
|
|
|
|
Заняття 14 – 16. Забруднення води (Теоретичне заняття). |
3 |
|
|
|
|
Заняття 17 – 19. Забруднення води (Практичне заняття). Екскурсія до місцевого сільгосппідприємства , підприємства промислового чи побутового напрямку роботи. |
3 |
|
|
|
5 |
Тема: Очищення води. Очисні споруди підприємств. |
4 |
|
|
|
|
Заняття 20 – 21. Способи очищення забрудненої води. (Теоретичне заняття) |
2 |
|
|
|
|
Заняття 22 – 23. Способи очищення забрудненої води. (Практичне заняття) Екскурсія до місцевого сільгосппідприємства , на очисні об’єкти підприємств промислового чи побутового напрямку роботи. |
2 |
|
|
|
6 |
Тема: Забезпечення населення якісною питною водою. |
5 |
|
|
|
|
Заняття 24 – 25. Водопостачання населення. (Теоретичне заняття) |
2 |
|
|
|
|
Заняття 26- 28. Криниця в житті українців. Екскурсія до різних криниць. ( Дослідницько – практична робота) |
3 |
|
|
|
5 |
Тема 5. Охорона водних багатств. |
5 |
|
|
|
|
Заняття 29 – 31.Охорона водних багатств (Теоретичне заняття). |
3 |
|
|
|
|
Заняття 32 – 33.Охорона водних багатств (Практичне заняття). |
2 |
|
|
|
6 |
Заняття 34 - 35.Захист проекту «Криниця в моєму дворі» або «Річка мого дитинства». Підсумок роботи за рік. |
2 |
|
|


Тема 6: Водні ресурси Землі. Гідросфера.
Рекомендована література з теми:
- Л.А Кульский. Вода, её использование в настоящем и будущем. К. Общ.»Знание» 1977. С. 19 – 45
- М.А. Прокофьев(редак.)Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 121 - 123
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 111
- Ю.В.Новиков. Природа и человек. М.; Просвещение, 1991. – с.163 – 172
- Н.В. Соболь Піклуємося про нашу річку. Журнал «Біологія» Х. ВГ «Основа» № 22 – 24 серпень 2007 С. 81 – 82
- Тарасенко О.Є. Довідник молодого охоронця природи. К.: Молодь, 1997. с. 26 - 27
- Давидов А.І. Піонерське гроно. К.: Молодь, 1997.с. 120
- Н.М.Чернова, А.М.Былова. Экология.Учеб. пособие для студентов биол. Спец. Пед. Ин-тов. – 2-е узд:, перераб. – М.: Просвещение, 1988. с. 63 – 70
- .М.Величко. Живі охоронці водойм. К.: Наукова думка. 1987. с. 78.
Заняття 1. Водні ресурси Землі. Гідросфера
Мета: Узагальнити та розширити знання учнів про забезпеченість людей планети Земля водою, її різноманітність, об’єм, розміщення на планеті. Дати поняття «гідросфера» її склад, розміри.
План
- Людина і світовий океан.
- Запаси води на планеті Земля.
- Різноманітність природних вод, їх об’єм на планеті.
- Водна оболонка Землі – гідросфера.
- Місцеві водні ресурси.
- Характеристика водойм, джерел води.
- Правила опису водойми.
-
Вивчення нових понять.
- Поняття „водойма”,
- Класифікація водойм,
- Природні водойми (моря, річки, озера, болота),
- Штучні водойми (ставки, канали, водосховища).
- Водойми - середовище життя риб.
- Практична робота з картою (відшукування річок за даною назвою, простеження її течії).
Заняття 2 - 3 Екскурсія (2год.) Вивчення водойм своєї місцевості.
- Дніпро і річки його басейну.
- Водосховища на Дніпрі.
- Це цікаво: цифрові дані про Дніпро та його притоки, про водосховища та їх характеристики.
- Інші притоки Дніпра в межах України:
|
Назва річки |
Довжина в км |
З якого берега впадає |
|
Тетерів |
365 |
Правого |
|
Ірпінь |
162 |
Правого |
|
Стугна |
68 |
Правого |
|
Трубіж |
112 |
Лівого |
|
Рось |
350 |
Правого |
|
Супій |
114 |
Лівого |
|
Вільшанка |
105 |
Правого |
|
Золотоноша |
92 |
Лівого |
|
Сула |
415 |
Лівого |
|
Тясмин |
194 |
Правого |
|
Псел |
719 |
Лівого |
|
Ворскла |
455 |
Лівого |
|
Орель |
370 |
Лівого |
|
Самара |
311 |
Лівого |
|
Конка |
246 |
Лівого |
|
Базавлук |
186 |
Правого |
|
Інгулець |
551 |
Правого |
Водосховища на Дніпрі
|
Водосховища |
Площа водяного дзеркала в кв.км |
Об’єм в куб.км |
|
Київське |
922 |
3,75 |
|
Канівське |
582 |
2,48 |
|
Кременчуцьке |
2250 |
13,5 |
|
Дніпродзержинське |
567 |
2,45 |
|
Дніпропетровське |
410 |
3,4 |
|
Каховське |
2155 |
18,2 |
Заняття 4- 5 Екскурсія (2год.)
Джерело – потічок – річечка = ріка.
Цікаві матеріали.
Струмочок
Запитав мене синок:
— Це ж куди біжить струмок?
— Через поле у ярок.
— І зупиниться в ярку?
— Ні, звідтіль — в Десну-ріку.
— А з Десни-ріки куди?
До Дніпрової води.
Попливе з Дніпром у море,
В море синє, неозоре.
В.Гринько [8, C.157]
Основні питання екскурсії.
- Основні частини річки.
- Рух води в річках. Течія.
- Визначення швидкості течії річки.
- Вимір глибини.
- Прозорість води, способи її визначення.
- Схема опису річки.
Опис річки проводять за схемою:
1. Тип і назва водойми, її форма (округла чи видовжена).
2. Характер угідь, які прилягають до водойми (ліс, чагарник, луки, болото, вигін, рілля), їх грунти (піщані, глинисті, суглинисті, кам'янисті, лугово-болотні, гірськоземні).
3. Характер берегів водойми (стрімкі, високі, низькі, похилі, кам'янисті, глинисті, піщані, заболочені). Чи ростуть на берегах трави, чагарники, ліси.
4. З яких грунтів складається дно водойми (пісок, глина, мул, каміння).
5. Розміри водойми (довжина, ширина).
6. Характер водойми (вода проточна чи стояча).
7. Як сполучена водойма з іншими водоймами протягом року. Якщо вода з водойми вибігає - то з якого джерела постачається водою.
8. Чим, коли і як забруднена водойма (мочінням конопель, миттям вовни, відходами цукрових і спиртових заводів, стічними водами промислових підприємств і яких саме).
Глибину водойми вимірюють з човна лотом — приладом для визначення глибини, до якого прикріплюють невелику гирю або камінець і опускають на дно водойми. Як тільки тягар доторкнеться дна, шнур натягують і заміряють глибину. Для визначення середньої глибини водойми необхідно проміряти її декілька разів у різних місцях.
Грунт з дна дістають лотом, гиря або камінець якого змащені жиром, щоб приставав грунт.
Цікаві завдання:
Головоломка: “Річки басейну Дніпра”
Запитання:
- Друга притока Дніпра. Ввібрала в себе 400 рік.
- Найменша (ліва) притока Дніпра довжиною 45 км, без єдиної притоки.
- Права притока Дніпра. Її назва походить від слова “Греція” або гречка.
- Права притока Дніпра, тече з батьківщини Т. Шевченка.
- Права притока Дніпра, що тече у Чигиринськім краї і впадає там, де починається.
- Річка Полтавської області, чиї води поки що найчистіші в Україні.
- Назву цій річці Полтавщини дав Петро І.
- Ця річка є правою притокою Дніпра, колись була південною межею Київської Русі.
- . р . . . . .
- . і . . . . . .
- . . . ч . . . .
- . . . . . . . к .
- . . . . и .
- . У . .
- . . . . к . .
- р . . .
- . . . а . .
10. . . . . . ї . . .
11. . . . н .
12. . . . . . и .
- Ця річка, притока попередньої річки, має з нею однаковий корінь в назві.
10. Притока річки Рось, назва походить від слова “злодійка” і з суфіксом -ївк-.
11. Сестра Дніпра, впадає в нього біля Києва.
12. Ліва притока Дніпра, остання перед впаданням його в Чорне море.
Відповіді: 1 – Припять, 2 – Пікулька, 3 – Гречанка, 4 – Вільшанка,
5 – Тясмин, 6 – Сула, 7 – Ворскла, 8 – Рось, 9 – Росава, 10 – Злодіївка,
11 – Десна, 12 – Рогачик.
Головоломка “Водоймища на Дніпрі”
- . . . . . . Д . . . . . . . . . . .
- . . Н . . . . . .
- . . І . . . . .
- . . . П . . . . . . . . . . . .
- . Р . . . . . . . . . .
- . . . О . . . . .
Запитання:
- Водоймище, утворене після побудови греблі у Дніпропетровській області.
- Водоймище, назване іменем міста Черкаської області.
- “Столичне” водосховище.
- Водоймище, утворилося після побудови Дніпрогесу ( в Запорізькій
області).
- Водоймище на території Полтавської та Черкаської областей.
- Водосховище на території Херсонської області.
Відповіді:
-
- Дніпродзержинське, 2 – Канівське, 3 – Київське, 4 - Дніпропетровське
- – Кременчуцьке, 6 – Каховське
Тема7: Мінеральна і морська вода.
Рекомендована література.
- Б.В. Некрасов. Основы общей химии.М.Химия. 1973 Т.І С. 143, 147, 274, Т.ІІ С. 181
- Д. Василега . Цікава хімія. К.: Рад.шк. 1980. С. 147 - 148
- М.А.Прокофьев(редак.)Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 98 - 105
- І.М.Чертков,П.Н.Жуков Хімічний експеримент з малими кількостями реактивів.М. «Просвещение» 1980.С.71, 92 - 93
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 111 – 128, с. 80
- Ю.А. Лавров. Напитки здоров’я. К. Техника. 1989. С. 52 – 59
Заняття 6. Солона і прісна вода.
(Теоретичне заняття)
Мета: ознайомити учнів з різноманітністю вод за вмістом солей в них, дати поняття «мінеральна», «морська», « прісна» вода, показати використання вод людиною.
- Вміст розчинених у воді солей.
- Поняття морська (солона) вода і прісна.
- Поняття мінеральна вода. Загальні відомості про відкриття мінеральних вод.
- Класифікація мінеральних вод за вмістом солей.
- Використання мінеральних вод людиною. Мінеральні води нашої країни.
- Бальнеологічні курорти України і світу.
Заняття 7. Мінеральні води та їх різноманітність.
(Практичне заняття)
Мета: закріпити теоретичні знання учнів з теми та навчити практично аналізувати , розуміти і використовувати у житті знання про мінеральні води, отримані аналізом написів і повідомлень на етикетках їх тари.
План роботи.
1. Дослідження змісту написів на етикетках мінеральних солей. Склад мінеральної води.
2. Дослідження даних про газованість води. Визначення оксиду карбону(IV) у воді.
3. Дослідження даних про солодкі газовані напої.
Дослід 53. Визначення оксиду карбону(IV) у воді.
Невелику кількість газованої води наливаємо у колбу і закриваємо трубкою з газовідвідною трубкою. Вміст колби злегка підігріємо. Кінець газовідвідної трубки опустимо в посудину з вапняною водою. Після пропускання газу крізь розчин спостерігаємо його помутніння. Це свідчить про те, що з газованої води виділяється вуглекислий газ. Отже, газовані напої насичують вуглекислим газом.
Тема 8: Аналіз води з різних джерел.
Рекомендована література з теми:
1. .Г.Д. Поляков. Пособие по гидрохимии для рыбоводов. М. Пищепромиздат 1950. С. 5 – 84.
2. Н.В. Соболь Піклуємося про нашу річку. Журнал «Біологія» Х. ВГ «Основа» № 22 – 24 серпень 2007 С. 81 – 82
3. С.А. Заданчук. Химический кружок.М. Просвещение. 1964. С. 134 – 141
4. П.И. Воскресенський, А.М.Неймарк. Основи химического анализа. М.Просвещение. 1971. С. 128 – 137.
5. Ф.А. Деркач Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 60 – 61, 170, 175, 180.
6. Методики проведення досліджень дано у заняттях 23 – 32 (перший рік навчання у гуртку)
Заняття 8. Взяття проб води для аналізів
( Теоретичне заняття).
Мета: навчити учнів брати проби води для аналізів з різних водойм, колодязів, водопроводу.
Методика роботи.
Способи узяття і зберігання проб води для аналізів.
1. Проби води треба брати за допомогою спеціальних приладів і пристосувань, інакше дослідження довелося б обмежити тільки самим поверхневим шаром води.
2. Відбирати проби води для хімічного аналізу простим зачерпуванням не можна, оскільки це приводить до перемішування води з повітрям і результати визначення розчинених у воді газів виявляються спотвореними. Краще всього користуватися особливим приладом, званим батометром.
3. Батометр опускають на певну глибину у відкритому вигляді, причому вода проміжних шарів в ньому не затримується. На заданій глибині батометр закривають за допомогою посильного вантажу («листоноші»). Посильний вантаж одягається на трос, на якому підвішений батометр, ковзає по цьому тросу і, ударивши по особливому пристосуванню у верхній частині батометра, закриває його. Таким чином «вирізується» шар води, причому перемішування води з повітрям не відбувається. Для визначення глибини узяття проби трос, на якому опускається батометр, розмічають за допомогою кольорових латочок або ж батометр опускають із стріли, забезпеченої автоматичним лічильником. В нижній своїй частині батометр має відросток з надітою на нього каучуковою трубкою із затискачем. За допомогою цієї трубки і відбувається наповнення склянок, призначених для проб води.
4. Якщо батометра немає, для глибин не понад 2—3 м з склянки, яка призначена для проби на визначення розчиненого в воді кисню або вільної вуглекислоти, виймають скляну притерту пробку і замість неї вставляють каучукову або кіркову пробку, забезпечену двома скляними трубочками. Одна з цих трубочок майже досягає дна склянки і обрізана врівні з верхнім краєм пробки; інша трубочка протягнута на 20—30 см вище за пробку і обрізана врівні з її нижнім краєм .
5. Склянку укріплюють на жердині, розміченій на метри і десятки сантиметрів. До кінця цієї жердини прибитий дерев'яний майданчик, на який і ставлять склянку. До жердини склянку притягають за допомогою гумового кільця, м'якого дроту, ремінця або яким-небудь іншим способом. Жердину з склянкою швидко опускають на задану глибину; вода починає втікати в склянку по трубці, що закінчується у дна, а повітря виходить по трубці, протягнутій вгору. Перемішування води з повітрям не відбувається.
Про наповнення склянки дізнаються по припиненню виділення на поверхню пухирців повітря.
6. Проби на сольовий аналіз (без визначення розчинених газів) можна в крайньому випадку узяти за допомогою завантаженої пляшки, з закритою пробкою; пробка висмикується за вірьовку, прикріплену до неї. Після наповнення пляшку піднімають і знову добре закупорюють, залишивши під пробкою трохи повітря.
7. При роботах взимку склянки з пробами слідує ретельно оберігати від замерзання і ставити їх в спеціальний утеплений ящик в теплих мішечках з ватяною підкладкою, або ж ставить у відро з водою, стежачи за тим, щоб не замерзнула вода в самім відрі.
8. Зберігати проби на визначення розчинених у воді газів не можна. Визначати кисень, вільну вуглекислоту, сірководень і активну реакцію (рН) треба обов'язково не пізніше, ніж через декілька годин після узяття проби. Фіксувати кисень відразу після наповнення склянок (безпосередньо в човні, на дамбі або на березі водоймища). Лише взимку під час морозу можна принести склянки з пробами в приміщення і там фіксувати кисень.
9. Зразу ж після узяття проби необхідно окремо визначити закисне і окисне залізо, оскільки закисне залізо окислюється киснем, розчиненим у воді. В день узяття або, в крайньому випадку, наступного дня необхідно провести і наступні визначення: фізичні властивості
10. Визначати лужність, жорсткість, загальний вміст заліза, сульфатів і хлоридів можна не відразу, оскільки вміст цих речовин трохи міняється з часом.
11. Якщо початок аналізу затримується, то проби необхідно берегти при низькій температурі, близькій до 0. Це уповільнює процеси окислення і мінералізації, але не припиняє їх. Відкладати аналіз більш, ніж на дві-три доби, не можна і в цьому випадку.
Реєстрація результатів аналізу
1. При роботі в полі завжди слід мати з собою польову книжку, в якій реєструють номер станції, місце і глибину, дату і годину узяття проби, температуру і прозорість води, номери склянок з пробами на визначення кисню, вільної вуглекислоти і сірководню, номери склянок, з пробами на загальний аналіз.
Записи оформляють у вигляді таблиці( сторінка польової книги):
|
№ п.п |
Водой- ма
|
місце |
Глиби- на |
дата |
Час взяття проби |
Темпе- ратура води |
Прозо- рість |
Номер склянки |
При- мітка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. В цій же книжці відзначають найважливіші метеорологічні дані у момент узяття проби.
3. Всі записи в польовій книзі слід вести простим олівцем.
4. Відразу після повернення в лабораторію необхідно привести польові записи в повний порядок, звірити номери склянок, дописати упущене, виправити помилки.
5. Результати лабораторної роботи записують в лабораторний журнал. В цьому журналі відзначають дату, місце узяття і номер проби (номер склянки), дату проведення аналізу, кількість реактивів, що пішли на титрування узятого для аналізу об'єму води або інші проміжні дані, наприклад, висоту стовпів проби і стандарту в циліндрах (при колориметруванні). Тут же записують результати установки титру початкових реактивів і результати обчислень кількості шуканих речовин.
Заняття 9. Взяття проб води для аналізів
(Практичне заняття).
Мета: закріпити теоретичні знання учнів брати проби води для аналізів з різних водойм, колодязів, водопроводу на практиці. Взяти проби води для наступних аналізів у лабораторії.
Заняття 10 – 11. Аналіз води з водопроводу і колодязів .
Робота проводиться групами учнів (2-3 особи) згідно методик визначення фізико – механічних характеристик води , органолептичного та хімічного аналізів води.
У шкільній лабораторії вимірюються і визначаються за допомогою дослідів такі характеристики проб води:
- Температура води
- Прозорість
- Колір
- Запах
- Смак (з дотриманням правил безпеки)
- Лужність (реакція води)
- Твердість
- Вміст органічних речовин у воді
- Вміст солей у воді (загальний)
- Вміст заліза
- Сульфати
- Хлориди
А) Методику визначення механічних характеристик води та органолептичний аналіз виконують згідно методик робіт із заняття № 22 – 23 першого року навчання.
Результати аналізу заносять у таблицю (І і ІІ частини):
І частина
|
Проба води, її № |
Тем- пера- тура |
Про- зорі- сть |
Колір |
Запах |
Смак |
||
|
Характер |
Бали (інтен- сивність) |
Характер |
Бали (інтен- сивність) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ІІ частина
|
Проба води, її № |
Луж ність |
Твер- ді- сть |
Вміст орг. речо вин |
Вміст солей |
Наявність іонів
|
||
|
|
заліза
|
сульфатів |
хлоридів
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дослідження природної води в умовах шкільної лабораторії хімії
а) Визначення загальної кількості солей у воді
При виконанні роботи корисно узяти для дослідження зразки води з різних джерел і в різні пори року.
Обладнання і матеріали. Терези з наважками, фарфорова чашка, мензурка на 500 мл, електрична плитка, водяна баня, сушильна шафа, досліджувана вода
Хід роботи.
Зважують фарфорову чашку, відмірюють 50 мл досліджуваної води і виливають у зважену чашку.
Дві третини рідини випаровують на полум'ї спиртівки або на електричній плитці. Закінчують випарювання на водяній бані, щоб уникнути втрат. Чашку з залишком поміщають в сушильну шафу до отримання постійної ваги при температурі 102°С. Зважують чашку з осадом і визначають кількість грамів солей, що містяться в 50 мл води. Обчислюють процентний вміст солей в досліджуваній воді.
б) Якісне визначення найголовніших домішок води
Обладнання і матеріали. Штатив з пробірками, спиртівка, досліджувана вода, червоний і синій лакмусовий папір, 0,5-процентний розчин калій перманганату, 2-процентний розчин аргентум нітрату, 5— 10-процентний розчин барій хлориду, концентрована нітратна кислота, 5-процентний розчин амоній роданіду.
Визначення реакції води. В стакан з досліджуваною водою опускають червоний і синій лакмусові папірці. Кип'ятять воду в пробірці і знову опускають синій лакмусовий папірець. Відсутність почервоніння указує на наявність у воді вуглекислого газу, а посиніння червоного папірця, зникаюче після кип'ятіння, — на присутність амоніаку.
Визначення органічних речовин. Беруть дві пробірки: в одну наливають 5—6 мл дистильованої води, в іншу — стільки ж випробовуваної води. В кожну пробірку додають по краплі 0,5-процентного розчину перманганату калію. Зникнення малинового забарвлення говорить про присутність органічних речовин.
По числу крапель розчину перманганату калію визначається кількість домішок органічних речовин.
Випробування на іон С1-. На випробовувану воду діють декількома краплями розчину аргентум нітрату. Наявність хлоридів виявляється по помутнінню розчину.
Випробування на іон SО4 --. На випробовувану воду діють розчином барію хлориду. Утворення муті, нерозчинної в нітратній кислоті, — показник наявності сульфатів.
Випробування на солі заліза. До 3—4 мл випробовуваної води додати 2 мл концентрованої нітратної кислоти і кип'ятити 2—3 хв. для окислення іона Fе++ в іон Fе+++.
Після кип'ятіння додають 3—4 краплі розчину амоній роданіду. Розчин забарвлюється в червоний колір.
в) Визначення твердості води. Виконуючи роботу, учні знайомляться з одним з методів визначення твердості води і розвивають навички по приготуванню розчинів, вимірюванню, відліку крапель і т.д.
Найпростіший і швидкий спосіб визначення твердості води, правда, не зовсім точний, — збовтування досліджуваної води з розчином мила відомої концентрації до утворення незникаючої протягом 5 хв. піни. Звичайне натрієве мило реагує з солями, що містяться у воді, утворюючи нерозчинний кальцій стеарат. Коли всі солі кальцію, що знаходяться у воді, перетворяться на кальцій стеарат, вийде мильний розчин, що дає при збовтуванні піну. Чим більше твердість води, тим більше піде мильного розчину, що підливається з піпетки окремими краплями. Кожні 5 крапель мильного розчину відповідають одному градусу твердості. Твердістю води прийнято називати вміст в ній розчинних солей кальцію і магнію, виражений в міліграм-еквівалентах на 1 л води.
1 мг-екв твердості відповідає вмісту в 1 л 20,04 мг Са++ або 12,16 мг Мg++. Для перерахунку міліграмів-еквівалентів в 1 г на градуси і назад можна скористатися наступним співвідношенням: 1 мг-екв в 1 л дорівнює 2,8°, прийнятий у нас раніше (1° твердості рівний 0,366 мг-екв). Разом з поняттям міліграм-еквівалента можна рекомендувати користуватися в школі при визначенні твердості води поняттям градуса, показавши тим, що вчиться перерахунок градусів на нові одиниці вимірювання твердості міліграм-еквіваленти в 1 л.
Нагадаємо, що м'яка вода має твердість до 10°. Помірно тверда вода — до 20°, тверда вода — від 20 до 30°. Дуже тверда вода — більше 30°. Вода, що стикається з вапняними гірськими породами, може мати твердість навіть до 80°.
Примітка. Для роботи необхідне ядрове 60-процентне сухе господарське мило.
Мильний розчин готується при слабкому нагріванні (не кип'ятити). Бажано щоб уникнути (або зменшення) погрішності одночасно вести паралельний дослід (контрольний) і результатом вважати середньоарифметичну величину двох визначень. Це наближає шкільний екслеримент до наукового дослідження і привчає учнів до контролю за своєю роботою.
Необхідно провести дослідження різних зразків води, а потім скласти діаграму твердості різних вод місцевості або району.
Обладнання і матеріали: Терези з наважками, піпетки, мірний циліндр на 100 мл, колба широкогорла на І00 мл з пробкою і піпеткою, 4 колби конічних на 250 мл, господарче мило 60-процентне, зразки різних вод.
Хід роботи.
Подрібнюють і відважують на аптекарських терезах 5 г господарського мила. Наважку мила переносять в колбу на 100 мл. Розраховують кількість мілілітрів води, необхідну для приготування 10-процентного розчину мила.
Відмірюють мірним циліндром необхідну кількість дистильованої води і наливають в колбу.
Розчиняють при нагріванні все мило. Мірним циліндром відмірюють 100 мл дистильованої води і виливають в колбу на 250 мл.
Додають з піпетки, рахуючи краплі, мильний розчин до утворення піни, не зникаючої протягом 5 хв. Колбу весь час струшують. Мірним циліндром відмірюють 100 мл досліджуваної води, виливають її в колбу на 250 мл. Додають в колбу спочатку те число крапель мильного розчину, яке пішло на утворення піни в дистильованій воді. Потім вливають мильний розчин по краплях до появи піни, не зникаючої протягом 5 хв. Краплі рахують, а колбу при цьому треба весь час струшувати.
Визначають твердість досліджуваної води, знаючи, що 5 крапель мильного розчину відповідають приблизно одному градусу твердості. Для цього потрібно із загального числа крапель мильного розчину, що пішов на утворення піни в досліджуваній воді, відняти число крапель мильного розчину, що пішов на утворення піни в дистильованій воді. Розділивши одержаний результат на 5, одержують твердість води в градусах.
Складають звіт про виконану роботу у вигляді таблиці 1:
|
Найменування досліджуваної води
|
відсоток вмісту солей у воді
|
реакція води
|
Органічні речови- ни |
Хлориди |
Сульфати |
Солі заліза |
Жорсткість води
|
||||||||
|
багато |
мало |
ні |
багато |
мало |
ні |
багато |
мало |
ні |
є |
ні |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Заняття 12 – 13. Екскурсія в санепідемстанцію.
Тема: Контроль за якістю води у місті (районі).
Мета: Ознайомитися з обладнанням лабораторій санепідемстанції, проведенням аналізів води з різних джерел, ознайомитися з професіями лаборанта, бактеріолога.
Тема 9: Забруднення води в природі та внаслідок діяльності людини.
Рекомендована література:
-
Ю.В.Новиков. Природа и человек. М.; Просвещение, 1991. –
- с.149– 160
- І.М.Величко. Живі охоронці водойм. К.: Наукова думка. 1987. с. 8 - 18.
- Скиннер Б. Хватит ли человечеству земних ресурсов? Пер. С англ..-М.; Мир, 1989, - С. 230 – 242.
- Н.М.Чернова, А.М.Былова. Экология.Учеб. пособие для студентов биол. Спец. Пед. Ин-тов. – 2-е узд:, перераб. – М.: Просвещение, 1988. – 42 – 53 63 – 70
Заняття 14 – 16. Забруднення води.
(Теоретичне заняття)
Мета: Ознайомитися з використанням води в різних галузях господарства . Вивчити забрудненість використовуваної води, можливий склад відпрацьованої води, шляхи потрапляння забрудненої води у водойми.
План.
- Всі шляхи ведуть до водойм.
- Наслідки використання мінеральних добрив те пестицидів у сільському господарстві.
- Стічні води промислових підприємств.
- Забруднення вод – природне, мікробіологічне, хімічне, фізичне.
- Детергенти у водному середовищі.
- Нафта і нафтопродукти у водоймах.
Заняття 17 – 19. Забруднення води (Практичне заняття).
Екскурсія до місцевого сільгосппідприємства , підприємства промислового чи побутового напрямку роботи.
Мета: Ознайомитися з використанням води в даній галузі господарства та на даному підприємстві зокрема. Вивчити забрудненість використовуваної води, можливий склад відпрацьованої води, шляхи потрапляння забрудненої води у водойми.
Рекомендовані об’єкти: склад мінеральних добрив і отрутохімікатів у сільгосппідприємстві, станції миття машин та вагонів, підприємства легкої та харчової промисловості, промислові підприємства, банно - пральні комбінати, переробні підприємства різної продукції, обладнані сміттєзвалища.
Тема10: Очищення води. Очисні споруди підприємств.
Рекомендована література:
-
Ю.В.Новиков. Природа и человек. М.; Просвещение, 1991. –
- с.149 – 160
- І.М.Величко. Живі охоронці водойм. К.: Наукова думка. 1987. с. 62 - 65.
- Н.М.Чернова, А.М.Былова. Экология.Учеб. пособие для студентов биол. Спец. Пед. Ин-тов. – 2-е узд:, перераб. – М.: Просвещение, 1988. с.63 – 70
- Л.А Кульский. Вода, её использование в настоящем и будущем. К. Общ.»Знание» 1977. С. 42 – 46
Заняття 20 – 21. Способи очищення забрудненої води. (Теоретичне заняття)
Мета: Ознайомитися з очищенням відпрацьованої води в господарствах. Вивчити способи очищення відпрацьованих вод,
План.
- Контроль за рівнем забрудненості води.
- Способи очистки стічних вод: механічні і біологічні.
- Очисні споруди підприємств.
- Безстічні виробництва.
- Безвідходні виробництва.
Заняття 22 – 23. Способи очищення забрудненої води. (Практичне заняття)
Екскурсія до місцевого сільгосппідприємства , на очисні об’єкти підприємств промислового чи побутового напрямку роботи.
Мета: Ознайомитися з очищенням відпрацьованої води в даній галузі господарства та на даному підприємстві зокрема. Вивчити способи очищення відпрацьованих вод,
Рекомендовані об’єкти: , станції миття машин та вагонів, підприємства легкої та харчової промисловості, промислові підприємства, банно - пральні комбінати, міські чи селищні очисні споруди комунальних господарств.
Тема11: Забезпечення населення питною водою.
Рекомендована література з теми.
- В.А. Крицман (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 122 – 126,
- М.А.Прокофьев(редак.)Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 98 - 105
- Л.А Кульский. Вода, её использование в настоящем и будущем. К. Общ.»Знание» 1977. С. 19 - 45
- Г.С.Юзбашева. Навчальні комплексні екскурсії з хімії. Х. ВГ «Основа» 2003 С.10 – 18
Заняття 24 – 25. Водопостачання населення.
(Теоретичне заняття)
Мета: Ознайомитися з водопостачанням населення питною водою, з підготовкою і очищенням води.
План.
- Забезпечення водою населення в різні епохи історичного розвитку людства.
- Криниця – джерело життя. Артезіанські колодязі.
- Водопроводи, їх призначення і схематична будова.
- Водозабірні та водоочисні станції.
- Схема міського чи сільського водопроводу. По можливості – екскурсія.
- Віртуальна екскурсія до музею води в м. Києві.
Екскурсія до міського (сільського) водопроводу.
Мета: Ознайомитися з водопостачанням місцевого населення питною водою, з підготовкою і очищенням води. По можливості, ознайомлення з наявністю, будовою та оформленням колодязів індивідуального (чи колективного) користування .
Заняття 26 - 38. Криниця в житті українців.
( Дослідницько – практична робота)
Мета: Дослідити історичне походження назви свого населеного пункту, назви річки чи інших місцевих водойм, поява першої криниці, мережа криниць у населеному пункті колись і тепер. Виконати підбірку творів народної творчості, літератури чи мистецтва із теми заняття ( криниця).
Тема12: Охорона водних багатств.
Рекомендована література з теми.
1. Величко І.М.. Живі охоронці водойм. К.: Наукова думка. 1987. С. 43.
2. Кульский Л.А.. Вода, её использование в настоящем и будущем. К. Общ.»Знание» 1977. С. 45
3. Новиков Ю.В.. Природа и человек. М.; Просвещение, 1991. – С. 222
4. Тарасенко О.Є. Довідник молодого охоронця природи. К.: Молодь, 1997. С. 118
Заняття 29 – 30.Охорона водних багатств
(Теоретичне заняття з елементами практичних робіт).
Мета: Ознайомитися із державними заповідниками, заказниками по охороні водного середовища, рослинного і тваринного світу водойм.
План.
- Закон України про охорону водних багатств.
- Контроль за чистотою водойм.
- Участь «Голубих патрулів» у охороні водойм.
- Коротко з історії охорони водойм.
- Міжнародні організації по захисту водного середовища.
- Охорона води у моєму регіоні.
Заняття 31. Охорона водних багатств
(Практичне заняття).
Мета: Ознайомитися із державними заповідниками, заказниками по охороні водного середовища, рослинного і тваринного світу водойм.
Нанесення на контурну карту охоронних територій. Місцеві території, що охороняються , нанесення їх на схематичну карту регіону. Ознайомитися з роботою учнівських природоохоронних організацій, зокрема «Голубих патрулів».
Заняття 32 -33. Охорона водних багатств
(Практичне заняття).
Мета: Ознайомитися із можливими джерелами забруднення місцевої водойми. Допомога дорослим у охороні водних багатств – упорядкування джерел, колодязів, очищення берегів річок чи інших водойм від сміття, насаджування рослин у прибережній смузі, проведення рейдів контролю за чистотою водойм, ведення роз’яснювальної роботи серед учнів з даного питання, підготовка виступу агітбригади.
Заняття 34 -35. Захист проекту
« Криниця в моєму дворі» або «Річка мого дитинства».
Підсумок роботи за рік.
Мета: Вчити учнів працювати з додатковою літературою, записувати спогади місцевих жителів, опрацьовувати зібраний матеріал, робити сповіщення перед товаришами.
План
- Захист проектів членами гуртка (групова робота над проектами)
- Виставка робіт членів гуртка.
- Гра «Вода, вода, кругом вода…» Дидактичні і інтелектуальні ігри.
- Нагородження кращих гуртківців.
Вікторина
- Коли б ми помітили всі молекули води, які є в склянці (200 мл), і перемішали цю воду з усією водою земної кулі, а потім набрали де завгодно склянку води, то в ній було б близько 1000 мічених молекул. Як перевірити це твердження?
- Скільки різновидів води за складом можна передбачити?
- Яку речовину називали колись «окисленою водою»?
- Чому є хлорна вода, бромна вода, йодна вода, а фторної води немає?
- Які коштовні прекраси не рекомендується довго зберігати , не одягаючи їх?
- Який метал скорочував життя мешканцям стародавнього Риму?
- Яка вода буває «твердою» за кімнатної температури?
- Чи багато води у водяному газі?
- Чому персидський цар Кір, який жив більше двох тисяч років тому, під час походів пив воду із срібної посудини?
- В якій воді розчиняється золото?
- Що таке надважка вода?
- Чи може горіти вода?
- Який тиск міг би виникнути, якщо піддати воду електролізу в герметично закритій посудині, повністю заповненій водою? Вважайте, що відхилень від закону Бойля — Маріотта при цьому не буде.
Відповіді:
2. Якщо враховувати різні ізотопи Гідрогену і Оксисену, то можна передбачити принаймні 12 різновидів води. Найпоширеніша вода з легкого Гідрогену і Оксисену 11 Н2168О. Відома важка і надважка вода D2O і T2O.
3. Пероксид Гідрогену Н2О2. Така назва спрощено передає склад і властивості цієї сполуки.
4. Тому, що фтор надзвичайно енергійно реагує з водою.
5. Перли. При довгому зберіганні відбувається виділення води, яка знаходиться у перлах, тому вони висихають і розсипаються. Дотикання до шкіри людини та знаходження на вологому повітрі підтримує в них певну кількість вологи.
6. Свинець. З нього робили труби для подачі води. Під впливом води та розчинених у ній газів свинець переходив у розчин, потрапляв у організм людини і поступово отруював його.
7. Вода, яка містить багато розчинених солей магнію і кальцію (часом і заліза). За їх вмістом визначають твердість природної води.
8. У водяному газі немає води. Це — переважно суміш оксиду вуглецю (II) і водню.
9. Іони срібла мають бактерицидну дію. Тепер «срібну воду» використовують у медицині. Учені визначили, що 0,5 г срібла за півгодини знищує всі шкідливі бактерії в літрі води.
10. Золото розчиняється в хлорній воді. Це знав ще М. В. Ломоносов.
11. Оксид тритію 31 Н 2О, або Т2О. На Землі у вільному стані важкої води лише кілька кілограмів.
12. Може. Нагріта вода горить у струмені фтору голубим полум'ям, оскільки відбувається енергійне окислення кисню за рівнянням:
2Н2О + 2F2 = О2 + 4НF.
13. За законом Бойля— Маріотта: \/0Р0 =\/ 1Р1, де \/0 — об'єм, який зайняли водень і кисень, добуті з 1 моля води. За н. у. ця величина дорівнює 33 600 мл. Об'єм моля води — 18 мл. Отже, 33 600=18х; х=1867 ат.
Цікаві ігри та завдання
Кросворд „Очистіть воду”
Розгадайте кросворд, а допомогою вам стануть перші літери слів-відгадок.
- Обеззараження води з участю озону.
- Пропускання води через пісок.
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
х |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
а |
|
|
|
|
|
|
|
6 |
в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Осадження часток речовин коагулянтами.
- Очищення води з додаванням газоподібного хлору.
- Насичення води киснем.
- Простий метод очистки води від завислих частинок.
7. Вбивання мікробів в воді дією високої температури
Відповіді:
- Озонування. 2. Фільтрація. 3. Коагуляція. 4. Хлорування. 5. Аерація.
6.Відстоювання. 7. Кип’ятіння.
Кросворд „Очисти воду” (обернений)
Дай коментарі до термінів, які використані в кросворді.
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
З |
|
|
|
|
|
|
Ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
К |
О |
А |
Г |
У |
Л |
Я |
Ц |
І |
Я |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
Л |
|
|
|
|
|
|
|
|
|
|
4 |
Х |
Л |
О |
Р |
У |
В |
А |
Н |
Н |
Я |
|
Ь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
Т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
5 |
А |
Е |
Р |
А |
Ц |
І |
Я |
|
6 |
В |
І |
Д |
С |
Т |
О |
Ю |
В |
А |
Н |
Н |
Я |
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
Ц |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Я |
7 |
К |
И |
П |
Я |
Т |
І |
Н |
Н |
Я |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Я |
|
|
|
|
Відповіді:
- Обеззараження води з участю озону.
- Пропускання води через пісок.
- Осадження часток речовин коагулянтами.
- Очищення води з додаванням газоподібного хлору.
- Насичення води киснем.
- Простий метод очистки води від завислих частинок.
- Вбивання мікробів в воді дією високої температури.
Головоломка „Методи очистки стічної води”
З крана краплям капає вода. На деяких краплях видно букву з кількома клітинками. Впишіть у них решту букв, щоб утворилось слово, що означає спосіб очистки стічних вод.

- Розділення за допомогою відстійників.
- Нейтралізація за допомогою хімічних реактивів.
- Природні і штучні методи очистки з використанням мікроскопічних рослин і тварин.
Відповіді:
- Механічний.
- Хімічний.
- Біологічний.
Головоломка „Водопровідна вода”
З колби краплям капає вода. На деяких краплях видно букву з кількома клітинками. Впишіть у них решту букв, щоб утворилось слово, що означає спосіб очистки водопровідних вод.
- Розбризкування води за допомогою фонтанів.
- Додавання газоподібного хлору для обеззараження води.
- Спосіб видалення води завислих частинок.
- Обеззараження з допомогою озону.
Відповіді:1 – аерація, 2 – хлорування, 3 – фільтрація, 4 - озонування
Кросворд „Побутові водоочисники”
У клітинки впишіть назви побутових водоочисників, що мають спільне закінчення І.
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
І |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
І |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
І |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
І |
- У цих очисниках використовують активоване вугілля.
- У цих очисниках вода пропускається через мембрани.
- У цих очисниках вода пропускається через шар іонообмінних смол.
- У цих очисниках у воду пропускають електричний струм.
Відповіді: 1.Вугільні. 2.Мембранні. 3.Іонообмінні. 4.Електрохімічні
Кросворд „Джерела забруднень гідросфери” (А)
Дай коментарі до слів, які використані в кросворді.
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
с |
|
|
|
|
|
|
|
|
|
|
|
|
|
р |
|
|
|
7 |
|
|
|
1 |
т |
а |
л |
і |
|
|
|
|
|
|
|
|
2 |
п |
о |
б |
у |
т |
о |
в |
і |
|
|
і |
|
|
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
п |
|
|
|
|
ч |
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
3 |
р |
е |
а |
к |
ц |
і |
й |
н |
і |
|
|
|
|
|
|
|
|
|
|
|
|
в |
|
|
|
д |
|
|
|
|
і |
|
|
|
|
4 |
о |
х |
о |
л |
о |
д |
ж |
е |
н |
і |
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
і |
|
|
|
|
|
|
|
|
|
|
|
|
Відповіді:
- Весняні води з снігу, льоду.
- Стічні води їдалень, будинків, бань.
- Води, що утворюються в процесі реакцій.
- Води, що використовуються в системах охолоджень.
- Води, що утворюються після миття сировини, тари.
- Води, що стікають з вулиць, майданчиків різних виробництв.
- Загальна назва дощу, граду, снігу.
Кросворд „Джерела забруднень гідросфери” (Б)
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Весняні води з снігу, льоду.
- Стічні води їдалень, будинків, бань.
- Води, що утворюються в процесі реакцій.
- Води, що використовуються в системах охолоджень.
- Води, що утворюються після миття сировини, тари.
- Води, що стікають з вулиць, майданчиків різних виробництв.
- Загальна назва дощу, граду, снігу.
Відповіді:
1 - Талі. 2 - Побутові. 3 - Реакційні. 4 - Охолоджені. 5 - Промивні.
6 - Стічні. 7 - Опади.
Кросворд „Води - забруднювачі”
- Води, що утворюються після миття сировини, тари.
- Стічні води їдалень, будинків, бань.
- Води, що використовуються в системах охолоджень.
- Води, що утворюються в процесі реакцій.
- Води, що стікають з вулиць, майданчиків різних виробництв.
- Весняні води з снігу, льоду.
Відповіді:
-
Промивні. 2 - Побутові. 3 - Охолоджені. 4 - Реакційні. 5 - Стічні.
- - Талі.
Використані джерела
1. Астахов О.І. Цікаві роботи з хімії. К.: Рад. Шк..1980. С. 75
2. Василега Д. . Цікава хімія. К.: Рад. шк. 1980. С. 147 - 148
3. Воскресенський П.І., Неймарк А.М. Основи хімічного аналізу. М.: «Просвещение», 1971. С.189
4. Величко І.М.. Живі охоронці водойм. К.: Наукова думка. 1987. С. 43.
5. Гольдфарб Я.Л., Ходаков Ю.В, Додонов Ю.Б. Збірник задач і вправ з хімії 8 – 11 класи. К.: Рад. Шк. 1983 С. 175.
6. Григора І.М. і ін. Курс загальної ботаніки. К. Фітосоціоцентр 2003. С. 499.
7. Генкель П.А.Ю., Физиология растений. М. Просвещение. 1970. С. 386
7. Гусаков А.Х.,Лазаренко А.А. (составители). Учителю химии о внеклассной работе. М. Просвещение 1978. С. 127, 142
Давидов А.І. Піонерське гроно. К.: Молодь, 1997. С. 182
8. Деркач Ф.А. Практикум з неорганічної хімії. Львів, львівський університет. 1966. С. 333
9. Загубинога О.О., Науменко Г.С. Викладання біології у профільних класах
випуск 2. «Гурток «Голубий патруль». Авторська програма та методичні розробки занять з авторськими дидактичними іграми». «Видавництво «Основа»2007, С.175
10. Загубинога О.О., Науменко Г.С. Дидактичні ігри з хімії для учнів 7 – 9 класів«Видавництво « Основа» 2007. С. 188
11. Загубинога О.О., Науменко Г.С. Дидактичні матеріали з курсу «Основи здоров’я та безпеки життєдіяльності» «Біологія» в-во «Основа»№ 31 11. 2006
С. 13 - 22
12. Загубинога О.О., Науменко Г.С. Задачі з екології. «Біологія»в-во «Основа» № 14 05.2007. С. 315
14. Заданчук. С.А. Химический кружок.М. Просвещение. 1964. С. 147
15. Іванов М.А.. Химический демонстрационний експеримент. М. Высшая школа. 1969. С. 16 – 18
Казидуб Г.О. Зв'язок викладання хімії з сільським господарством. К.Рад. шк.. 1987. С.68
16. Корчагіна В.О.. Біологія 6 - 7 класи. К. Рад.шк. 1991. С. 282
17. Крицман В.А. (упорядник). Хімічна хрестоматія для учнів 7 і 8 класів.К.: Рад.шк. 1971. С. 426.
18. Кульский Л.А.. Вода, её использование в настоящем и будущем. К. Общ.»Знание» 1977. С. 45
19. Лавров Ю.А.. Напитки здоров’я. К. Техника. 1989. С. 142
20. Методичні рекомендації до лабораторних занять з дисципліни «Фізіологія рослин». К. Фітосоціоцентр. 2000. С. 61
Некрасов Б.В.. Основы общей химии.т І, т ІІ. М. Химия. 1973 Т.ІІ
21. Новиков Ю.В.. Природа и человек. М.; Просвещение, 1991. – С. 222
22. Поляков Г.Д.. Пособие по гидрохимии для рыбоводов. М. Пищепромиздат 1950. С. 84.
23. Практичні роботи з хімії.за ред.Н.М.Буринської. К.«Освіта» 1974.С.139
24. Прокофьев М.А. (редак.)Єнциклопедия Школьника. Неорганическая химия. М. Сов.Енц. 1975 С. 383
25. Рик Моррис. Тайны живой природы. М. «РОСМЭН» 1997 С.58 – 59
26. Скиннер Б. Хватит ли человечеству земних ресурсов? Пер. С англ..-М.; Мир, 1989, - С. 245
26. Соболь Н.В. Піклуємося про нашу річку. Журнал «Біологія» Х. ВГ «Основа» № 22 – 24 серпень 2007 С. 81 – 82
27. Сухарєва І.Х.. Фізіологія рослин. К. Рад.шк. 1972 С. 173.
28. Тарасенко О.Є. Довідник молодого охоронця природи. К.: Молодь, 1997. С. 118
29. Туріщева Л.В.. Енциклопедія хімічних розваг. Х. ВГ «Основа».2003. С. 47
30. Федій Є.М.. Фізіологія тварин. К. Рад.шк. 1971. С. 149.
31. Чернова Н.М., Былова А.М.. Экология.Учеб. пособие для студентов биол. спец. Пед. Ин-тов. – 2-е узд:, перераб. – М.: Просвещение, 1988. С. 272
32. Чертков І.М.,Жуков П.Н. Хімічний експеримент з малими кількостями реактивів.М. «Просвещение» 1980.С. 191
33. Юзбашева Г.С.. Навчальні комплексні екскурсії з хімії. Х. ВГ «Основа» 2003 С. 62


про публікацію авторської розробки
Додати розробку
