Закон Авогадро. Молярний об’єм. Обчислення об’єму газу за нормальних умов.
Тема. Закон Авогадро. Молярний об’єм. Обчислення об’єму газу за нормальних умов.
Цілі уроку:
- ознайомити учнів з поняттям «молярний об'єм»; розкрити особливості використання поняття «молярний об'єм» для газоподібних речовин.
Формування ключових компетеностей:
- спілкування державною мовою;
- математична компетентність;
- уміння вчитися впродовж життя;
- розвивати вміння логічно мислити, аналізувати, порівнювати і прогнозувати;
- виховувати в учнів допитливість і самовдосконалення;
- виховувати прагнення працювати самостійно.
Формування предметних компетентностей:
- навчити учнів використовувати отримані знання для розрахунків об'ємів газів за нормальних умов;
- вивести і засвоїти математичний вираз молярного об’єму та вміти застосувати його під час хімічних обчислень;
- розвивати пізнавальний інтерес, логічне мислення, пам’ять;
- формувати науковий світогляд
Обладнання та матеріали: періодична система хімічних елементів Д.І. Менделєєва, роздаткові картки з завданнями.
Тип уроку: урок засвоєння нових знань, навичок і вмінь.
Форми роботи: керована практика, самостійна робота, групова робота.
Очікувані результати навчальної діяльності: учні мають застосовувати поняття про молярний об’єм для обчислення кількості речовини; характеризувати спільні та відмінні ознаки понять «молярна маса» та «молярний об’єм»; називати нормальні умови для вимірювання об’ємів газів; обґрунтовувати закон Авогадро з погляду атомно-молекулярного вчення; обчислювати кількість речовини за відомим молярним об’ємом і числом частинок та об’єм речовини за відомою кількістю речовини і числом частинок.
Девіз уроку: «Вміння розв’язувати задачі – це мистецтво, що набувається практикою.» ( Д.Пойя)
Структура уроку:
І. Організаційний момент.
ІІ. Актуалізація опорних знань
ІІІ. Мотивація навчальної діяльності, повідомлення теми, мети, завдань уроку.
IV. Вивчення нового матеріалу.
V. Узагальнення і систематизація знань.
VІ. Підбиття підсумків уроку.
VIІ. Домашнє завдання.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ МОМЕНТ
Учні за допомогою смайликів визначають свій настрій на початку та в кінці уроку
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Перевірка домашнього завдання.
- Фронтальна бесіда
1) Що таке «кількість речовини»?
2) Одиниця вимірювання кількості речовини.
3) Скільки частинок міститься в 1 моль речовини?
4) Яка існує залежність між кількістю речовини й агрегатного стану, в якому перебуває ця речовина?
5) Скільки молекул води міститься в 1 моль льоду?
6) А в 1 моль рідкої води?
7) В 1 моль водяної пари?
8) Яку масу матимуть: • 1 моль льоду? • 1 моль води? • 1 моль пари?
III. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Оголошення теми, мети та завдань уроку.
IV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
- Проблемна ситуація.
Казка.
В одному великому будинку в сусідніх кімнатах жили два гази: 1 моль Кисню та 1 моль Водню. (запитання до класу: Скільки молекул кожного газу жило в кімнатах?). Жили вони дружно, поки одного разу не виникла між ними суперечка: хто з них важливіший? Кисень гордовито промовив: - Я підтримую горіння, дихання, без мене не було б життя на Землі. Водень знітився і тихенько промовив: - Але я теж важливий, адже я утворюю одну з найважливіших складних речовин – воду, в якій зароджується життя. Мене так і назвали «Водень» - той, що народжує воду.
Але Кисень не хотів навіть слухати його. Скільки не старалися сусіди примирити їх, але не змогли. І вирішили розселити ці два гази в нові квартири одинакові за розміром. Але Кисень не згодився на цю пропозицію. Він вважав, що його квартира повинна бути більшою. Як ви вважаєте, чому Кисень захотів більшої квартири? (Пропонуємо порівняти молярні маси Кисню і Водню і зробити відповідний висновок). Як ми переконалися, Кисень важчий від Водню в 16 разів, отже і квартира його повинна бути більшою. І пішов Кисень по різних інстанціях, але всюди йому відмовляли, пояснюючи це тим, для всіх газів діє закон Авогадро. Тому, давайте зясуємо зміст закону Авогадро і переконаємось, що з Киснем поступили по закону.
Вивченням газоподібних речовин займалося безліч учених. Значний внесок у вивчення цього питання зробили французький хімік Жозеф Луї Гей-Люссак та англійський фізик Роберт Бойль, які сформулювали низку фізичних закономірностей, що описують стан газів. Які з цих закономірностей ви знаєте? (відповіді учнів)
Усі гази однаково стискаються, мають однаковий термічний коефіцієнт розширення. Об’єми газів залежать не від розмірів окремих молекул, а від відстані між молекулами. Відстані між молекулами залежать від швидкості їхнього руху, енергії та, відповідно, температури.
На підставі цих законів і своїх досліджень італійський учений Амедео Авогадро сформулював закон:
В однакових об’ємах різних газів міститься однакова кількість молекул.
На основі цього закону справедливим буде обернене твердження: Однакова кількість молекул різних газів за однакових умов займатиме однаковий об’єм.
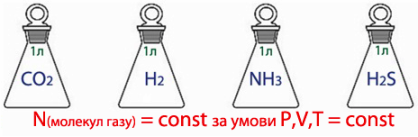
За звичайних умов газоподібні речовини мають молекулярну будову. Молекули газів дуже дрібні порівняно з відстанню між ними. Тому об’єм газу визначається не розміром частинок (молекул), а відстанню між ними, що для будь-якого газу приблизно однакова. А. Авогадро зробив висновок, що, якщо взяти 1 моль, тобто 6,02 • 1023 молекул будь-яких газів, то вони займатимуть однаковий об’єм. Але при цьому вимірюватися цей об’єм має за однакових умов, тобто за однакових температури й тиску.
Умови, за яких проводяться подібні розрахунки, назвали нормальними умовами. Нормальні умови (н.у.):
Т= 273 К або t = 0 °С Р = 101,3 кПа або Р = 1 атм. = 760 мм рт. ст.
1 моль будь-якого газу за н.у. займає об’єм 22,4 л. Цей об’єм називають молярним об’ємом. Молярний об’єм чисельно дорівнює об’єму 1 моль речовини і позначається Vm («ве-ем»):
Vm = 22,4 л/моль, м3/моль.
Молярний об’єм газу (Vm) визначається за відношенням об’єму (V) порції даного газу до кількості речовини (n) в цій порції:
Vm = ![]()
де V – об’єм газу за н. у., (л, м3); n кількість речовини газу, (моль).
Молярний об’єм газу – це величина, що дорівнює відношенню молярної маси газу до його густини:
Vm = ![]()
де M – молярна маса газу; ρ – густина газу.
І тип. Обчислення кількості речовини за відомим об’ємом.
Задача 1. Яка кількість речовини карбон(IV) оксиду об’ємом 67,2 л?
Тепер розв’яжемо задачу.
![]() Дано: Розв’язання:
Дано: Розв’язання:
![]() V(СO2) = 67,2 л n = V : Vm
V(СO2) = 67,2 л n = V : Vm
Знайти: Визначаємо кількість речовини CO2
n(СO2) – ? n(CO2) = ![]() = 3 моль
= 3 моль
Відповідь: n(СO2) = 3 моль.
А тепер розв’яжіть задачі, які ви бачите на слайді, у складі груп. (Додаток А)
ІІ тип. Обчислення об’єму речовини за відомою масою.
Задача 2. Який об’єм займає кисень масою 3,2 г?
![]() Дано: Розв’язання:
Дано: Розв’язання:
m(O2) = 3,2 г V = n • Vm; ![]()
![]() M(O2) = 32 г/моль 1) Визначаємо кількість речовини O2:
M(O2) = 32 г/моль 1) Визначаємо кількість речовини O2:
Знайти: n(O2) = ![]() = 0,1 моль
= 0,1 моль
V(O2) – ? 2) Знаходимо об’єм О2:
V(O2) = n(O2) • Vm; V(O2) = 0,1 • 22,4 = 2,24 (л).
Відповідь: V(O2) = 2,24 л.
Виконайте завдання у групах. (Додаток Б)
ІІІ тип. Обчислення маси речовини за відомим об’ємом.
Задача 3. Яку масу займає кисень обємом 44,8 л?
![]() Дано: Розв’язання:
Дано: Розв’язання:
V(O2) = 44,8 л m = n • M; n = V : Vm
![]() M(O2) = 32 г/моль 1) Визначаємо кількість речовини O2:
M(O2) = 32 г/моль 1) Визначаємо кількість речовини O2:
Знайти: n(O2) = ![]() = 2 моль
= 2 моль
m(O2) – ? 2) Знаходимо масу О2:
m(O2) = n(O2) • M(O2); m(O2) = 2 • 32 = 64 г.
Відповідь: m(O2) = 64 г.
Виконайте завдання у групах. (Додаток В)
Відгадайте.
Тисячі років людина захоплюється, милується цією речовиною. У сиву давнину говорили: «Вона – одне з начал усього, що є на Землі». У середньовіччя вважали, що вона – проста речовина, єдина й неподільна. Але А. Лавуазьє довів, що вона складається з діох елементів і утворюється внаслідок хімічної реакції. Властивості цієї речовини визначають властивості розчинів, стверджував Д.І. Менделєєв. Про неї є багато відомостей, однак вона все ще залишається найзагадковішою…
Про яку речовину йдеться? (Вода)
Вода утворена з двох газів: водню й кисню.
![]() Задача.
Задача.
Дано: Розв’язання:
![]() n(O2) = 180 г
n(O2) = 180 г ![]() ; V = Vmn;
; V = Vmn;
Знайти: 1) n(O2) = ![]() = 5,625 моль
= 5,625 моль
V(O2) ? 2) V(O2) = 5,625 моль22,4 л/моль = 126 л.
Відповідь: 126 л О2.
V. УЗАГАЛЬНЕННЯ І СИСТЕМАТИЗАЦІЯ ЗНАНЬ
1. Розв’язування задач.
2. Заповнити в таблиці пропущені місця. (Додаток Г)
VI. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
- Рефлексія.
Учні по колу висловлюються одним реченням:
Сьогодні я дізнався…Було цікаво…Я виконував завдання…Було складно…Тепер я зможу…Я зрозумів…У мене вийшло… Я відчув, що…Мене здивувало… Я навчився…Я придбав… Я зміг…Я спробую… Мені захотілося…Урок дав мені для життя…
- Оцінювання учнів.
VII. ДОМАШНЄ ЗАВДАННЯ
1. § 24, завдання 4, 5.
Опрацювати відповідний параграф підручника, відповісти на запитання.
- Складіть кросворд і розгадайте його. (Запитання для кроссворду надруковані на окремих аркушах)
- Одна з фізичних характеристик, позначається у фізиці й хімії буквою m
- Міра довжини тіл, позначається буквою l.
- Інша назва сталої Авогадро, позначається буквою NA.
- Фізична величина, що вимірюється в молях.
- Найчастіше вживана одиниця вимірювання, позначається літерою л.
- Одиниця вимірювання маси тіл, позначається кг.
- Маса, що визначається як відношення фізичної маси до об’єму, позначається М.
- Одиниця кількості речовини.
- Хімік, на честь якого названа величина, що позначається NА.
- Вживана в побуті назва одиниці об’єму, що позначається м3
- Інша назва незмінної величини.
- Так читається літера, якою позначається кількість речовини.
- Найбільш прийнята одиниця для вимірювання газів, позначається літерою V.
Відповіді. 1. Маса. 2 Метр. 3 Число. 4. Кількість речовини. 5. Літр. 6. Кілограм. 7. Молярна. 8. Моль. 9. Авогадро. 10. Кубометр. 11. Стала. 12. Ню. 13. Об’єм.
2. Розв’яжіть задачу. (Додаток Д)
Додаток А
Задачі І типу
- Обчисліть кількість речовини газу, який займає об’єм 44,8 л;
- Обчисліть кількість речовини газу, який займає об’єм 89,6 л;
- Обчисліть кількість речовини газу, який займає об’єм 6,72 л;
- Обчисліть кількість речовини газу, який займає об’єм 2,24 л.
Додаток Б
Задачі ІІ типу
- Який об’єм за нормальних умов займає О2 масою 8 г;
- Який об’єм за нормальних умов займає СО2 масою 11 г;
- Який об’єм за нормальних умов займає N2 масою 7 г;
- Який об’єм за нормальних умов займає Н2 масою 12 г.
Додаток В
Задачі ІІІ типу
- Обчисліть масу СО2, який за нормальних умов займає обєм 24 л.
- Обчисліть масу О2, який за нормальних умов займає обєм 24 л.
- Обчисліть масу Н2, який за нормальних умов займає обєм 24 л.
- Обчисліть масу N2, який за нормальних умов займає обєм 24 л.
Додаток Г
Заповнити в таблиці пропущені місця
|
Речовини |
V(газу) |
М(реч),г/моль |
n (реч), моль |
m(реч.),г |
N, молекул |
N,атомів |
|
Na2O |
|
|
2 |
|
|
|
|
K2CO3 |
|
|
|
|
1,803*1022 |
|
|
O2 |
|
|
|
|
|
3,01*1023 |
|
Mg(OH)2 |
|
|
|
11,6 |
|
|
|
Ca3(PO4)2 |
|
|
|
1,55 |
|
|
Додаток Д
Середній рівень (розв’язати за зразком задачу)
І Варіант
Обчислити об’єм, що займе при нормальних умовах водень кількістю речовини 1,5 моль.
ІІ Варіант
Обчислити, якій кількості речовини відповідатиме 4,48 л вуглекислого газу.
Достатній рівень
І Варіант
П’ятачок на день народження друга вирішив надути повітряні кульки. Допоможіть йому обчисліть об’єм Гелію, кількістю речовини 3,5 моль.
ІІ Варіант
Для оборотного зілля Гаррі Потерру потрібно взяти 7 моль сірководню H2S. Допоможіть обчислити, які необхідні об’єм та маса газу?
Високий рівень
І Варіант
Обчислити кількість молекул та атомів, що міститься в 89,6 л кисню при нормальних умовах.
ІІ Варіант
Допоможіть Мауглі порахувати, яку кількість речовини та масу кисню виробляють дерева в джунглях, якщо відомо, що загальний об’єм O2 складає 5600 літрів.
Додаток Е
Картка самооцінювання
|
Вивчений матеріал |
Бали |
|
Я знаю, що таке |
|
|
|
|
|
|
|
|
Я вмію |
|
|
|
|
|
|
|
|
|
|
|
|
0 – не знаю, 1 – потребує вдосконалення, 2 – задовільно, 3 – добре, 4 чудово |
|


про публікацію авторської розробки
Додати розробку
