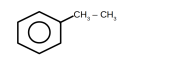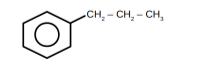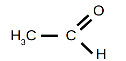Збірник задач і вправ з хімії для 10 класу
Збірник
задач і вправ з хімії
для 10 класу
(за новою програмою)
О.А.Вовчук
У запропонованому збірнику подано різноманітні завдання, які охоплюють всі теми шкільного курсу хімії 10 класу за новою програмою .
Матеріал розподілений за темами програми. До кожної теми подається кілька завдань. Посібник можна використовувати у підготовці до уроків хімії, до олімпіад.
Для вчителів хімії, учнів загальноосвітніх закладів.
Зміст
Розділ І Передмова ……….................................. 4
Розділ ІІ Збірник задач і вправ з хімії 10 клас…….. 5 - 29
Список використаних джерел ………………………… 30
Передмова
Використання задач у навчальному процесі допомагає реалізувати такі першочергові завдання школи як:
- Забезпечення самостійності та активності учнів;
- Реалізація політехнічного навчання;
- Забезпечення якості і міцності знань та вмінь;
- Здійснення зв’язку з життям шляхом професійної орієнтації;
- Забезпечення єдності навчання, виховання і розвитку.
Розв’язування задач сприяє розвитку спостережливості, виховує ініціативу, бажання більше знати і втілити свої знання на практиці.
Такий вид роботи є також одним із необхідних факторів при закріпленні правил, формулювань, законів, формул, розвитку логічного мислення. Складання алгоритмів систематизує знання, виробляє методику оптимального підходу до творчого обґрунтування задачі, її практичного виконання.
Цілком можливе використання збірника і в урочній діяльності з метою закріплення знань, індивідуалізації процесу навчання хімії. Він допоможе вчителем звести до мінімуму під час підготовки самостійних і контрольних робіт.
Перспективним є використання збірника на факультативних заняттях.
Теорія будови органічних речовин
- Зобразіть електронну конфігурацію атома Карбону і його електронну будову в нормальному і збудженому станах. Поясніть чому Карбон в сполуках чотиривалентний. Які типи гібридизації характерні для Карбону? Яка форма електронних хмар та які валентні кути властиві для кожного зі станів?
- Зобразіть електронні конфігурації та електронні формули валентних електронів для атомів Карбону, Силіцію, Нітрогену, Оксигену. Поясніть чому саме атоми Карбону мають виключну здатність утворювати ланцюги.
- Відомо більше 6 млн. органічних сполук і лише близько 700 тис. неорганічних. Поясніть таку кількісну відмінність.
- Поясніть, чому більшість органічних речовин мають молекулярну будову, тоді як неорганічні – переважно немолекулярну.
- Поясніть, чому явище ізомерії сприяло створенню О.М.Бутлеровим теорії будови органічних сполук.
- Чи є ізомерами такі сполуки:
![]()
![]()
![]() Н Н Н
Н Н Н
![]()
![]()
![]() а) Н – С – С – С – Н б) СН3 – СН2 – СН3
а) Н – С – С – С – Н б) СН3 – СН2 – СН3
Н Н Н
![]()
![]() Н Н
Н Н
![]()
![]()
![]() в) СН3 – СН2 г) Н3С – С – С – Н
в) СН3 – СН2 г) Н3С – С – С – Н
СН3 Н Н
![]()
![]() Н Н
Н Н
![]()
![]() д) Н – С – СН2 – С – Н
д) Н – С – СН2 – С – Н
Н Н
- З наведених структурних формул випишіть ізомери:
![]() а) СН3 – СН2 – СН – СН3
а) СН3 – СН2 – СН – СН3
СН3
![]() б) СН3 – СН – СН2 – СН3
б) СН3 – СН – СН2 – СН3
СН3
![]()
![]() в) СН3 – СН – СН – СН3
в) СН3 – СН – СН – СН3
СН3 СН3
![]() СН3
СН3
![]() г) СН3 – С – СН2 – СН3
г) СН3 – С – СН2 – СН3
СН3
![]() СН3
СН3
![]()
![]() д) СН3 – СН – С – Н
д) СН3 – СН – С – Н
СН3 СН3
![]() СН3
СН3
![]()
![]() е) Н– С – СН2 – СН2
е) Н– С – СН2 – СН2
СН3 СН3
- Скільки формул речовин зображено:
![]() а) СН3 – СН – СН2 – СН2 – СН3
а) СН3 – СН – СН2 – СН2 – СН3
СН3
![]() СН3 – СН2 – СН2 – СН – СН3
СН3 – СН2 – СН2 – СН – СН3
СН3
![]() СН3 – СН2 – СН– СН2 – СН3
СН3 – СН2 – СН– СН2 – СН3
СН3
![]() СН3
СН3
![]() б) СН3 – СН2 – СН– СН – СН3
б) СН3 – СН2 – СН– СН – СН3
СН3
![]()
![]() СН3 – СН – СН– СН2 – СН3
СН3 – СН – СН– СН2 – СН3
СН3 СН3
![]() СН3
СН3
![]() СН3 – СН2 – С– СН2 – СН3
СН3 – СН2 – С– СН2 – СН3
СН3
- Для ізомерів однакові:
а) значення молярних мас;
б) фізичні властивості;
в) структурні формули молекул;
г) як якісних, так і кількісний склад молекул.
10. Укажіть тип хімічного зв’язку , найбільш характерний для органічних сполук:
а) йонний;
б) металічний;
в) водневий;
г) ковалентний.
11. Більшість органічних речовин легкоплавкі, оскільки мають кристалічну гратку:
а) йонну;
б) металічну;
в) атомну;
г) молекулярну.
12. Укажіть правильні для гомологів твердження:
а) мають однакові значення молекулярних мас;
б) можуть розрізнятися за хімічними властивостями;
в) розрізняють за складом на одну або декілька груп СН2;
г) мають однакову загальну формулу для всіх членів гомологічного ряду.
13. Укажіть неправильні твердження:
а) органічні сполуки не можна отримати з неорганічних;
б) валентність атома Карбону в молекулі С2Н6 дорівнює ІІІ;
в) не може бути речовин з однаковою формулою, але різною будовою;
г) для Карбону в органічних сполуках характерна валентність, що дорівнює ІV.
14. Сполуки гексан та 2-метилпентан це:
а) гомологи;
б) структурні ізомери;
в) геометричні ізомери;
г) одна й та сама речовина.
15. Укажіть кількість ізомерних насичених сполук складу С5Н12:
а) 3; б) 4; в) 5; г) 6.
Для підтвердження відповіді складіть структурні формули відповідних ізомерів та вкажіть їх назви.
Вуглеводні
Алкани
- Назвіть вуглеводні. Вкажіть серед них ізомери:
![]() а) С3Н– СН2 – СН2 – СН – СН3
а) С3Н– СН2 – СН2 – СН – СН3
СН3
![]()
![]() б) С3Н– СН – СН2 – СН – СН3
б) С3Н– СН – СН2 – СН – СН3
СН3 СН3
![]() в) С3Н– СН – СН2 – СН3
в) С3Н– СН – СН2 – СН3
![]() СН3 СН3
СН3 СН3
![]()
![]() г) С2Н– СН – СН3
г) С2Н– СН – СН3
СН3 СН3
![]()
![]() д) С3Н– СН – СН– СН2 – СН3
д) С3Н– СН – СН– СН2 – СН3
СН3 СН3
![]()
![]() СН3 СН3
СН3 СН3
![]()
![]() е) СН– СН2 – СН
е) СН– СН2 – СН
СН3 СН3
- Назвіть вуглеводні:
![]()
![]() СН2 – СН3 СН3
СН2 – СН3 СН3
![]() а) С3Н– СН – СН2 – С – СН3
а) С3Н– СН – СН2 – С – СН3
СН3
![]() б) Н3С – СН2
б) Н3С – СН2
![]() Н3С – СН2 СН – СН3
Н3С – СН2 СН – СН3
![]() СН3
СН3
![]()
![]() в)H3C– С – СН2 – СН – СН2 – СН3
в)H3C– С – СН2 – СН – СН2 – СН3
СН3 СН3
![]() СН3
СН3
![]() г) С3Н– С – СН3
г) С3Н– С – СН3
СН3
- Напишіть структурні формули вуглеводнів. Вкажіть серед них ізомери:
а) 2, 2, 3 – триметилгексан;
б) 3, 3 – диетилпентан;
в) 2, 4 – диметилпентан ;
г) 2, 2, 3, 3 – тетраметилгексан;
д) 3, 3 – диетилгексан;
е) 2, 3, 4 – триметил гексан.
4. Запишіть схеми перетворень:
![]()
![]()
![]()
![]() СН4 СН3Сl С2Н6 СН3СН2Сl СН3СН2NН2
СН4 СН3Сl С2Н6 СН3СН2Сl СН3СН2NН2
5 . Наведіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
![]()
![]()
![]() етан брометан бутан 2-хлорбутан
етан брометан бутан 2-хлорбутан
вуглекислий газ
6. Наведіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
![]()
![]()
![]()
![]() С СН4 СН3Сl С2Н6 СО2
С СН4 СН3Сl С2Н6 СО2
С2Н2
7. Яку масу має пропан об’ємом 1,12л?
8. У якому випадку витратиться більше кисню на спалювання 1м3 етану чи 1м3 пропану?
9. Який об’єм карбон(ІV) оксиду утвориться при спалюванні 3,5 моль етану?
10. Обчислити густину тетрахлоретану за повітрям.
11. Виведіть формулу алкану, якщо відомі масові частки елементів, що входять до його складу: С – 82,6%; Н – 17,24%.
12. Яка структурна формула газу, що є алканом, якщо маса 5,6л його (н.у.) становить11г?
13. Який об’єм метану (н.у.) можна одержати з 20кг карбіду алюмінію Аl4С3?
14. При спалюванні 29г органічної речовини утворилось 88г вуглекислого газу і 45г води. Відносна густина пари цієї речовини за повітрям 2. Встановити молекулярну формулу речовини.
15. Спалили 5,6л бутану. Утворений карбон (ІV)оксид пропустили через розчин, що містить 102,6г барій гідроксиду. Яка сіль утворилась і якої маси?
Алкени. Алкіни
- В якому стані гібридизації можуть перебувати атоми Карбону в молекулах алкенів:
а) тільки Sp2 –
б) в стані Sp3 –
в) Sp3;Sp2–
г) Sp3;Sp; Sp2-?
2. Чим пояснюєтьсяздатністьетиленовихвуглеводіввступати в реакціїприєднання;
а) массою, довжиноюзв'язку;
б) наявність π-зв’язку ;
в) наявністю сигма – зв’язку.
г) деформацією молекули під впливом подвійного зв’язку?
3. Які хімічні реакції характеризують етиленові вуглеводні:
а) розщеплення;
б) приєднання;
в) розкладу?
4. Як називається число, що показує кількість елементарних ланок у полімерії:
а) мономером;
б) полімером;
в) ступенем полімеризації;
г) молекулярною масою?
5. Назвіть за міжнародною номенклатурою сполуки:
а) СН3 – СН2 – СН = СН – СН2 – СН3
![]()
![]() б) СН3 – СН– СН = С – СН2 – СН3
б) СН3 – СН– СН = С – СН2 – СН3
СН3 СН3
![]()
![]() в) СН3 – С = С – СН2 – СН3
в) СН3 – С = С – СН2 – СН3
СН3 СН3
6. Записати схеми таких перетворень речовин:
![]()
![]()
![]() СН2 = СН2 СН3СН2ОН СН2 = СН – СН = СН2 полібутадієн
СН2 = СН2 СН3СН2ОН СН2 = СН – СН = СН2 полібутадієн
7. Напишіть рівняння реакцій, за допомогою яких можна здійснити наступні перетворення. Вкажіть умови їх протікання:
![]()
![]()
![]() а) С2Н5ОН С2Н4 С2Н5Сl С4Н10
а) С2Н5ОН С2Н4 С2Н5Сl С4Н10
![]()
![]()
![]() б) С8Н18 С4Н8 С4Н8Вr2 С4Н8
б) С8Н18 С4Н8 С4Н8Вr2 С4Н8
![]()
![]()
![]() в) С3Н4 С3Н6 (С3Н6)n С3Н6
в) С3Н4 С3Н6 (С3Н6)n С3Н6
![]()
![]()
![]() г) С3Н6 С3Н7ОН С3Н6 С3Н6(ОН)2
г) С3Н6 С3Н7ОН С3Н6 С3Н6(ОН)2
8. Яка маса бромної води з масовою часткою брому 3,2% може прореагувати з 8,4г алкену, густина якого за повітрям 1,45?
9. Виведіть молекулярну формулу газу, знаючи, що масова частка Карбону в ньому 85,7%, Гідрогену – 14,3%. Відносна густина газу за воднем – 21.
10. На гідрування 2,8г етиленового вуглеводню витрачається 0,869л водню (н.у.) . Яка молекулярна маса і формула цієї сполуки?
11. Відносна густина пари речовини за воднем – 28. Масова частка Карбону в ній становить 85,72%, Гідрогену – 14,28%. Сполука знебарвлює бромну воду. Що це за сполука?
12. При згорянні 4,2г речовини утворилося 13,2г карбон (ІV) оксиду і 5,4г води. Відносна густина пари даної речовини за повітрям становить 2,9. Яка це сполука?
13. Алкен масою 7г приєднує бромоводень, об’єм якого однаковий з об’ємом метану масою 2г (н.у.). Визначити формулу алкену.
14.Щоб спалити 1 моль ацетиленового вуглеводню, необхідно 56л кисню. Встановити формулу сполуки.
15. З 5г ацетилену за реакцією Кучерова добуто 3г оцтового альдегіду. Яка масова частка виходу альдегіду?
Арени
- Який стан гібридизації атомів Карбону в молекулі бензену:
а) Sp3 - б) Sp2 - в) S2p - г) Sp - ?
2. Укажіть речовину або суміш речовин, з якою реагує бензен зі збереженням бензенового кільця:
а) водень;
б) бром в наявності каталізатора FeBr3;
в) хлор при освітленні;
г) кисень.
3. Яка з наведених сполук легко вступає в реакцію з нітратною кислотою:
А) бензен б) толуол в) циклогексан?
4. Записати схеми таких перетворень:
![]()
![]()
![]() C6H6Cl6
C6H6Cl6
![]()
![]()
![]() СН С2Н2 С6Н6 С6Н5Сl
СН С2Н2 С6Н6 С6Н5Сl
5.Записати схеми перетворень:
![]()
![]()
![]()
![]() С2Н6 С2Н6 С2Н2 С6Н6 С6Н5Сl
С2Н6 С2Н6 С2Н2 С6Н6 С6Н5Сl
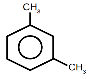
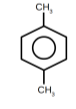
6. Дайте назву сполукам:
|
а. |
|
в. |
|
|
б. |
|
г. |
|
7. Напишіть рівняння реакції одержання бромбензену. Яка відмінність між продуктами бромування бензену і толуолу? Поясніть причину.
8. Який об’єм кисню необхідний для повного згоряння 10кг бензену?
9. Скільки грамів бромбензену можна добути при взаємодії 106г бензену і 323г брому?
10. Прореагували 2кг бензену і 1,8л нітратної кислоти (густина 1,44 2/см3). Скільки кг нітробензену утворилося при цьому?
11. Скільки літрів водню (н.у.) виділиться при каталітичному дегідруванні 122,5г метилциклогексану в толуол, якщо масова частка виходу толуолу становить 75%.
12. Знайдіть формулу вуглеводню, якщо після його згорання утворилося 0,6 моль вуглекислого газу і 0,3 моль води. Відносна густина пари сполуки за повітрям становить 2,69.
13. При спалюванні 9,75г органічної речовини, відносна густина парів якої за воднем – 39, утворилося 33г карбон (ІV) оксиду і 6,75г води. Визначити сполуку.
14. Скільки грамів бензену потрібно пронітрувати, для одержання 21г нітробензену, якщо масова частка виходу нітробензену становить 85,4%.
15. При спалюванні 2,3г органічної речовини утворилось 7,7г карбон (ІV) оксиду і 1,8г води. Відносна густина пари цієї речовини за вуглекислим газом 2,09. Встановити молекулярну формулу речовини.
Оксигеновмісні органічні сполуки
Спирти
- Назвати речовини:
а) СН3 – СН2 – СН2 – СН2 – ОН
![]() б) СН3 – СН – СН2 – ОН
б) СН3 – СН – СН2 – ОН
СН3
![]() в) СН3 – СН2 – СН– СН3
в) СН3 – СН2 – СН– СН3
ОН
![]() СН3
СН3
![]() г) СН3 – С – СН3
г) СН3 – С – СН3
ОН
- Зообразити структурну формулу
а) 2,3 диметилбутан – 1 – ол
б) 3 метилбутан – 2 – ол
в) гексан – 1 – ол
3. Вивести хімічну формулу насиченого одноатомного спирту, якщо його молярна маса становить 46г/моль.
4. Записати схеми перетворень: виходячи з 2-метилбутан одержати 2 метилбутан - 2 – ол.
5. Обчисліть об’єм природного газу (н.у.), необхідний для добування метилового спирту масою 30г при каталітичному окисненні метану, якщо об’ємна частка метану в газі – 90%.
6. У якому об’ємі природно газу міститься 21л метану?
7. При дії металічного натрію на насичений спирт виділилось 280мл водню. Визначте молекулярну масу і формулу спирту, якщо його в реакцію вступило 1,15г.
8. Вивести формулу спирту, якщо при спалюванні 0,48г цієї сполуки утворилося 0,336л (н.у.) вуглекислого газу та 0,54г води.
9. Здійснити перетворення:
![]()
![]()
![]() а) С2Н5ОН С2Н4 С2Н5Сl С2Н5ОН
а) С2Н5ОН С2Н4 С2Н5Сl С2Н5ОН
![]()
![]()
![]() б) СН4 С2Н2 С2Н4 С2Н5ОН
б) СН4 С2Н2 С2Н4 С2Н5ОН
10. При спалюванні 22г речовини утворилось 55г СО2 і 27г Н2О. Ця речовина взаємодіє з НВr з утворенням 2-бром – 2 метилбутану. Яка це речовина?
11. Який об’єм етилену потрібний для виробництва 4т етилового спирту, якщо масова частка виходу становить 85%.
12. Скільки грамів води і який об’єм карбон (ІV) оксиду утвориться при спалюванні 400г розчину етилового спирту з масовою часткою С2Н5ОН 96%?
13. Який об’єм 96% етанолу (густина 0,8г/мл) можна одержати з 1,8кг глюкози?
14. Скільки грамів гліцерину вступає в реакцію з 0,75л розчину нітратної кислоти (густина1,085г/см3) з масовою часткою НNO3 15%, якщо при цьому утворюється мононітрогліцерину? Скільки грамів моно нітрогліцерину при цьому утворюється?
15. При згорянні 2,7г органічної сполуки утворилося 5,28гкарбон оксиду та 2,7г води. Густина пари цієї речовини за воднем 45. Скільки ізомерів має речовина з такою молекулярною формулою, якщо відомо, що вона реагує з купрум (ІІ) гідроксидом з утворенням яскраво – синього розчину?
Фенол
- У трьох пробірках знаходяться етанол, гліцерин і фенол. За допомогою яких хімічних реакцій можна розрізнити ці речовини? Написати рівняння відповідних реакцій.
- Складіть рівняння реакцій фенолу з літієм, калій гідроксидом і назвіть сполуки, що утворюються.
- Який об’єм водню (н.у.) виділиться в результаті взаємодії 2,3г натрію з надлишком фенолу?
- Масові частки Карбону й Оксигену в ароматичній органічній сполуці становить відповідно 76,6% і 17%, а відносна молекулярна маса – 94. Визначте формулу сполуки.
- Скільки грамів фенолу було в реакційній суміші, якщо при взаємодії з бромною водою добуто 9,97г трибромфенолу?
- Скільки фенолу можна добути з 2т феноляту калію?
- Який об’єм газу виділиться при взаємодії 18,8г фенолу з металічним натрієм?
- Скільки грамів натрію вступило в реакцію з фенолом, якщо при цьому добули 112г феноляту натрію, масова частка виходу якого становить 95%?
- Скільки грамів продукту утвориться при змішуванні 250г розчину з масовою часткою фенолу 94% і 750г розчину з масовою часткою брому 10%?
- Скільки грамів фенолу необхідно взяти, щоб з 200г розчину з масовою часткою фенолу 20% добути розчин, з масовою часткою фенолу 30%?
- Який продукт і якою масою утворюється при взаємодії 14,1г фенолу і 9,45г нітратної кислоти?
- Визначте масу фенолу, який можна отримати з 36кг хлорбензену, якщо втрати виробництва становлять 10%.
- Визначте масу фенолу, який можна отримати з 150г 25%-го (за масою)розчину натрію феноляту. Якою речовиною треба обробити розчин натрій феноляту?
- Запропонуйте хід перетворень метану у фенол і обчисліть масу фенолу, яку можна одержати з 15,68л метану, якщо вихід кінцевого продукту становить 45%.
- Визначте масові частки (%) етанолу та фенолу в суміші, якщо при дії на неї металічним натрієм виділилось 2,24л водню (н.у.), а при взаємодії суміші з бромом утворився 2,4,6 – трибромфенол масою 33,1г.
Альдегіди
- Які альдегіди можна отримати при окисненні або каталітичному дегідруванні таких сполук:
а) бутан – 1 –ол.
б) 2,4 – диметил пропан – 1 – ол?
2. Складіть структурні формули всіх ізомерів альдегідів складу С5Н10О та вкажіть їхні назви.
3. Укажіть речовину, яка утвориться при відновленні альдегіду:
а) первинний спирт;
б) третинний спирт;
в) карбонова кислота;
г) вторинний спирт.
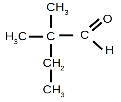
4. Укажіть назви відповідних сполук:
|
а. |
|
б. |
|
5.Напишіть рівняння реакцій окиснення амоніачним розчином арґентум (І) оксиду таких альдегідів:
А) оцтового;
Б) пропіонового;
В) масляного.
Поясніть, чому ця реакція є якісною на альдегіди.
6. Здійсніть перетворення:
![]()
![]()
![]() метан хлорметан метанол метаналь.
метан хлорметан метанол метаналь.
7. Внаслідок відновлення арґентум оксиду оцтовим альдегідом утворилося 10,8г срібла. Скільки грамів альдегіду прореагувало?
8. Яку масу карбонату кальцію з масовою часткою домішок 20% потрібно для добування 80кг оцтового альдегіду за реакцією Кучерова?
9. Визначте формулу альдегіду, який має відносну молекулярну масу 86 і четвертинний атом Карбону в молекулі.
10. Скільки грамів оцтового альдегіду утвориться при окисненні 100мл етилового спирту з масовою часткою С2Н5ОН 92% (густина 0,8г/см3).
11. При взаємодії етанолу масою 13,8г з купрум (ІІ) оксидом масою 28г одержали альдегід, маса якого становить 9,24г. Визначте масову частку виходу продукту від теоретичного можливого.
12. Визначте масу оцтового альдегіду, що утворюється при окисненні 50мл 96% - го (за масою) розчину етилового спирту (густина 0,8г/см3).
13. Визначте масу срібла, що утвориться за реакцією «срібного дзеркала», якщо до амоніачного розчину арґентум (І) оксиду додали водний розчин етаналю масою 200г і масовою часткою альдегіду 3,3%.
14. У невідомій органічній речовині масова частка Карбону складає 54,55%. Гідрогену – 9,09%, а Оксигену 36,36%. Відносна густина пари за воднем дорівнює 22. Відомо, що речовина легко відновлює амоніачний розчин арґентум (І) Оксиду, утворюючи кислоту. Визначте формулу цієї речовини.
15. З Карбіду кальцію масою 50г, який містить 20% домішок (за масою), одержали ацетилен, а з нього – ацетальдегід. Який об’єм водню необхідний для його повного відновлення?
Карбонові кислоти
- Здійснити перетворення:
![]()
![]()
![]() етанол етаналь етанова кислота хлоретанова кислота
етанол етаналь етанова кислота хлоретанова кислота
- Укажіть продукти нагрівання мурашиної кислота з концентрованою Н2SО4:
а) СО + Н2О
б) СО2 + Н2О
в) (СООН)2 + Н2О
г) С + Н2О
3. Карбонові кислоти отримують
а) фракційною перегонкою нафти;
б) окисненням альдегідів;
в) гідруванням алканів;
г) гідратацією алкекнів.
4. Укажіть невідому речовину Х у такій схемі перетворень:
![]()
![]()
![]()
![]()
![]() етилен етан хлоретан Х етаналь етанова кислота
етилен етан хлоретан Х етаналь етанова кислота
а) етанова кислота;
б) етанол;
в) етен;
г) етин.
Для підтвердження відповіді складіть рівняння відповідних реакцій, укажіть умови перебігу реакцій.
5.На нейтралізацію 13,22г одноосновної насиченої карбонової кислоти було витрачено 22,5мл 25% -го за масою розчину гідроксиду натрію (густина 1,27г/мл). Яка це кислота?
6. Крізь розчин оцтової кислоти масою 150г з масовою часткою кислоти 20% пропустили амоніак об’ємом 4,48л (н.у.) Визначити масову частку оцтової кислоти у добутому розчині.
7. Оцет є 6% - вим розчином оцтової кислоти. Скільки треба узяти оцтової есенції з масовою часткою оцтової кислоти 80% для приготування 200г оцту?
8. Для добування 1т оцтової кислоти з масовою часткою СН3СООН 99% було витрачено 1,5т етилового спирту з масовою часткою С2Н5ОН 87%. Визначте масову частку виходу кислоти.
9. На нейтралізацію одноосновної органічної кислоти масою 1,2г затрачено 20мл 1М розчину КОН. Яка це кислота?
10. Визначити масу 80%-го розчину етанової кислоти, яку можна отримати при окисненні 2кг етаналю.
11. Визначте масу технічного Кальцій карбіду з масовою часткою СаС2 80%, яку необхідно витратити, щоб отримати 30кг оцтової кислоти.
12. Яку масу оцтової кислоти можна добути при окисненні оцтового альдегіду масою 500кг, якщо масова частка СН3СООН в розчині – 80%?
13. Який об’єм розчину гідроксиду натрію з масовою часткою NaOH 20% (густина 0,9г/см3) буде витрачений на нейтралізацію 60г розчину оцтової кислоти з масовою часткою СН3СООН 15%?
14. Яка маса розчину натрій гідроксиду з масовою часткою лугу 20% витрачається на нейтралізацію 50г розчину пропанової кислоти з масовою часткою кислоти 7,4%?
15. Масові частки Карбону, Гідрогену і Оксигену в одноосновній кислоті становлять відповідно 26,1%; 4,35%; 69,55%. Виведіть формулу речовини.
Естери. Жири. Мила
- Складіть структурні формули естерів складу С4Н8О та вкажіть їхні назви за міжнародною номенклатурою.
- Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
![]()
![]()
![]() СН3ОН НСНО НССООН НСООСН3
СН3ОН НСНО НССООН НСООСН3
- Скільки молів оцтовоетилового ефіру можна добути з 16г етилового спирту 31г оцтової кислоти?
- Яка маса естеру утвориться в результаті взаємодії 50г мурашиної кислоти і 50г етилового спирту?
- Яку масу етилового естеру оцтової кислоти можна добути з 120г оцтової кислоти і 92г спирту, якщо масова частка практичного виходу естеру становить 90% від теоретично можливого?
- При взаємодії 96% етанолу об’ємом 200мл (густина 0,8 г/мл) з оцтовою кислотою масою 120г утворився естер. Знайдіть масу естеру, якщо масова частка його практичного виходу становить 95%.
- Визначте масу естеру, який утвориться у результаті взаємодії етанової кислоти масою 65г з метанолом масою 84г. Указати назву утвореного естеру.
- Визначте масу розчину лугу з масовою часткою NaОН 25%, необхідного для одержання мила у процесі переробки 3кг тригліцериду олеїнової кислоти.
- Обчисліть скільки стеарату кальцію можна добути з 28,4г стеаринової кислоти при взаємодії з негашеним вапном.
- На виробництво 1т туалетного мила, в якому масова частка стеарату натрію становить 60%, витрачається 748кг жирних кислот (стеаринової) і 124кг розчину їдкого натру, в якому масова частка NаОН 92%. Яка масова частка виходу мила?
- Скільки тонн триолеїну потрібно витратити на виробництво 1млн. тонн мила, якщо масова частка стеарату натрію у милі становить 10%?
- Скільки тонн гліцерину можна одержати з 25т технічного жиру, що містить тристеарин масовою часткою 85,4% і 14,6% води та домішок?
- Скільки триолеїну вступило в реакцію, якщо при цьому виділилось 25г гліцерину?
- Зразок жиру, що являє собою триолеат, піддали гідролізу. Яку масу жиру було взято, якщо на гідрування добутої кислоти витратили водень об’ємом 336л?
- Визначте об’єм водню (н.у.), необхідний для перетворення 26,7кг рідкого жиру (тригліцериду олеїнової кислоти) у твердий, якщо виробничі втрати водню складають 10% (за об’ємом ).
Вуглеводи
- Наведіть приклади хімічних реакцій, які підтверджують, що глюкоза – речовина, що має двоїсті хімічні властивості.
- Здійсніть перетворення:
![]()
![]()
![]() сахароза глюкоза етанол хлоретан.
сахароза глюкоза етанол хлоретан.
- Обчисліть масову частку сахарози в розчині, виготовленому з 5г сахарози і 145мл води.
- Знайдіть кількість крохмалю, яка потрібна для одержання 230г етанолу. Який об’єм вуглекислого газу при цьому виділиться?
- Яку масу глюкози потрібно піддати бродінню, щоб отримати 200кг етилового спирту, вихід якого – 90%.
- При кислотному гідролізі тирси, масова частка целюлози в якій становить 60%, було добуто 115г глюкози. Яка масова частка виходу глюкози?
- Скільки грамів глюкози можна добути при фотосинтезі, якщо в реакцію вступає 112л карбон (ІV) оксиду?
- Визначте масові частки елементів, що входять до складу спирту, який утворюється при окисненні глюкози.
- Визначте масу арґентум (І) оксиду, що містить 5% домішок необхідного для окиснення 0,5 моль глюкози до глюконової кислоти.
- Визначте масу розчину нітратної кислоти з масовою часткою НNО3 99%, необхідної для отримання 25кг тринітроклітковини.
- Масова частка крохмалю в картоплі становить 20%. Визначте масу глюкози, яку можна отримати при переробці 150кг картоплі. Вихід глюкози складає 75%.
- Визначте масу етанолу (кг) , який можна отримати з 1т пшениці, яка містить 70% крохмалю, коли витрати виробництва етанолу становлять 15%.
- Визначте вихід (%) етанолу від теоретично можливого, якщо відомо, що з 1т картоплі, яка містить 20% (за масою) крохмалю, отримано 120л 96%-го (за масою) розчину етилового спирту.
- Масова частка целюлози в деревині 50%. Яку масу спирту можна добути з глюкози, яка утворюється при гідролізі деревних ошурок масою 810кг? Вихід етанолу становить 70%, а спирт виділяється у вигляді розчину з масовою часткою води 8%.
- Яку масу кукурудзяних зерен потрібно взяти для добування спирту масою 115кг з масовою часткою етанолу 96%, якщо вихід спирту становить 80%? Масова частка крохмалю в кукурудзяних зернах становить 70%.
Нітрогеновмісні органічні сполуки
- Складіть структурні формули амінокислот складу С4Н9NО2 та вкажіть їхні назви за міжнародною номенклатурою.
- Здійсніть перетворення:
![]()
![]()
![]()
![]()
![]() СН4t0Х1t0Х2+НNO3,Н2SO4Х3+Н2,Ni Х4бромна вода Х5.
СН4t0Х1t0Х2+НNO3,Н2SO4Х3+Н2,Ni Х4бромна вода Х5.
Напишіть рівняння відповідних реакцій. Визначте кінцевий продукт Х5.
- Як здійснити таке перетворення:
СН4 →С2Н2→С6Н6→С6Н5NO2→C6H5NH2?
Напишіть рівняння відповідних реакцій.
- Визначте в якій з речовин – амоніаку, метиламіні, аніліні чи амінооцтовій кислоті – масова частка Нітрогену більша.
- Внаслідок спалювання 0,93г органічної речовини утворилося 0,672л вуглекислого газу, 1,35г води і азот. Густина цієї речовини за повітрям становить 1,07. Визначити її склад і написати структурну формулу.
- При відновленні 61,5г нітробензену добули 44г аніліну. Визначте масову частку виходу аніліну.
- Обчисліть масу аніліну , яка утворюється з 503г нітробензолу і 24г водню.
- Обчисліть молярну масу лізину, якщо відомо, що в молекулі лізину міститься два атоми Нітрогену, а масова частка Нітрогену становить 19,7%.
- При відновленні 12,3г нітробензену отримано 8,5г аніліну. Визначте, скільки відсотків це становить від теоретичного можливого виходу.
- Визначте об’єм бромної води з масовою часткою бром 3% (густина 1,02г/см3), необхідної для одержання 66г триброманіліну.
- При спалюванні 0,93г газоподібної органічної речовини утворився карбон (ІV) оксиду об’ємом 672мл (н.у.), вода масою 1,35г та азот. Відносна густина речовини за воднем 15,5. Установіть формулу речовини.
- Масові частки карбону, Нітрогену і Гідрогену в первинному аміні становлять відповідно 38,7%; 45,15%; 15,15%. Визначте формулу аміну.
- Первинний алкіламін масою 15,5г може нейтралізувати 500г 8,1%-го розчину бромідної кислоти. Установіть формулу аміну.
- Визначте формулу амінокислоти, 10г якої можуть прореагувати з 18г 25%-го розчину натрій гідроксиду.
- Для повного гідролізу дипептиду масою 24г використано 2,7г води. Установіть структуру дипептиду, якщо відомо, що при гідролізі утворилась тільки одна амінокислота.
Синтетичні високомолекулярні органічні
сполуки і матеріали на їх основі
- Напишіть схему полімеризації сполуки ССlF=CF2
-
 Склад полівінілацетату (основний компонент клею ПВА) відповідає формулі (- СН2 – СН - )n,
Склад полівінілацетату (основний компонент клею ПВА) відповідає формулі (- СН2 – СН - )n,
Х
де Х – група СН3СОО - . Напишіть схему реакції полімеризації з утворенням цього полімеру.
- Обчисліть масові частки лементів у полівінілхлориді.
- Напишіть схему реакції полімеризації бута – 1,3 –дієну.
- Обчисліть масову частку Хлору в хлоропреновому каучуку.
- З полівінілового спирту виготовляють нитки для зшивання ран. Добувають полівініловий спирт з похідних вінілового спирту СН2= СНОН. Скласти рівняння реакції добування полівінілового спирту і зазначити тип хімічної реакції.
- Скласти рівняння реакції добування поліефірного волокна найлон з адипінової кислоти НООС – (СН2)4 – СООН та гексаметилендіаміну Н2N – (CH2)6–NH2. До якого типу реакцій вона належить?
- Силікони – термостійкі полімери, які мають високі діелектричні властивості, водонепроникні. Добувають їх реакцією поліконденсації, наприклад, діетилсиландіолу (С2Н5)2Si(ОН)2. Скласти рівняння реакції поліконденсації цієї речовини.
- Співполімеризацією бута – 1,3 – дієну і нітрилу акрилової кислоти СН2=СН – С≡N добувають бутадієн – вітрильний каучук, стійкий до розчинників бензину, часу та інших вуглеводнів. Скласти рівняння реакції співполімеризації і навести структурні формули цього каучуку.
- Хлоркаучуки добувають співполімеризацією речовин:
СН2 = СНСl +СН2 = ССl2. Скласти рівняння реакції, назвати речовини.
- Бутилкаучук – сополімер ізобутилену і невеликої кількості ізопрену – відрізняється високою стійкістю по відношенню до кисню повітря, світла, озону, кислот. Скласти рівняння співполімеризації.
- Для виробництва пінопласту використано 300г полімеру, об’єм якого складає 200мл. Після нагрівання полімеру, спінювання його карбон (ІV) оксидом та охолодження до кімнатної температури був отриманий пінопласт об’ємом 2м3. Яку масу має отриманий пінопласт?
- Полімеризацією тетрафторетилену СF2 = CF2добувають політетрафторетилен (тефлон) – полімер, який має високу термічну стійкість надзвичайно високу хімічну стійкість. Напишіть схему реакції полімеризації. Зазначте структурну ланку полімеру.
- Волокно «Анід» добувають поліконденсацією гексамилендіаміNH2- (CH2)6–NH2 і адипінової кислоти
НООС – (СН2)4– СООН. Складіть рівняння реакції поліконденсації. Яка маса вихідних речовин необхідна для добування поліконденсату масою 5т, якщо виробничі витрати становлять 5%.
- Скільки бутадієну можна добути з етилового спирту, взятого:
а)масою 184кг;
б) кількістю речовини 8 моль?
Вихід продукту становить 96% від теоретично можливого.
Взаємоперетворення органічних речовин.
Органічні сполуки в житті людини і суспільства
- Напишіть рівняння реакції гідратації вуглеводню, назва якого – бут – 2 – ен.
- Напишіть рівняння реакцій таких перетворень:
![]()
![]()
![]() а) алкан алкен алкін арен;
а) алкан алкен алкін арен;
![]()
![]()
![]() б) спирт альдегід кислоти естер;
б) спирт альдегід кислоти естер;
в) амінокислота→дипептид;
г) дисахарид →моносахарид→ спирт;
д) полімер→мономер;
е) мономер → полімер (каучук).
3. Здійснити перетворення:
![]()
![]()
![]()
![]()
![]() а) С2Н2 С6Н6 С6Н5NO2 C6H5NH2 C6H5NH3Cl C6H5NH2
а) С2Н2 С6Н6 С6Н5NO2 C6H5NH2 C6H5NH3Cl C6H5NH2
![]()
![]()
![]()
![]()
![]() б) С2Н6 С2Н5Сl C2H5OH CH3CHO CH3COOH (CH3COO)2Mg
б) С2Н6 С2Н5Сl C2H5OH CH3CHO CH3COOH (CH3COO)2Mg
![]()
![]() О
О
![]()
![]()
![]()
![]()
![]()
![]() в) СН4 СН3Вr СН3ОН НСНО НСООН Н – С
в) СН4 СН3Вr СН3ОН НСНО НСООН Н – С
О – СН3;
4.Ідентифікувати всі невідомі речовини в схемах. Назвати. Написати рівняння реакцій.
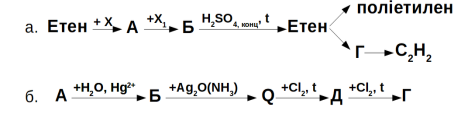
5. Здійснити перетворення:
![]() CO2 →CaCO3→CaCl2→Са(NO3)2
CO2 →CaCO3→CaCl2→Са(NO3)2
![]() СН4 →СН3ОН→СН3ОNа
СН4 →СН3ОН→СН3ОNа
C2H2→Х→ С2Н6О
6. Виведіть формулу одноосновної насиченої карбонової кислоти, якщо масова частка Гідрогену в ній 8,1%.
7. Обчисліть відносну молекулярну масу вітаміну В2, якщо його молекула містить чотири атоми Нітрогену, а масова частка цього елемента у вітаміні становить 14,9%.
8. При спалюванні 2,3г органічної речовини утворилось 7,7г карбон (ІV) оксиду і 1,8г води. Відносна густина пари цієї речовини за вуглекислим газом 2,09. Встановіть молекулярну формулу речовини.
9. Внаслідок взаємодії Натрію з 0,46г насиченого одноатомного спирту виділяється 112мл водню. Визначте формулу спирту.
10. Визначити формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу:
W(C) = 92,3%, W(Н) = 7,7%. Відносна густина пари цієї речовина за воднем 13.
- Який об’єм природного газу, що містить 95% метану, потрібно для добування 1м3 ацетилену, якщо вихід продукту становить 40%?
- Яку масу етилового ефіру оцтової кислоти можна добути з 120г етанової кислоти і 92г спирту, якщо масова частка виходу ефіру становить 90% від теоретичного можливого?
- Яку масу етилового спирту можна добути з 448мл етилену прямою гідратацією, якщо вихід продукції становить 90% від теоретично можливого.
- При спалюванні 12г невідомого вуглеводню утворилося 16,8г (н.у.) вуглекислого газу і 27г води. 1лвуглеводню має масу 0,714г (н.у.). Встановіть формулу.
- Скільки етилового спирту можна одержати з 1т пшениці, масова частка крохмалю в якій становить 70%, якщо масова частка витрат при виробництві – 15%?
- Внаслідок окиснення спирту утворюється насичена одноосновна карбонова кислота. Для нейтралізації 22г її витрачено розчин їдкого калію об’ємом 52,4мл (масова частка) КОН 20%, густина 1,18г/см3. Визначити, яка карбонова кислота утворюється і який спирт окислюється. Написати їхні структурні формули, зазначити можливі ізомери (чотири) і назвати їх за міжнародною номенклатурою.
Список використаних джерел
1. Данильченко В.Є., Фрадіна Н.В. Хімія 10-11 клас. Навчальний посібник. Харків 2004. – 220с.
2. Мальченко Г., Каретникова О. Я готуюсь до уроку хімії. 10-й клас. Випуск 2 - К. Редакції загально педагогічних газет, 2004. – 128с.
3. Столяр О., Барановський В., Горбовий П. Збірник задач і вправ з органічної хімії для учнів 10-11 класів. Тернопіль . Підручники і посібники. 2001. – 80с.
4. Ярошенко О.Г., Новицька В.І., Клубань Л.О., Лікарчук А.М., Титаренко Н. В. Завдання для тестової перевірки знань, умінь і навичок випускників загальноосвітніх шкіл, ліцеїв та гімназій. – К ІСДО, 1995. – 88с.
5. Ярошенко О.Г., Новицька В.І. Збірник задач і впарв з хімії. Київ. Партнер. 1997 – 160с.
1
-
дякую!
-
Дякую
-


про публікацію авторської розробки
Додати розробку