Урок "Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання"
Міністерство освіти і науки України
Вінницький технічний коледж
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
до проведення відкритого заняття з хімії
на тему «Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання»
Розглянуто і схвалено на засіданні циклової комісії природничо-математичних дисциплін та інформатики
Протокол №___ від ________
Голова циклової комісії
________ Овчар І.М.
Укладач: Вітюк О.І.
Вінниця – 2014
Зміст
Зміст…………………………………………………………………………………
Вступ………………………………………………………………………………...
1.Технологічна карта заняття……………………………………………………...
2. Методика проведення заняття…………………………………………………..
3. Хід заняття……………………………………………………………………….
І. Організаційний момент………………………………………………………..
ІІ. Актуалізація опорних знань……………………………………………………
ІІІ. Мотивація навчальної діяльності……………………………………………
ІV. Вивчення нового матеріалу заняття
V. Узагальнення та систематизація знань.
VІ. Підбиття підсумків заняття.
VІІ. Оголошення домашнього завдання.
Додатки……………………………………………………………………………...
Висновки…………………………………………………………………………...
Література…………………………………………………………………………
Вступ
Одне з основних завдань процесу навчання у коледжах нині полягає в тому, щоб підготувати майбутнього фахівця до професійного саморозвитку та самовдосконалення, сформувати інтерес до постійного поповнення та оновлення знань, розвивати творчі здібності, формувати професійну компетентність та компетенції, тобто готувати фахівців високого ґатунку, які б відповідали потребам суспільства.
Сучасні наука і виробництво потребують не тільки глибоких знань з дисципліни «Хімії», а й сформованого інноваційного мислення.
Тому потрібна зміна стратегічних, глобальних цілей освіти, перенесення акценту зі знань, умінь і навичок фахівця на його людські якості, котрі одночасно є метою і засобом його підготовки до майбутньої професійної діяльності як процесу, що триває впродовж усього життя людини.
Зміст дисципліни «Хімія» має зберігати фундаментальну компоненту, оскільки саме принцип фундаменталізації забезпечує цілісність навчального процесу. Фундаментальні знання з хімії є основою для виробничої практики молодших спеціалістів, оскільки викликають і стимулюють пізнавальну діяльність.
На заняттях з неорганічної хімії особливу увагу молодших спеціалістів звертаємо на формування знань, необхідних для обґрунтованого пояснення причинно-наслідкових зв’язків досліджуваних хімічних процесів і явищ, пізнання законів реальної дійсності.
Важливе значення в курсі неорганічної хімії займеє тема: «Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання».
Металічні елементи та їх сплави використовуються як хороші провідники електрики (мідь, алюміній), так і в якості матеріалів з підвищеним опором, котрі працюють за високих температур: для виготовлення резисторів, реостатів та електронагрівальних елементів (ніхром і інші)
2.Метали і їх сплави широко застосовуються для виготовлення інструментів (їх робочої частини). В основному це інструментальні сталі і тверді сплави.
3.Також метали використовують:
-суднобудуванні,
-залізничному транспорті,
-автомобільному транспорті,
-авіації,
-будівництв.
Дисципліна: Хімія
Тема:Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання
Мета: зазначена в сценарії
Тип заняття: засвоєння нових знань (лекція)
Група: 1ЕА2
Викладач: Вітюк О.І., викладач другої категорії
Дата:
Студенти повинні знати:
- Розташування металічних елементів в ПСХЕ
- Особливості будови атомів металічних елементів
- Будову кристалічної гратки металів
- Утворення металічного зв’язку
- Загальні фізичні властивості металів
- У якому вигляді металічні елементи зустрічаються в природі.
- Хімічні властивості металів.
- Методи добування та використання металів.
- Поняття про корозію металів та види її.
Вміти:
- Складати схеми будови атомів металів і визначати особливості їх будови.
- Пов’язувати будову металів з їхніми фізичними властивостями.
- Складати рівняння окисно – відновних реакцій і реакцій йонного обміну на прикладі хімічних властивостей металів.
- Розв'язувати задачі.
Технологічна карта заняття
|
№ |
Етап заняття |
Дидактичне завдання етапу |
|
1 |
Організаційний |
Підготувати студентів до роботи, на позитивне сприйняття матеріалу |
|
2 |
Перевірка домашнього завдання |
Встановити правильність і усвідомленість виконання студентами домашнього завдання, фронтальне опитування |
|
3 |
Підготовка студентів до активного й усвідомленого засвоєння змісту навчального матеріалу |
Організувати і спрямувати навчально-пізнавальну діяльність студентів до досягнення основної мети (мотивація, актуалізація опорних знань, вивчення нового матеріалу). Активізація навчально-пізнавальної діяльності студентів шляхом евристичної фронтальної бесіди, демонстраційного експерименту, лабораторного досліду, використання елементів ділової гри. |
|
4 |
Засвоєння нового матеріалу |
Розглянути загальні питання лекції: місце металічних елементів у періодичній системі та особливості будови їхніх атомів;вивчити новий металічний тип хімічного звязку;ознайомиться із загальними фізичними та хімічними властивостями металів; методами добування та використання металів;поняття про корозію металів та види її. Формувати відповідні уміння та практичні навички виконання лабораторних дослідів по вивченню хімічних властивостей металів та написання хімічних рівнянь реакцій
|
|
|
Перевірка та корекція засвоєння навчального матеріалу |
З'ясувати здатність та правильність розв’язування розрахункових задач та написання студентами хімічних рівнянь реакцій, формувати вміння студентів працювати у групах. |
|
5 |
Підведення підсумків заняття |
Узагальнити та закріпити засвоєнні знання шляхом тестової перевірки знань студентів про загальні властивості металів та оцінити рівень засвоєння навчального матеріалу |
|
|
Інформація про домашнє завдання, інструктаж про його виконання |
Повідомити зміст домашнього завдання, пояснити методику його виконання. Звернути увагу студентів на виконання ланцюга перетворень та на розрахункову задачу, з'ясувати певні труднощі у процесі виконання |
Хід заняття
Дисципліна:Хімія
Викладач: Вітюк О.І., викладач другої категорії
Група: 1ЕА2
Тема:Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання
Мета:
Навчальна: поглибити знання студентів про металічні елементи, їх положення в періодичній системі, про загальні фізичні властивості металів, особливості будови атомів, будови речовин. Розширити уявлення щодо видів хімічного зв’язку введенням поняття про металічний хімічний зв’язок; показати вплив зв’язку на фізичні властивості речовин, утворених металічними елементами. Ознайомити із сполуками металічних елементів у природі, із загальними хімічними властивостями металів, рядом активності металів; показати взаємозв’язок хімічних властивостей металів з будовою їх атомів; розглянути явище корозії та методи захисту металів від корозії, продовжувати формувати інформаційну та професійну компетентність студентів.
Розвиваюча: розвивати вміння аналізувати, порівнювати, узагальнювати та робити висновки на підставі добутих знань;прищеплювати навички пошукової роботи, складання рівнянь окисно – відновних реакцій і реакцій йонного обміну на прикладі хімічних властивостей металів.Сприяти формуванню інформаційної та професійної компетентності студентів.
Виховна: виховувати бережливе ставлення до навколишнього середовища та раціонального використання металів, формувати професійні інтереси, виховувати відповідальне ставлення до обраної професії.
Тип заняття: лекція
Форми та методи роботи: навчальна лекція, евристична фронтальна бесіда, мозковий штурм,тестова перевірка знань, групова робота, демонстраційний експеримент, лабораторний дослід, ділова гра.
Міжпредметні зв’язки: біологія, географія, фізика.
Обладнання та реактиви: ПСХЕ, ряд активності металів, колекція металів та їх сплавів, модель металевої кристалічної гратки , використання ТЗН, компютера, проектора,інструкція, пробірки, хімічний посуд, розчини хлоридної кислоти (HCl), магній (Mg ), мідь (Cu ), розчини купрум сульфату (CuSO4), літій хлориду(LiCL), барій хлоридуBaCL2.
Основні поняття та терміни: електроліз, металічні елементи, металеве покриття.
Методика проведення заняття
Тема «Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання» є важливою в курсі неорганічної хімії.
У процесі вивченн данної теми необхідно розглянути такі питання як: розташування металів в періодичній системі елементів; будову атома їх атомів; загальні фізичні та хімічні властивості металів; добування та використання їх у своїй професійній діяльності; поняття про сплави та корозію металів.
Студенти повинні зрозуміти, що металів більше ніж неметалів, вони відіграють важливу роль в природі і в майбутній професійній діяльності людини.
Для того щоб визначити зв'язок між властивостями металів і будовою їх атомів, необхідно починати вивчення теми з короткої характеристики положення металів в періодичній системі і вияснити структурні особливості їх атомів. При цьому слід звернути увагу, що метали знаходяться на початку періодів, число валентних електронів у них невелике, атомні радіуси їх невеликі порівняно з неметалами, що знаходяться в одному ряді періодичної системи.
Важливе значення для характеристики металів набуває уявлення про особливості будови їх кристалів. Оскільки різні метали мають подібні металічні зв’язки, а в ряді випадків утворюють подібні металічні кристали, то багато з них при переході в розплавлений стан можуть змішуватися один з одним, утворюючи сплави.
Характеризуючи загальні фізичні властивості металів(електропровідність, теплопровідність, блиск, ковкість, пластичність) доцільно виявити зв’язок їх з структурою металів.
Розглядаючи температури плавлення і кипіння металів, слід вказати на досить високу різницю їх.
Використовуючи набуті студентами знання про метали, викладач нагадує
будову атомів металів і реакції взаємодії металів з галогенами, з оксигеном, з сіркою і робить висновок, що атоми металів легко віддають електрони атомам неметалів.
У процесі вивчення хімічних властивостей металів необхідно, що студенти виконали демонстрацію досліду взаємодії металів з водою, кислотами, солями.
Важливого значення набуває пояснення процесу електролізу добування металів.
Розв'язання розрахункових задач на визначення хімічного елемента
Використання металів та їх сплавів рекомендується провести після розгляду загальних хімічних властивостей металів, оскільки утворення сплавів – це фізико-хімічний процес, для розуміння якого необхідні знання хімічних властивостей металів. Доцільно акцентувати увагу студентів, де в їх спеціальності використовуються метали та їх сплави.
Питання «Корозія металів. Види корозії» пропонуємо розглядати у вигляді ділової гри, зупиняючись на різних станціях.
У народі кажуть «Іржа їсть залізо, а горе – серце» Як видумаєте , про який хімічний процес іде мова в першій половині приказки? Мова про корозію. Ми розглянемо явище корозії металів та методів захисту від неї. Вирушимо в подорож і побуваємо на різних станціях: «Корозійна» , «Історична» «Економічна», «Технолого-експерементальна». (Повідомлення студентів)
Хід заняття
І. Організаційний момент.
Позитивна установа на роботу. Привітання, перевірка присутніх.
ІІ. Актуалізація опорних знань студентів.
1.Що особливого в будові атомів неметалів?
2.Які ви вивчили неметали?
3.Назвіть оксиди та сполуки неметалів.
ІІІ. Мотивація навчальної діяльності.
Метали мають широке застосування у техніці, побуті, будівництві. Але для того щоб якнайдоцільніше використовувати метали та матеріали, виготовлені на їх основі, потрібно знати природу цих елементів, їх будову та властивості.
Повідомлення теми, мети й завдань заняття.
Тема нашого заняття«Загальна характеристика металічних елементів,будова їх атомів, властивості, способи їх добування та використання».Ця тема є дуже важливою, оскільки людина здавна використовує метали та їх сплави у своєму житті.
Мета нашого заняття(слайд 2)
- Розглянути місце металічних елементів у періодичній системі та особливості будови їхніх атомів;
- Вивчити новий металічний тип хімічного звязку;
- Ознайомиться із загальними фізичними та хімічними властивостями металів;
- Методами добування та використання металів;
- Поняття про корозію металів та види її.
ІV. Вивчення нового матеріалу.
Лекція з елементами бесіди
Перегляд відео "Історія відкриття металів та їх класифікація"
1.Загальна характеристика металів(4 слайд)
- Де в періодичній системі Д.І.Менделєєва розташовані елементи-метали?
- Пошукова діяльність студентів.
Робота студентів з таблицею Періодичної системи Менделєєва.
Елементи метали розташовані на початку періодів (виняток 1 період).Всі елементи побічних підгруп відносяться до металічних.Непарні ряди великих періодів утворені лише з металічних елементів.Хімічні елементи-метали розташовані переважно в лівій нижній частині ПСХЕ.
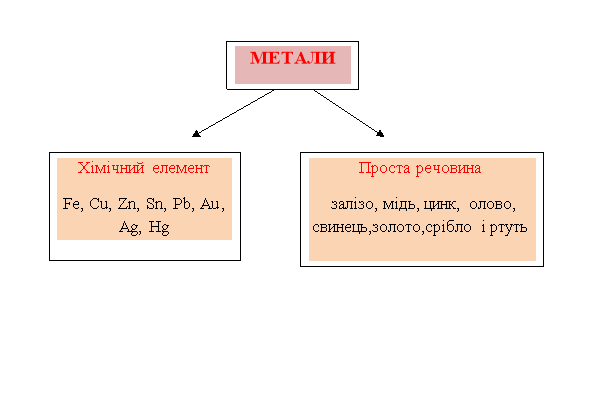
2.Метали як хімічні елементи та як прості речовини.(5 слайд)
Існують хімічні елементи яким у природі відповідають прості речовини.
- Що називаеться хімічним елементом? (Хімічний елемент – вид атомів з певним зарядом ядра).
- Які речовини називають простими? (Речовини які містять атоми одного хімічного елемента.
- Наведіть приклади хімічних елементів-металів та відповідних простих речовин металів.
-
Ознайомлення студентів зі зразками металів.
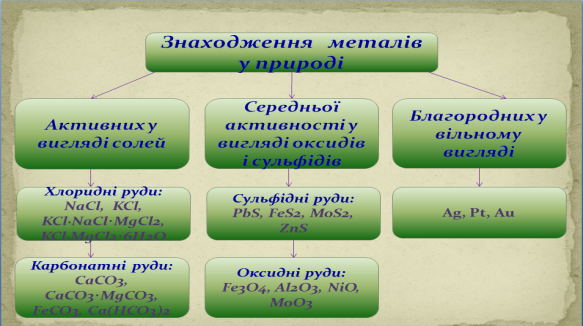
Переважно метали знаходяться у природі у вигляді руд.
Цікаві факти про метали(повідомлення студентів).Знаходження металів в організмі людини.
3.Будова атомів металів
- Запишіть електронні конфігурації атомів кількох металів. Знайдіть, що є спільного?
11Na1S22S22P63S1; 12Mg 1S22S22P63S2; 13Al 1S22S22P63S23Р1.
На зовнішньому енергетичному рівні знаходиться невелике число електронів (звичайно 1 – 3).
Радіуси атомів металів великі, порівняно з радіусами атомів неметалів того ж періоду.
- Метали мають невелику електронегативність, тому легко віддають валентні електрони, таким чином виявляють відновні властивості.
Na – 1e- → Na+ (11Na+1S22S22P63S1)
Mg – 2e- → Mg2+ (12Mg 1S22S22P63S2)
Які особливості будови атомів цих хімічних елементів ви помітили?
(відмінності: різна кількість електронів на зовнішньому рівні, кількість електронів невелика; загальне: передостанні енергетичні рівні мають однакову будову і є завершеними).
- Що відбувається з електронами останього шару металічних елементів під час перетворень? ( віддають електрони).
- Які властивості при цьому виявляють елементи-метали? (відновників).
Велика кількість елементів - металів пояснюється схожою будови зовнішнього енергетичного рівня (1-3 електрони) та їх здатністю віддавати електрони, виявляючи властивості відновників у хімічних реакціях.
Метали утворюють металічні кристалічні ґратки.
![]()
![]()
- • ← катіон Меn+
• ← електрон
![]()
![]() • ← атом Ме
• ← атом Ме
Електрони відокремлюються від своїх атомів і хаотично рухаються у речовині, утворюючи «електронний газ». Вони стають усуспільненими (делокалізованими).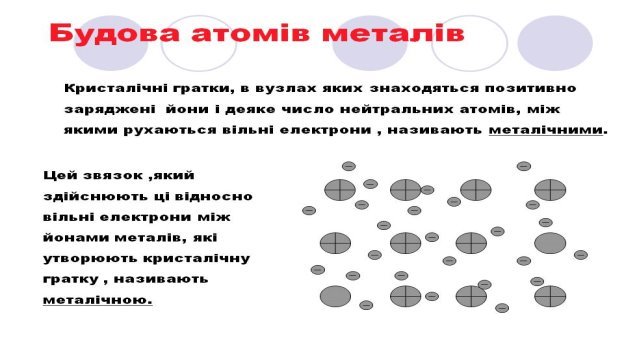
4.Фізичні властивості металів(6,7 слайд)
Специфічні фізичні властивості металів
- Металічний блиск.
Метали відбивають промені світла, а не пропускають їх, як скло, і не вбирають, як сажа. Срібло найкраще відбиває світло, тому має найбільший блиск (дзеркала, ялинкові іграшки).
У більшості металів сріблястий блиск, але у золота і цезію – жовтий, у міді – червоний.
- Висока електропровідність і теплопровідність.
При з’єднані металу з джерелом струму, вільні електрони починають направлено переміщатися, отже виникає електричний струм.
Чому на лініях електропередач на далекій відстані використовують алюміній, а не мідь?.
Чому при доторканні рукою до металічного предмета відчуваємо холод, а до дерев’яного – ні? (Тепло долоні швидко передається металу, він стає теплішим, а долоня холоднішає. Дерево погано проводить тепло, тому, торкаючись його рукою, ми не відчуваємо холоду).
Ця властивість металів зумовлена наявністю усуспільнених електронів, що можуть відносно вільно рухатися.
Ag, Cu, Au, Al, Mg, Zn, Fe, Pb……….
![]()
Електропровідність - і теплопровідність спадає
- Ковкість, пластичність.
Пластичність – здатність необоротно деформуватися під дією механічних навантажень. Пластичність обумовлена будовою металічної кристалічної ґратки .
Пластичність пояснюється утриманням шарів атомів і йонів вільними електронами які рухаються і під дією зовнішньої сили метали деформуються(витягуються у дріт, викатуються у фольгу), зберігаючи при цьому цілісність.
Золото – найеластичніший з металів. 1г золота можна витягнути у дріт завдовжки 2 км. Із шматочка величиною із сірникову головку можна отримати лист площею 50 м2, лист в 0,0001мм у 500 раз тонше за волосину.
Найбільш крихкі з металів – хром, манган, стибій.
Неспецифічні фізичні властивості металів
- Температура плавлення
![]()
![]() Метали
Метали
легкоплавкі тугоплавкі
tпл < 1000° С tпл > 1000° С
лужні, лужноземельні метали, Cu, Fe, Cr, Ti, Mo….
Mg, Al, Pb, Sn, Zn…… tплW ~3400°С
tплHg = - 38,87°С
- Твердість
Метали
![]()
![]()
м’які тверді
лужні метали, хром, вольфрам
свинець.
- Густина
Метали
![]()
![]()
Легкі Важкі
ρ < 5 г/см3 ρ> 5 г/см3
літій,натрій, магній, осмій, цинк, залізо, свинець,
алюміній ртуть, золото
Повідомлення студентів про найтвердіши, найпластіші, найкрихкіши, найважчиши, найлегчіши, найелктропровідніши, найтеплопровідніші метали.
- Агрегатний стан (тверді, за винятком ртуті)
- Колір: усі відтінки від сірого до чорного (виняток мідь та золото)
- Тепло-й електропровідність ( за рахунок вільних електронів)
Найменша теплопровідність у ртуті, найбільша у срібла, міді, золота, алюмінію.
Найбільша електропровідність у срібла, міді, алюмінію
Hg, Pb, Fe, Zn, Mg, AI, Au, Cu, Ag
→ збільшуеться
- Ковкість і пластичність (найбільш пластичний золото, крихкий хром, манган, стибій у них 5-7 електронів на останьому рівні)
- Густина: легкі (літій р=0,53г/см3)
Важки (осьмій р=22,48 г/см3)
- Твердість: м’які (лужні метали)
тверді (хром)
- Температура плавлення:
Легкоплавкі –цезій (280С)
Тугоплавкі – вольфрам (33700С)
Які типи хімічних зв’язків ви знаєте?
- Як у металах з’являються вільні електрони і які сили утримують атоми металу в простій речовині? (особливий тип зв’язку – металічний)
Розповідь викладача (слайд )
Які типи хімічних зв’язків ви знаєте?
- Як у металах з’являються вільні електрони і які сили утримують атоми металу в простій речовині? (особливий тип зв’язку – металічний)
- Металічний зв'язок(8 слайд)
Утворення металічного зв’язку:
- Атоми металу втрачають електрони (один або кілька) і перетворюються на позитивно заряджені йони.
- Втрачені атомом електрони вільно переміщаються по всьому об’єму металічного тіла, то приєднуючись до йонів, то відриваючись від них, і спільно втримують усі позитивні йони.
- Йони розміщуються шарами в певному порядку один відносно одного, утворюючи певний тип кристалічної гратки.
Особливістю будови металів є утворення кристалічної гратки.В основі кристалічної гратки знаходяться іони,атоми і вільні електрони.
Ме0 – 1 ̅е →Ме+
Ме+ + 1 ̅е →Ме0
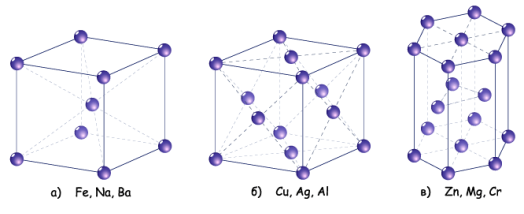
Кристалічні гратки металів бувають різних типів (слайд 7) : а)кубічна гранецентрована (алюміній, мідь, срібло, золото); б) гексагональна берилій, магній, цинк); в) кубічна об’ємоцентрована (лужні, лужноземельні, залізо)
6. Хімічні властивості металів(9 слайд)
1. Метали взаємодіють з неметалами (Ме + неМе)
![]()
![]()
![]() 4е
4е
2Са° + О2° = 2Са+2О-2
![]()
![]()
![]() 2e
2e
2Na° + Cl2 = 2Na+1Cl-1
![]() 2.Взаємодія металів з водоюМе + Н2О
2.Взаємодія металів з водоюМе + Н2О
- Лужні і лужноземельні метали за н.у. утворюють луг і водень:
2Na + 2H2O = 2NaOH + H2
Демонстрація досліду.
- Інші метали, що стоять в ряду активності до Гідрогену, за високої температури утворюють з водою оксид і водень:
Mn + H2O = MnO + H2
- Mетали, що стоять в ряду активності після Гідрогену, з водою не реагують:
Cu +H2O =
3.Взаємодія з кислотами Ме + кислота → сіль + Н2 (крім кислот сильних окисників).Метали, що стоять в ряду активності до Гідрогену, реагують з кислотами - слабкими окисниками, утворюючи сіль і водень. Метали, що стоять в ряду активності після Гідрогену, з цими кислотами не реагують:
![]()
![]()
![]() 2e
2e
Mg° + 2H+1Cl = Mg+2Cl2 + H2°
Cu + HCl =
З кислотами – сильними окисниками метали реагують незалежно від їх положення в ряду активності, при цьому відновлюється не водень,а кислотоутворюючий елемент:
Cu + 4HNO3 конц.= Cu(NO3)2 + 2NO2↑ + 2H2O
Демонстрація досліду.
4.Взаємодія металів з розчинами солей Ме + сіль →метал + сіль
Демонстрація досліду.
Fe + CuSO4 →FeSO4 +Cu
Cu + ZnCl2 →
Групова робота студентів. (Фізичні та хімічні властивості металів).
7. .Добування металів(10,11,12 слайд)


Розв'язати задачу
Лужний метал масою 10,92 г повністю прореагував з сіркою. Утворилася сіль масою 15,4 г. Обчисліть, який це метал? Напишіть формули його оксиду та гідроксиду.(К, К2О, КОН)
8. Використання металів (13,14 слайд)
- 1.Метали та сплави використовуються як хороші провідники електрики (мідь, алюміній), так і в якості матеріалів з підвищеним опором, котрі працюють за високих температур: для виготовлення резисторів, реостатів та електронагрівальних елементів (ніхром і інші)
- 2.Метали і їх сплави широко застосовуються для виготовлення інструментів (їх робочої частини). В основному це інструментальні сталі і тверді сплави.
- 3.Також метали використовують:
- -суднобудуванні,
- -залізничному транспорті,
- -автомобільному транспорті,
- -авіації,
- -будівництві…
Суднобудування
- Алюміній і сплави на його основі знаходять все більш широке застосування в суднобудуванні. З алюмінієвих сплавів виготовляють корпуси суден, палубні надбудови, комунікацію і різного роду суднове устаткування. Основна перевага при впровадженні алюмінію і його сплавів в порівнянні зі сталлю - зниження маси судів, яка може досягати 50 ... 60%. У результаті представляється можливість підвищити вантажопідйомність судна або поліпшити його тактико-технічні характеристики (маневреність, швидкість і т.д.).
Залізничний транспорт
- Основніхарактеристикиалюмініюійогосплавів, щорозкриваютьдоцільністьзастосуванняїхузалізничному транспорті, високапитомаміцність, невеликасилаінерції, корозійнастійкість. Впровадженняалюмінієвихсплавівпривиготовленнізварнихємностейпідвищуєїхдовговічністьприперевезеннірядупродуктівхімічноїтанафтохімічноїпромисловості. Алюміній і його сплави використовуються при виготовленні кузова і рами вагона.
Автомобільний транспорт
- Одним з основних вимог до матеріалів, що застосовуються в автомобільному транспорті, є мала маса і досить високі показники міцності. Беруться до уваги також корозійна стійкість і гарна декоративна поверхняматеріалу. Висока питома міцність алюмінієвих сплавів збільшує вантажопідйомність і зменшує експлуатаційні витрати пересувного транспорту. Висока корозійна стійкість матеріалу продовжує терміни експлуатації, розширює асортимент перевезених товарів, включаючи рідину і гази з високою агресивною концентрацією.
Авіація
- Через сильний аеродинамічного нагріву матеріал обшивки і окремі елементи нагріваються до дуже високої температури при надзвукових швидкостях до 153 С і при гіперзвукових - до 390 С. Останнім часом не без підстави віддають перевагу матеріалам середньої міцності при високих значеннях їх пластичності. При виборі матеріалу однієї з найважливіших експлуатаційних характеристик для польотних конструкцій є статистична витривалість і втомна міцність. Невисокі значення втомної міцності алюмінієвих сплавів - один з основних недоліків при використанні їх у деталях, підтверджених високим динамічним навантаженням. Матеріали, застосовувані в літакобудуванні, повинні також мати високі корозійними властивостями: при цьому контакт матеріалу з навколишнім середовищем (атмосферою) слід розглядати з урахуванням температурно-часового чинника. Надзвукова авіація, поряд із переліченими, висуває додаткові, більш жорсткі вимоги до матеріалів: працездатність при підвищених акустичних навантаженнях, повзучість і її вплив на зміну геометричних розмірів конструкції в процесі експлуатації (з урахуванням тривалості ресурсу), рівень температурних і втомних напружень, які виникають в конструкції при польоті на надзвукових швидкостях.
Будівництво
-
Перспективність застосування алюмінієвих сплавів в будівельних конструкціях підтверджується техніко-економічними розрахунками та багаторічної світовою практикою в області споруди різних будівельних об'єктів.
Впровадження алюмінієвих сплавів в будівництві зменшує металоємність, підвищує довговічність і надійність конструкцій при їх експлуатації в екстремальних умовах.
Алюмінева посуд
- Алюмінієвий посуд - найбільш поширена посуд в громадському харчуванні і на домашній кухні. Алюміній, як і чавун, є енергозберігаючим матеріалом. Але, на відміну від чавунної, алюмінієвий посуд є значно легшим - і це вагомий аргумент на її користь. А використання посуду з протипригарним покриттям вирішить для господині і багато інших проблем: їжа в цьому посуді не пригорає, вимагає мінімальну кількість жиру, посуд легко миється, використання дерев'яної лопатки забезпечує тривалий термін служби. Лита товстостінна алюмінієва посуд призначений для приготування других страв. Продукти в цьому посуді зберігають свій вітамінний склад і смакові якості. Алюмінієвий посуд легка, практична, зручна в експлуатації, має високу теплопровідність (нагрівається в 9 разів швидше, ніж посуд з нержавіючої сталі) і корозійною стійкістю. Краще алюмінію по теплопровідності тільки мідь. Але алюмінієвий посуд швидко стала дуже поширеною головним чином завдяки тому, чт про алюміній значно дешевше міді. Алюмінієвий посуд зазвичай тонкостінна, виготовлена методом штампування. Це також додає доступності алюмінієвому посуді для всіх категорій населення. Алюмінієвий посуд буває штампованої - з товщиною дна 1,5 мм (легка), 2 мм (середня) і 2,5 мм (важка).
8. Поняття про корозію. Види корозії.(15,16,17 слайд)
Проведення ділової гри.
У народі кажуть «Іржа їсть залізо, а горе – серце» Як видумаєте , про який хімічний процес іде мова в першій половині приказки? Мова про корозію. Ми розглянемо явище корозії металів та методів захисту від неї. Вирушимо в подорож і побуваємо на різних станціях. Перша станція «Корозійна» (Пояснення викладача). Корозія металів проходить під впливом кисню, води та вуглекислого газу, а також оксидів нітрогену. Наявність у навколишньому середовищі підвищених концентрацій вищеназваних оксидів, яке спричинене забрудненням атмосфери, прискорює цей процес.
Станція «Історична» (Повідомлення історика) Слово „корозія„ походить від латинського corrodere , що означає роз’їдати. Хоча корозію частіше всього пов’язують з металами, їй піддаються також каміння, пластмаси та інші полімерні матеріали.
Щоб боротися з іржею, необхідно знати, як вона утворюється. Нелегко було визначити стародавнім вченим причину руйнування металів. Влучно відображає відношення багатьох поколінь до корозії повна гіркоти фраза Плінія Старшого, який стверджував , що „іржавіння прокляттям лежить на залізі„.
У свій час Ломоносов висловив думку, що при прожарюванні метали сполучаються з повітрям, утворюючи окалину. Так з’явилася перша наукова теорія хімічної корозії. Електрохімічну корозію вивчали Деві, Фарадей. Теорія про корозію металів остаточно сформувалась у наш час. У найпростішому виді вона виглядає так: при стиканні з електролітом на поверхні металу виникають гальванічні елементи.
Станція «Економічна»(Повідомлення економіста)
Корозія металів завдає великої шкоди економіці. Людство несе великі матеріальні втрати в результаті корозії трубопроводів, деталей машин, суден, мостів, морських конструкцій і технологічного обладнання. Корозія призводить до зменшення надійності роботи апаратів високого тиску, лопатей і роторів турбін, деталей літаків і суден. Вона призводить до втрат сировини і продукції (втрата нафти, газів, води ), до енергетичних затрат, які викликані відкладенням іржі в трубопроводах . Спеціалісти підрахували, що вартість втрат, пов’язаних з корозією, складає 3 – 4 % валового національного доходу.
За наявними даними, близько 20% щорічного видобутку металу витрачається покриття безповоротних втрат внаслідок корозії і наступного розпорошення. Основний виміряти ціну корозії металу пов'язаний лише з втратою великих кількостей металу, але й пристрітом чи виходом із ладу самих металевих конструкцій, оскільки внаслідок корозії вона втрачає необхідної міцності, пластичність, герметичність, тепло- і електропровідність, отражательную здібність й інші необхідні якості. До втрат, які терпить господарство від корозії, слід віднести також величезні видатки різного роду захисні антикорозійні заходи, виміряти ціну погіршення якості своєї продукції, вихід із ладу устаткування, аварій у виробництві й таке інше.
Станція Технолого-експерементальна.
Методи захисту металів від корозії
Захисні покриття
Металеві покриття
За принципом захисної дії розрізняють анодні і катодні покриття. Анодні покриття мають у водному розчині електролітів більш негативний електрохімічний потенціал, ніж захищений метал, а катодні – позитивніший. Унаслідок зсуву потенціалу анодні покриття зменшують або повністю усувають корозію основного металу в порах покриття, тобто надають електрохімічний захист, тоді як катодні покриття можуть підсилювати корозію основного металу в порах, проте ними користуються, оскільки вони підвищують фізико-механічні властивості металу, наприклад зносостійкість, твердість. Але при цьому потрібна значно велика товщина покриттів, а у ряді випадків додатковий захист.
Металеві покриття розділяються також за способом їх отримання (електролітичне осадження, хімічне осадження, гаряче і холодне нанесення, термодифузійна обробка, металізація напиленням, плакірування).
Неметалічні покриття
Дані покриття отримують нанесенням на поверхню різних неметалічних матеріалів – лакофарбних, каучукових, пластмасових, керамічних і ін.
Найбільш поширенні лакофарбові покриття, які можна розділити за призначенням (атмосферостійкі, обмежено атмосферостійкі, водостійкі, спеціальні, маслобензостійкі, хімічно стійкі, термостійкі, електроізоляційні, консервації) і по складу плівкоутворювача (бітумні, епоксидні, кремнійорганічні, поліуретанові, пентафталеві і ін.)
Покриття, що отримуються хімічною і електрохімічною обробкою поверхні
Цими покриттями є плівки нерозчинних продуктів, що утворилися в результаті хімічної взаємодії металів із зовнішнім середовищем. Оскільки багато з них є пористими, вони застосовуються переважно як підшари під мастила і лакофарбові покриття, збільшуючи захисну здатність покриття на металі і забезпечуючи надійне зчеплення. Методи нанесення – оксидування, фосфатування, пасивування, анодування.
Питання по корозії
1.Поясніть, що таке корозія.(руйнування металів під дією факторів зовнішнього середовища)
2.Поясніть на прикладі заліза, до яких втрат призводить корозія( З доісторичних часів людство виплавило близько 20 млрд. т заліза. Із них корозія(іржа) «з’їла» 14 млрд. т)
3.Які види корозії ви знаєте за механізмом перебігу корозійних пошкоджень? (хімічну, електрохімічну)
4.Які ви знаєте способи захисту металів від корозії?( захисні покриття,зміна складу середовища, протекторний захист)
5.Чи існують метали,що здатні самі себе захистити від корозії? (Алюміній, цинк. На їх поверхні під дією повітря утворюється стійка захисна оксидна плівка)
6. Що означає термін «олов’яна чума»? У чому його суть ?(алотропія олова, зміна кристалічної структури металу за низьких температур)
V. Узагальненна та систематизація знань.
Підбиття підсумків заняття.
Узагальнюючи заняття можна зробити таки висновки :
- Металами називають хімічні елементи та прості речовини
- Хімічні елементи-метали розташовані переважно в лівій нижній частині ПСХЕ
- В електронній оболонці атомів металів на зовнішньому електронному рівні знаходяться невелика кількість електронів (від одного до трьох), які можуть легко відаватися атомами.
Домашнє завдання
- Лужний метал масою 4,6 г спалили в атмосфері кисню. Утворився оксид масою 6,2 г. Обчисліть, який це метал. Напишіть формули його оксиду та гідроксиду.
- Напишіть рівняння реакцій, що лежать в основі схем:
а) Fe→FeO→FeCI2→Fe(OH)2→FeSO4;
+O2
![]()
![]() оксиди
оксиди
+ Hal
![]()
![]() галогеніди
галогеніди
+S
![]()
![]() сульфіди
сульфіди
Ме + N2
![]()

![]()
 нітриди
нітриди
+C
![]() карбіди
карбіди
+P
![]() фосфіди
фосфіди
![]() +H2
+H2
Гідриди
Задача 3
Розклали карбонат двовалентного металу масою 12,5 г. Виділився газ об'ємом 2,8 л (н.у.). Обчисліть та вкажіть, карбонат якого металу розклали.Обчисліть відносну молекулярну масу карбонату.
Задача 4
Купрум(ІІ) нітрат за нагрівання розклався на купрум(ІІ) оксид, нітроген(ІV) оксидта кисень. Обчисліть масу купрум(ІІ) оксиду та об'єми газів (н.у.), що утворяться, якщо розклали сіль масою 18,8 г.
Задача 5
На хлорид двовалентного металу масою 9,5 г подіяли надлишком натрій гідроксиду. Випав осад масою 5,8 г. Обчисліть та вкажіть, хлорид якого металу прореагував. Напишіть його формулу та обчисліть відносну молекулярну масу.
Задача 6
Натрій оксид масою 18,6 г повністю розчинили у воді. Через отриманий розчин пропустили карбон(ІV) оксид до утворення натрій карбонату. Обчисліть об'єм та кількість речовини карбон(ІV) оксиду (н.у.), що витратився.
Тестові завдання "Загальна характеристика металів"
Варіант 1
1.До металів належать:
А) Калій; В)Манган;
Б) Гелій; Г)Карбон.
2.Позначте благородні метали:
А) золото і платина; В)магній та кальцій;
Б) залізо і хром; Г)мідь та алюміній.
3.Дляметалів характерний тип звязку:
А) ковалентний не полярний; В)ковалентний полярний;
Б) йонний; Г)металічний.
4.Найбільш тугоплавкий метал:
А) алюміній; В)вольфрам;
Б) мідь; Г)молібден.
5.В електротехніці використовують такі фізичні властивості мідіта алюмінію:
А)теплопровідність; В)ковкість;
Б) легкість; Г)електропровідність.
6. Серед перелічених металів найменш активним є:
А) Ртуть; В) свинець;
Б) Магній; Г) мідь.
7. У хімічних перетвореннях усі метали у вільному стані:
А) є тільки окисниками; В) можуть бути окисниками або відновниками;
Б)не беруть участі в окисно-відновних реакціях; Г) є тільки відновниками.
8. Який з перелічених металів взаємодіє з NaOH:
А) магній; В) хром;
Б) кальцій; Г) цинк.
9. Для одержання металів високого ступеня чистоти використовують:
А) пірометалургію; В) порошкову металургію;
Б) електроліз; Г) осадження важкорожчинних сполук металів.
10. Виберіть твердження щодо реакції металів на дію навколишнього середовища:
А) ролзкладаються; В) підлягають ерозії;
Б) кородують; Г) електролізують.
11. Галузь промисловості, що одержує метали з руд, називається:
А) алюмотермією; В) металургією;
Б) металотермією; Г) магнійтермією.
12. Установіть відповідність металічного елемента властивостям його сполуки.
Металічний елемент Властивості сполуки
1 Калій А Гідроксид належить до лугів;
2 Купрум Б сполуки з валентністю металу ІІ в
розчинах
3 Кальцій блакитного забарвлення;
4 Алюміній В активно реагує з водою за кімнатної
температури;
Г оксид дуже енергійно взаємодіє з
водою;
Д оксид має кислотні властивості
Тестові завдання "Загальна характеристика металів"
Варіант 2
1.До металів належать:
А Купрум, Аргентум, Ферум; В Алюміній, Силіцій, Плюмбум;
Б Натрій, Магній, Сульфур; Г Нітроген, Фосфор, Хлор.
2. Визначте процес, за допомогою якого метали частіше добувають із руд:
А топлення; В відновлення;
Б лиття; Г. окиснення.
3. Визначте важкий метал, який застосовується для виготовлення фарби, куль, в акумуляторах:
А олово; В свинець;
Б мідь; Г цинк.
4. Якщо відновлювати карбон(ІІ) оксидом концентрат магнітного залізняку Fe3О4 масою 58 кг, то можна добути залізо масою:
А 42 кг; В 84 кг;
Б 4,2 кг; Г 168 кг.
5. Металічний зв'язок утворюється в речовині:
А аміак; В вода;
Б карбон(ІV) оксид; Г залізо.
6.У сучасному авіабудуванні використовують такі властивості алюмінію:
А тепло- і електропровідність;В корозійну стійкість і міцність;
Б легкість;Г немагнітність.
7. Укажіть з якими з речовин може реагувати залізо:
А кисень; В купрум(ІІ) карбонат;
Б кальцій гідроксид; Г хлоридна кислота.
Д аргентум нітрат.
8. Виберіть метали, здатні витискувати водень із води:
А лужні та лужноземельні; В платинові;
Б підгрупа Феруму; Г всі метали.
9. Конфігурація валентного шару атома Кальцію:
А 3s23p63d10; В 4s24p0;
Б 4s24p2; Г 4s03d2.
10. Позначте відновник, що використовують для добування металів у промисловості:
А сірководень; В амоніак;
Б натрій сульфат; Г вуглець.
11.Установіть відповідність між металом та його властивостями:
Метали Властивості
1 Залізо А Активно розчиняється в розчинах лугів;
2 цинк Б Пасивується концентрованою сульфатною
3 натрій кислотою;
4 срібло В активно реагує з водою за кімнатної
температури;
Г за звичайних умов не взаємодіє з киснем;
Д проявляє стійкість відносно фтору.
12.Установіть генетичний ланцюжок добування цинку:
А ZnCl2; В. ZnO;
БZn(OH)2; Г. Zn.
Індивідуальні завдання
Тема: Загальна характеристика металів.
Варіант № 1.
- Допишіть продукти реакцій. Поставте коефіцієнти.
Pb + CuSO4→
Fe + Hg(NO3)2→
- Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Cr → Cr2O3→Cr(OH)3→ CrCI3→ Cr(NO3)3.
Індивідуальні завдання
Тема: Загальна характеристика металів.
Варіант № 2.
1. Допишіть продукти реакцій. Поставте коефіцієнти.
Fe + CuCI2→
AI +Fe2O3→
2.Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Zn→ZnCI2→Zn(OH)2→ZnO→ZnSO4.
Індивідуальні завдання
Тема: Загальна характеристика металів.
Варіант № 3.
1. Допишіть продукти реакцій. Поставте коефіцієнти.
Ni + HCI→
ZnO + C→
2.Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Sn→SnO→SnCI2→Zn(OH)2→SnO.
↓
Sn(NO3)2→Sn
Індивідуальні завдання
Тема: Загальна характеристика металів.
Варіант №4
1.Допишіть продукти реакцій. Поставте коефіцієнти.
Li + O2→
Na + H2S→
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Al→Al2O3→Al(OH)3
↓
Al2(SO4)3
Індивідуальні завдання
Тема: Загальна характеристика металів.
Варіант№5
1.Допишіть продукти реакцій. Поставте коефіцієнти.
K + H2O→
Mg + AgNO3→
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
Na→NaCl→NaOH
↓
Na2OH
AgNO3→Ag→Ag2SO4
↓
Ag2O

про публікацію авторської розробки
Додати розробку
