Неметали Vгрупи. Нітроген і Фосфор. Будова атомів, їх місце в періодичній системі. Амоніак, будова, властивості, добування.
Про матеріал
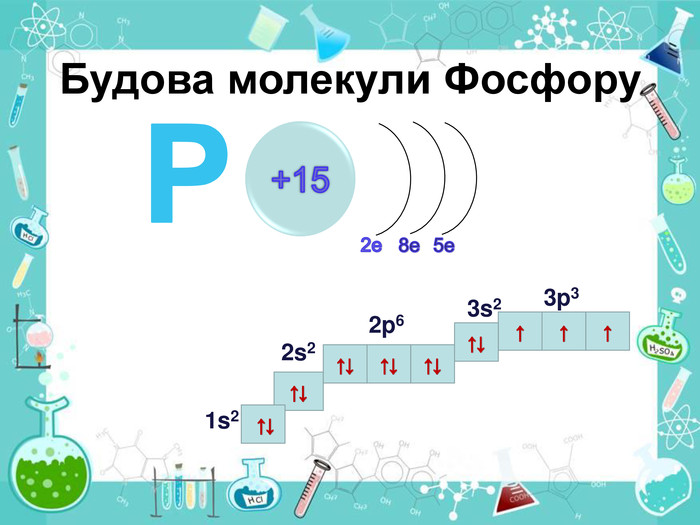
У створеній презинтації розглядаються питання загальної характеристики неметалів V групи, а саме Нітрогену та Фосфору, будова та властивості, добування та застосування амоніаку. Перегляд файлу
Зміст слайдів
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку