Збірник задач з теми: «Кількість речовини. Розрахунки за хімічними формулами ». 8 клас
У посібнику запропоновано багатоваріантні задачі з теми: «Кількість речовини. Розрахунки за хімічними формулами ». Багатоваріантні таблиці дозволяють учителю однаково та на рівних умовах визначити рівень навчальних досягнень учнів.
Крім контролюючої, дані задачі можуть виконувати і навчальну функцію, розвиваючи та удосконалюючи знання, уміння та навички учнів.
Призначено для вчителів та учнів 8 класу.
УПРАВЛІННЯ ОСВІТИ ЛУЦЬКОЇ МІСЬКОЇ РАДИ
Комунальний заклад
«Луцька загальноосвітня школа І-ІІІ ступенів №15
Луцької міської ради Волинської області»
Літвінчук С. М.
Багатоваріантні таблиці з хімії
8 клас
Збірник задач
Луцьк 2014
Літвінчук С. М. Багатоваріантні таблиці з хімії.8 клас – Луцьк: комунальний заклад «Луцька загальноoсвітня школа І-ІІІ ступенів № 15 Луцької міської ради Волинської області», 2014 – 28 c
У посібнику запропоновано багатоваріантні задачі з теми: «Кількість речовини. Розрахунки за хімічними формулами ». Багатоваріантні таблиці дозволяють учителю однаково та на рівних умовах визначити рівень навчальних досягнень учнів.
Крім контролюючої, дані задачі можуть виконувати і навчальну функцію, розвиваючи та удосконалюючи знання, уміння та навички учнів.
Призначено для вчителів та учнів 8 класу.
Рецензент: Оліферчук Л. Г. – учитель хімії, учитель - методист, заступник директора з навчально – виховної роботи комунального закладу «Луцька загальноосввітня школа І-ІІІ ступенів №15».
Рекомендовано методичною радою школи, протокол №6 від 25.02.2014
Зміст
Вступ………………………….…………………4
Теоретично – формульна база розрахункових задач…………………………………….………6
Багатоваріантні таблиці………………………12
Відповіді…………………………………….…19
Список використаної літератури…..…………26
Інтернет джерела………………………………27
Додатки…………………..…………………….28
Вступ
Розвиток сучасної науки і техніки ставить перед школою нові завдання. Випускник сучасної школи, який житиме і працюватиме в новому тисячолітті, повинен володіти певними якостями, зокрема:
- самостійно набувати необхідні знання, вміло застосовуючи їх на практиці для розв'язування назрілих проблем;
- критично мислити, уміти бачити труднощі і шукати шляхи їх подолання;
- грамотно працювати з інформацією;
- бути комунікабельним, контактним у різних соціальних групах;
- самостійно працювати над розвитком власного інтелекту, культурного і морального рівня.
Сформувати такі якості можливо лише через особистісно - орієнтовані технології, до яких належать і технології розв’язання кількісних хімічних задач.
Багатоваріантні таблиці створені з метою організації однакових, рівних умов для контролю вмінь учнів розв’язувати основні типи програмових розрахункових задач та інших завдань. Таблиці є також дидактичним матеріалом для індивідуальної роботи у класі при вивчені розрахункових задач за формулами. Учні мають змогу самостійно і при допомозі вчителя перевірити правильність засвоєння цього алгоритму.
Для використання таблиць можна використовувати наступну методику:
- Таблиці виготовляються на кожен робочий стіл.
- Учням повідомляється індивідуальний (один із 30) варіант задачі.
- Після пояснення алгоритму задачі учням пропонується опрацювати цей варіант з метою її усвідомлення.
- Змінивши варіант, використовуємо таблицю для контролю вміння розв’язувати задачу.
Технологія використання багатоваріантних таблиць передбачає оволодінням арсеналом базових знань з теми: « Кількість речовини. Розрахунки за хімічними формулами »
Теоретично – формульна база розрахункових задач
ОСНОВНІ ЗАКОНИ ХІМІЇ
Закон збереження маси: маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися внаслідок реакції.
Закон сталості складу: кожна індивідуальна молекулярна сполука має сталий якісний та кількісний склад незалежно від способу її добування.
Закон кратних відношень: якщо два елементи утворюють один з одним кілька сполук молекулярної будови, то на одну й ту саму кількість одного з них припадають такі кількості іншого, які відносяться між собою як невеликі цілі числа.
Закон Авогадро: в однакових об’ємах різних газів за однакових умов (температури та тиску) міститься однакове число молекул.
ОСНОВНІ ПОНЯТТЯ ХІМІЇ
Молекула – це найменша частинка речовини, яка має сталий склад і здатна зберігати основні хімічні властивості цієї речовини.
Атом – це найменша хімічно неподільна частинка хімічного елемента, яка зберігає його хімічні властивості.
Хімічний елемент – окремий вид атомів, що характеризується певними властивостями, або сукупність атомів з однаковими зарядами ядер.
Атомна одиниця маси (а.о.м.) (сучасна позасистемна одиниця вимірювання атомних і молекулярних мас) є ![]() маси атома ізотопу Карбону 12С: 1 а.о.м. = 1,66·10–24 г.
маси атома ізотопу Карбону 12С: 1 а.о.м. = 1,66·10–24 г.
Відносна атомна маса хімічного елементу – це фізична величина, що визначається відношенням маси атому елементу до ![]() частки маси атома ізотопу Карбону 12С: Ar = mатому·(
частки маси атома ізотопу Карбону 12С: Ar = mатому·(![]() m
m![]() )–1 = mатому/1 а.о.м. = mатому/1,66·10–27 кг, де mатому – маса атому елементу.
)–1 = mатому/1 а.о.м. = mатому/1,66·10–27 кг, де mатому – маса атому елементу.
Відносна молекулярна маса – це фізична величина, що визначається відношенням маси молекули до ![]() частки маси атома ізотопу Карбону 12С. Відносна молекулярна маса розраховується за хімічною формулою як сума відносних атомних мас всіх атомів елементів, що входять до складу молекул: Mr(BlCnDm) = l Ar(B) + n Ar(C) + m Ar(D), де BlCnDm– формула речовини; Ar– відносна атомна маса елементів; l, n, m – індекси хімічних елементів у формулі.
частки маси атома ізотопу Карбону 12С. Відносна молекулярна маса розраховується за хімічною формулою як сума відносних атомних мас всіх атомів елементів, що входять до складу молекул: Mr(BlCnDm) = l Ar(B) + n Ar(C) + m Ar(D), де BlCnDm– формула речовини; Ar– відносна атомна маса елементів; l, n, m – індекси хімічних елементів у формулі.
Кількість речовини – це фізична величина, що визначається числом часток – структурних елементів речовини: молекул, атомів, іонів. Одиницею її вимірювання є моль. Моль – це кількість речовини, що містить стільки часток – структурних елементів речовини (молекул, атомів, іонів), скільки атомів є в ізотопі Карбону 12С масою 0,012 кг. Це число дорівнює 6,02·1023.
Число Авогадро NA = 6,02·1023 моль–1 вказує число часток, структурних елементів у речовині, кількість якої становить 1 моль. Поняття “моль” застосовують щодо речовин в будь-якому агрегатному стані. Кількість речовини пов’язана з іншими величинами слідуючим чином: = ![]() ; =
; = ![]() ; =
; = ![]() , де m – маса речовини; M – молярна маса; N – число часток; NA – стала Авогадро; V – об’єм речовини (н.у.); Vm – молярний об’єм речовини.
, де m – маса речовини; M – молярна маса; N – число часток; NA – стала Авогадро; V – об’єм речовини (н.у.); Vm – молярний об’єм речовини.
Молярна маса (М) – це фізична величина, що визначається відношенням маси речовини до кількості речовини, яка їй відповідає: М = ![]() , де m – маса речовини; – кількість речовини, що їй відповідає. Одиниця вимірювання кг/моль, г/моль.
, де m – маса речовини; – кількість речовини, що їй відповідає. Одиниця вимірювання кг/моль, г/моль.
Молярний об’єм (Vm) – це фізична величина, що визначається відношенням об’єму речовини до відповідної кількості речовини: Vm = ![]() , де V – об’єм речовини, – кількість речовини, що йому відповідає. Одиниця вимірювання м3/моль, л/моль.
, де V – об’єм речовини, – кількість речовини, що йому відповідає. Одиниця вимірювання м3/моль, л/моль.
|
Фізична величина
|
Позначення |
Визначальна формула |
Одиниці вимірювання та деякі їх співвідношення |
|
Маса |
m |
– |
1 г = 10–3 кг і ін. |
|
Відносна атомна маса |
Ar |
Ar = mатому·( |
1 а.о.м. = 1,66·10–24 г |
|
Відносна молекулярна маса |
Mr |
Mr = mмолекули·( |
1 а.о.м. = 1,66·10–24 г |
|
Кількість речовини |
|
= |
1 моль (містить 6,02·1023 часточок речовини) |
|
Молярна маса |
M |
M= |
г/моль (маса (в г) 1 молі речовини) |
|
Об’єм |
V |
|
1л = 1 дм3 = 10–3 м3 і ін. |
|
Молярний об’єм |
Vm |
Vm= |
л/моль (об’єм (в л), який займає 1 моль речовини) |
|
Фізична величина
|
Позначення |
Визначальна формула |
Одиниці вимірювання та деякі їх співвідношення |
|
Густина |
|
= |
1 г/мл = 1000 кг/м3 = 1 кг/л і ін. |
|
Відносна густина газів |
D |
D(1)2= 1/2 = |
безрозмірна одиниця |
|
Частка речовини в суміші: |
|
|
|
|
а) масова |
|
= |
безрозмірна одиниця або % |
|
б) молярна |
|
= |
безрозмірна одиниця або % |
|
в) об’ємна |
|
= |
безрозмірна одиниця або % |
Багатоваріантні таблиці
1. Обчисліть кількість речовини А, якщо його маса становить Х г.
|
m (X) Р-на А |
80,5 |
75 |
64 |
38 |
90 |
|
ZnSO4 |
1 |
2 |
3 |
4 |
5 |
|
CuSO3 |
6 |
7 |
8 |
9 |
10 |
|
CaCO3 |
11 |
12 |
13 |
14 |
15 |
|
NaNO3 |
16 |
17 |
18 |
19 |
20 |
|
AIPO4 |
21 |
22 |
23 |
24 |
25 |
|
FeCI3 |
26 |
27 |
28 |
29 |
30 |
2. Об’єм газу А за нормальних умов становить X л. Обчисліть його масу.
|
V (A) газ А |
5,6 |
11,2 |
22,4 |
67,2 |
44,8 |
|
N2 |
1 |
2 |
3 |
4 |
5 |
|
O2 |
6 |
7 |
8 |
9 |
10 |
|
H2 |
11 |
12 |
13 |
14 |
15 |
|
CO2 |
16 |
17 |
18 |
19 |
20 |
|
SO2 |
21 |
22 |
23 |
24 |
25 |
|
CO |
26 |
27 |
28 |
29 |
30 |
3. Визначте масу речовини А кількістю речовини Х моль.
|
ν (X) Р-на А |
1 |
1,5 |
2 |
2,5 |
3 |
|
BaCI2 |
1 |
2 |
3 |
4 |
5 |
|
KNO3 |
6 |
7 |
8 |
9 |
10 |
|
H2SO4 |
11 |
12 |
13 |
14 |
15 |
|
H3PO4 |
16 |
17 |
18 |
19 |
20 |
|
AI2O3 |
21 |
22 |
23 |
24 |
25 |
|
Ca(OH)2 |
26 |
27 |
28 |
29 |
30 |
4. Визначте кількість речовини А масою Х г.
|
m (X) Р-на А |
21,7 |
31,5 |
26,4 |
42,8 |
53 |
|
K |
1 |
2 |
3 |
4 |
5 |
|
Ca |
6 |
7 |
8 |
9 |
10 |
|
Fe |
11 |
12 |
13 |
14 |
15 |
|
Na |
16 |
17 |
18 |
19 |
20 |
|
AI |
21 |
22 |
23 |
24 |
25 |
|
Zn |
26 |
27 |
28 |
29 |
30 |
5. Скільки молекул міститься у речовині А об’ємом Х л (н. у.)?
|
V (X) Р-на А |
112 |
56 |
224 |
448 |
632 |
|
H2 |
1 |
2 |
3 |
4 |
5 |
|
SO2 |
6 |
7 |
8 |
9 |
10 |
|
N2 |
11 |
12 |
13 |
14 |
15 |
|
CO2 |
16 |
17 |
18 |
19 |
20 |
|
O2 |
21 |
22 |
23 |
24 |
25 |
|
CO |
26 |
27 |
28 |
29 |
30 |
6. Визначте об’єм, який займе речовина А масою Х г за нормальних умов.
|
m (X) Р-на А |
60 |
120 |
75 |
34 |
89 |
|
NH3 |
1 |
2 |
3 |
4 |
5 |
|
SO2 |
6 |
7 |
8 |
9 |
10 |
|
O2 |
11 |
12 |
13 |
14 |
15 |
|
CO |
16 |
17 |
18 |
19 |
20 |
|
N2 |
21 |
22 |
23 |
24 |
25 |
|
CO2 |
26 |
27 |
28 |
29 |
30 |
7. Визначте кількість атомів Гідрогену в Х г речовини А.
|
m (X) Р-на А |
75 |
86 |
245 |
145 |
340 |
|
NH3 |
1 |
2 |
3 |
4 |
5 |
|
H2S |
6 |
7 |
8 |
9 |
10 |
|
CH4 |
11 |
12 |
13 |
14 |
15 |
|
PH3 |
16 |
17 |
18 |
19 |
20 |
|
H2 |
21 |
22 |
23 |
24 |
25 |
|
HNO3 |
26 |
27 |
28 |
29 |
30 |
8. Визначте відносну густину речовини А за Б
|
Б Р-на А |
повітрям |
CH4 |
NO |
CI2 |
NO2 |
|
NH3 |
1 |
2 |
3 |
4 |
5 |
|
SO2 |
6 |
7 |
8 |
9 |
10 |
|
O2 |
11 |
12 |
13 |
14 |
15 |
|
CO |
16 |
17 |
18 |
19 |
20 |
|
N2 |
21 |
22 |
23 |
24 |
25 |
|
CO2 |
26 |
27 |
28 |
29 |
30 |
9. Дано Х кг речовини А. Обчисліть: а) кількість речовини А; б) об'єм (н. у.), що займе задана маса речовини А.
|
m (X) Р-на А |
0,056 |
0,032 |
0,45 |
0,34 |
0,089 |
|
H2 |
1 |
2 |
3 |
4 |
5 |
|
І2 |
6 |
7 |
8 |
9 |
10 |
|
O2 |
11 |
12 |
13 |
14 |
15 |
|
O3 |
16 |
17 |
18 |
19 |
20 |
|
S |
21 |
22 |
23 |
24 |
25 |
|
CI2 |
26 |
27 |
28 |
29 |
30 |
10. Визначте відносну густину речовини А за Б
|
Б Р-на А |
повітрям |
O3 |
СІ2 |
SO3 |
Н2 |
|
NH3 |
1 |
2 |
3 |
4 |
5 |
|
SO2 |
6 |
7 |
8 |
9 |
10 |
|
O2 |
11 |
12 |
13 |
14 |
15 |
|
CO |
16 |
17 |
18 |
19 |
20 |
|
N2 |
21 |
22 |
23 |
24 |
25 |
|
CO2 |
26 |
27 |
28 |
29 |
30 |
11. Який об’єм займе газова суміш ( н. у. ), що складається із Х моль сульфур діоксиду та У моль азоту?
|
X У |
1 |
3 |
3,5 |
0,5 |
7 |
|
5 |
1 |
2 |
3 |
4 |
5 |
|
4 |
6 |
7 |
8 |
9 |
10 |
|
3,5 |
11 |
12 |
13 |
14 |
15 |
|
3 |
16 |
17 |
18 |
19 |
20 |
|
2 |
21 |
22 |
23 |
24 |
25 |
|
1,8 |
26 |
27 |
28 |
29 |
30 |
12. Обчисліть масу Х молекул речовини А.
|
X Р-на А |
10 |
14 |
18 |
20 |
23 |
|
H2 |
1 |
2 |
3 |
4 |
5 |
|
SO2 |
6 |
7 |
8 |
9 |
10 |
|
N2 |
11 |
12 |
13 |
14 |
15 |
|
CO2 |
16 |
17 |
18 |
19 |
20 |
|
O2 |
21 |
22 |
23 |
24 |
25 |
|
CO |
26 |
27 |
28 |
29 |
30 |
13. У якій кількості речовини А міститься Х атомів Оксигену?
|
N (X) Р-на А |
3·1023 |
1,5·1023 |
2,5·1023 |
0,51024 |
4·1023 |
|
H2O |
1 |
2 |
3 |
4 |
5 |
|
SO2 |
6 |
7 |
8 |
9 |
10 |
|
N2O5 |
11 |
12 |
13 |
14 |
15 |
|
Р2О3 |
16 |
17 |
18 |
19 |
20 |
|
СІ2О7 |
21 |
22 |
23 |
24 |
25 |
|
SO3 |
26 |
27 |
28 |
29 |
30 |
14. Обчисліть молярні маси речовин за їх формулами.
|
Р-на Р-на |
Fe(OH)3 |
Zn(OH)2 |
NH4Cl |
BaCO3 |
NaNO3 |
|
H2S |
1 |
2 |
3 |
4 |
5 |
|
H2SO4 |
6 |
7 |
8 |
9 |
10 |
|
H2SO3 |
11 |
12 |
13 |
14 |
15 |
|
H3PO4 |
16 |
17 |
18 |
19 |
20 |
|
H2SіO3 |
21 |
22 |
23 |
24 |
25 |
|
СаS |
26 |
27 |
28 |
29 |
30 |
Відповіді
1.
|
m (X) Р-на А |
80,5 |
75 |
64 |
38 |
90 |
|
ZnSO4 |
0,5 |
0,466 |
0,398 |
0,236 |
0,559 |
|
CuSO3 |
0,559 |
0,521 |
0,444 |
0,264 |
0,625 |
|
CaCO3 |
0,805 |
0,75 |
0,64 |
0,38 |
0,9 |
|
NaNO3 |
0,947 |
0,882 |
0,753 |
0,447 |
1,059 |
|
AIPO4 |
0,66 |
0,615 |
0,525 |
0,311 |
0,738 |
|
FeCI3 |
0,495 |
0,462 |
0,394 |
0,234 |
0,554 |
2.
|
V(A) газ А |
5,6 |
11,2 |
22,4 |
67,2 |
44,8 |
|
N2 |
7 |
14 |
28 |
84 |
56 |
|
O2 |
8 |
16 |
32 |
96 |
64 |
|
H2 |
0,5 |
1 |
2 |
6 |
4 |
|
CO2 |
11 |
22 |
44 |
132 |
88 |
|
SO2 |
16 |
32 |
64 |
192 |
128 |
|
CO |
7 |
14 |
28 |
84 |
56 |
3.
|
ν (X) Р-на А |
1 |
1,5 |
2 |
2,5 |
3 |
|
BaCI2 |
208 |
312 |
416 |
520 |
624 |
|
KNO3 |
101 |
151,5 |
202 |
252,5 |
303 |
|
H2SO4 |
98 |
147 |
196 |
245 |
294 |
|
H3PO4 |
98 |
147 |
196 |
245 |
294 |
|
AI2O3 |
102 |
153 |
204 |
255 |
306 |
|
Ca(OH)2 |
74 |
111 |
148 |
185 |
222 |
4.
|
m (X) Р-на А |
21,7 |
31,5 |
26,4 |
42,8 |
53 |
|
K |
0,556 |
0,808 |
0,677 |
1,097 |
1,359 |
|
Ca |
0,543 |
0,788 |
0,66 |
1,07 |
1,325 |
|
Fe |
0,388 |
0,563 |
0,471 |
0,764 |
0,946 |
|
Na |
0,943 |
1,37 |
1,148 |
1,861 |
2,304 |
|
AI |
0,804 |
1,167 |
0,978 |
1,585 |
1,963 |
|
Zn |
0,334 |
0,485 |
0,406 |
0,658 |
0,815 |
5.
|
V(X) Р-на А |
112 |
56 |
224 |
448 |
632 |
|
H2 |
3,01·1024 |
1,51·1024 |
6,02·1024 |
1,2·1025 |
1,7·1025 |
|
SO2 |
3,01·1024 |
1,51·1024 |
6,02·1024 |
1,2·1025 |
1,7·1025 |
|
N2 |
3,01·1024 |
1,51·1024 |
6,02·1024 |
1,2·1025 |
1,7·1025 |
|
CO2 |
3,01·1024 |
1,51·1024 |
6,02·1024 |
1,2·1025 |
1,7·1025 |
|
O2 |
3,01·1024 |
1,51·1024 |
6,02·1024 |
1,2·1025 |
1,7·1025 |
|
CO |
3,01·1024 |
1,51·1024 |
6,02·1024 |
1,2·1025 |
1,7·1025 |
6.
|
m (X) Р-на А |
60 |
120 |
75 |
34 |
89 |
|
NH3 |
79 |
158 |
99 |
44,8 |
117 |
|
SO2 |
21 |
42 |
26,25 |
11,9 |
31,15 |
|
O2 |
42 |
84 |
52,5 |
23,8 |
62,3 |
|
CO |
48 |
96 |
60 |
27,2 |
71,2 |
|
N2 |
48 |
96 |
60 |
27,2 |
71,2 |
|
CO2 |
31 |
61 |
38 |
17 |
45 |
7.
|
m(X) Р-на А |
75 |
86 |
245 |
145 |
340 |
|
NH3 |
7,97·1024 |
9,14·1024 |
2,6·1025 |
1,54·1025 |
3,61·1024 |
|
H2S |
2,66·1024 |
3,05·1024 |
8,68·1024 |
5,13·1024 |
1,2·1025 |
|
CH4 |
1,13·1025 |
1,3·1025 |
3,69·1025 |
2,18·1025 |
5,11·1025 |
|
PH3 |
3,98·1024 |
4,57·1024 |
1,3·1025 |
7,7·1024 |
1,81·1025 |
|
H2 |
4,52·1025 |
5,18·1025 |
1,47·1026 |
8,73·1025 |
2,05·1026 |
|
HNO3 |
7,17·1023 |
8,22·1023 |
2,34·1024 |
1,39·1024 |
3,25·1024 |
8.
|
Б Р-на А |
повітрям |
CH4 |
NO |
CI2 |
NO2 |
|
NH3 |
0,586 |
1,063 |
0,567 |
0,239 |
0,37 |
|
SO2 |
2,207 |
4 |
2,133 |
0,901 |
1,391 |
|
O2 |
1,103 |
2 |
1,067 |
0,451 |
0,696 |
|
CO |
0,966 |
1,75 |
0,933 |
0,394 |
0,609 |
|
N2 |
0,966 |
1,75 |
0,933 |
0,394 |
0,609 |
|
CO2 |
1,517 |
2,75 |
1,467 |
0,62 |
0,957 |
9.
|
m (X) Р-на А |
0,056 |
0,032 |
0,45 |
0,34 |
0,089 |
|
H2 |
28 627 |
16 358 |
225 5040 |
170 3808 |
44,5 997 |
|
І2 |
0,22 4,94 |
0,126 2,8 |
1,77 39,7 |
1,34 30 |
0,35 7,85 |
|
O2 |
1,75 39 |
1 22,4 |
14,1 315 |
10,6 238 |
2,781 62,3 |
|
O3 |
1,17 26 |
0,67 15 |
9,38 210 |
7,08 159 |
1,85 42 |
|
S |
1,75 39 |
1 22,4 |
14,1 315 |
10,6 238 |
2,78 62,3 |
|
CI2 |
0,79 17,7 |
0,45 10,1 |
6,34 142 |
4,79 107 |
1,25 28 |
10.
|
Б Р-на А |
повітрям |
O3 |
СІ2 |
SO3 |
Н2 |
|
NH3 |
0,586 |
0,354 |
0,24 |
0,213 |
8,5 |
|
SO2 |
2,207 |
1,33 |
0,9 |
0,8 |
32 |
|
O2 |
1,103 |
0,667 |
0,451 |
0,4 |
16 |
|
CO |
0,966 |
0,583 |
0,39 |
0,35 |
14 |
|
N2 |
0,966 |
0,583 |
0,39 |
0,35 |
14 |
|
CO2 |
1,517 |
0,917 |
0,62 |
0,55 |
22 |
11.
|
X У |
1 |
3 |
3,5 |
0,5 |
7 |
|
5 |
134,4 |
179,2 |
190,4 |
123,2 |
268,8 |
|
4 |
112 |
89,6 |
89,6 |
89,6 |
246,4 |
|
3,5 |
100,8 |
145,6 |
156,8 |
89,6 |
235,2 |
|
3 |
89,6 |
134,4 |
145,6 |
78,4 |
224 |
|
2 |
67,2 |
112 |
123,2 |
56 |
201,6 |
|
1,8 |
62,72 |
107,52 |
118,72 |
51,52 |
197,12 |
12.
|
X Р-на А |
10 |
14 |
18 |
20 |
23 |
|
H2 |
3,3·10-23 |
4,7·10-23 |
6·10-23 |
6,6·10-23 |
7,6·10-23 |
|
SO2 |
1,1·10-25 |
1,5·10-25 |
1,9·10-25 |
2,1·10-25 |
2,5·10-25 |
|
N2 |
4,7·10-24 |
6,5·10-24 |
8,4·10-24 |
9,3·10-24 |
1,7·10-25 |
|
CO2 |
7,3·10-24 |
1·10-25 |
1,3·10-25 |
1,5·10-25 |
1,7·10-25 |
|
O2 |
5,3·10-24 |
7,4·10-24 |
9,6·10-24 |
1,1·10-25 |
1,2·10-25 |
|
CO |
4,7·10-24 |
6,5·10-24 |
8,4·10-24 |
9,3·10-24 |
1,1·10-25 |
13.
|
N (X) Р-на А |
3·1023 |
1,5·1023 |
2,5·1023 |
0,51024 |
4·1023 |
|
H2O |
0,5 |
0,25 |
0,42 |
0,85 |
0,66 |
|
SO2 |
0,25 |
0,12 |
0,2 |
0,42 |
0,33 |
|
N2O5 |
0,1 |
0,05 |
0,08 |
0,17 |
0,13 |
|
Р2О3 |
0,17 |
0,08 |
0,14 |
0,28 |
0,22 |
|
СІ2О7 |
0,07 |
0,04 |
0,06 |
0,12 |
0,09 |
|
SO3 |
0,16 |
0,08 |
0,14 |
0,28 |
0,22 |
14.
|
Р-на Р-на |
Fe(OH)3 |
Zn(OH)2 |
NH4Cl |
BaCO3 |
NaNO3 |
|
H2S |
107 34 |
99 34 |
53,5 34 |
197 34 |
85 34 |
|
H2SO4 |
107 98 |
99 98 |
53,5 98 |
197 98 |
85 98 |
|
H2SO3 |
107 82 |
99 82 |
53,5 82 |
197 82 |
85 82 |
|
H3PO4 |
107 98 |
99 98 |
53,5 98 |
197 98 |
85 98 |
|
H2SіO3 |
107 78 |
99 78 |
53,5 78 |
197 78 |
85 78 |
|
СаS |
107 72 |
99 72 |
53,5 72 |
197 72 |
85 72 |
Список використаної літератури
- Базелюк І.І. та ін. Довідкові матеріали з хімії. – Київ; Ірпінь:DNA «Перун»,1998.
- Березан О.В. Енциклопедія хімічних задач. – Тернопіль: Підручники і посібники, 2001. – 304 с.
- Березан О.В. Хімія. Збірник задач. – Тернопіль: Підручники і посібники, 2011. – 352с.
- Буринська Н.М. Хімія. 8кл: Підручник 4-е вид., -К; Ірпінь: ВТФ «Перун», 2003.
- Грабовський А.К. Методика розв’язування розрахункових задач з хімії. – Черкаси: Відлуння-Плюс, 2004. – 214 с.
- Дубковецька Г.М., Ніколайчук В.І., Ніколайчук С.Д. Збірник задач з хімії для учнів загальноосвітніх навчальних закладів. – Тернопіль: Підручники і посібники, 2002. – 144 с.
- Кукса С.П. 600 задач з хімії. – Тернопіль: Мандрівець, 1999. – 260 с.
Інтернет джерела
Mon.gov.ua – Міністерство освіти і науки, молоді та спорту України
Man.gov.ua – Мала академія наук України
Osvita.ua – Освіта
ДОДАТКИ
Таблиця 1
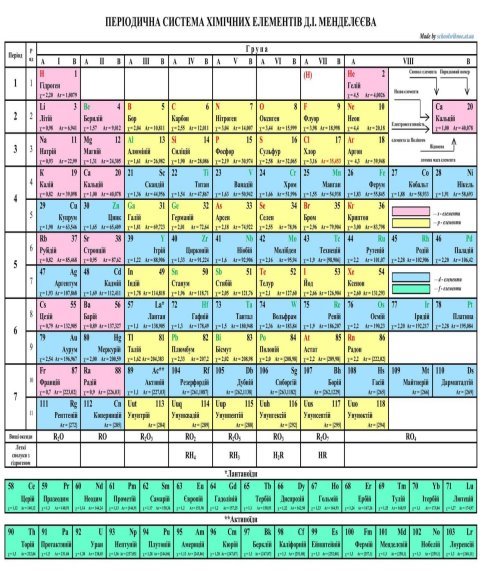
1
-
-
Дякую!
-


про публікацію авторської розробки
Додати розробку
