Урок узагальнення і систематизація знань. "Оксиди в природі. Використання оксидів". Конспект уроку з хімії для 8 класу на тему "Оксиди в природі. Використання оксидів".
Метою даного уроку є поглибити знання про класи неорганічних сполук на прикладі фізичних властивостей оксидів; ознайомлення з поширенням оксидів у природі; в конспекті показується зв'язок між властивостями й використанням оксидів. Роздатковий матеріал закодований за допомогою програми QR-коду.
Урок № 38
Тема. Оксиди в природі. Використання оксидів
Мета: поглибити знання про класи неорганічних сполук на прикладі фізичних властивостей оксидів; ознайомити учнів з поширенням оксидів у природі; показати зв’язок між властивостями й використанням оксидів; розвивати психічні процеси: мовлення, увагу, спостережливість, слухове зосередження на інформації, абстрактне, образне та логічне мислення учнів, вміння аналізувати; виховувати культуру поведінки учнів, інтерес до навчання.
Наскрізні лінії: громадянська відповідальність, екологічна безпека і сталий розвиток; здоров’я і безпека.
Компетентності: ключові (вміння вчитися - спостерігати, аналізувати, робити висновки; нформаційні - вміння осмислювати й використовувати інформацію з різних джерел (мовлення вчителя, однокласників, результати спостережень); комунікативні – вміння вільно висловлюватися, оптимально використовувати власні знання та навчальну інформацію уроку для результативної комунікації; соціальні – вміння продуктивно співпрацювати з однокласниками, вчителем; предметні (сформувати поняття про оксиди).
Тип уроку: урок узагальнення та систематизація знань.
Форми роботи: фронтальна робота, групова робота самостійна робота.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, картки-завдання, телефон з додатком зчитуванням QR-кодів.
ХІД УРОКУ
ІІ. Оголошення теми й мети уроку
 ІІІ. Актуалізація опорних знань учнів (пояснення вчителя з елементами демонстрування презентації)
ІІІ. Актуалізація опорних знань учнів (пояснення вчителя з елементами демонстрування презентації)
Фронтальна бесіда
- Що таке оксиди?
- Який хімічний елемент обов’язково входить до складу оксидів?
Виберіть з переліку різних речовин, оксиди і дайте їм назву за систематичною номенклатурою.
Na2SO4, MgO, Ca(OH)2, CO2, C2H5OH, V2O5, Cl2O7, Cu(OH)2, C6H12O6, CO, CaO, H2O.
ІV. Мотивація навчальної діяльності
На сьогоднішньому уроці ми з вами продовжуємо вивчати оксиди. Дізнаємося яку роль відіграє вода, вуглекислий газ у природі.
V. Вивчення нового матеріалу
Поширення у природі
Оксиди багатьох елементів дуже поширені в природі. Як ви гадаєте, чому?
Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем).
Майже чистим кремнеземом є гірський кришталь. Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів.
З руд, які містять алюміній оксид Al2O3, виплавляють алюміній.
Звичайний наждак – це також алюміній оксид з домішками.
Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір).
Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд.
До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об’ємна частка якого в повітрі становить 0,3 %.
Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).
Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті.
Багато води перебуває у газуватому стані в атмосфері. У вигляді великих мас снігу і криги лежить вода цілорічно на вершинах високих гір і в полярних країнах. У надрах Землі також є вода, що просочує грунт і гірські породи. Воді належить найважливіша роль у геологічній історії нашої планети.
Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3.
У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.
Застосування оксидів
- У металургії.
Людина, яка працює в галузі металургії, знає що важливими залізними рудами є:
- магнітний залізняк - Fe3O4
- червоний залізняк - Fe2O3
- бурий залізняк – Fe2O3·H2O, 2Fe2O3·3H2O
Для кольорової металургії використовують оксиди Мангану, Молібдену, Вольфраму, Алюмінію.
- У виготовленні скла.
У виробництві скла значну роль відіграє пісок SiO2. Для виготовлення скла входять силікати Натрію і Кальцію, а також пісок. Тому формула віконного скла виглядає: Na2O·CaO·6SiO2. а якщо взяти поташ K2CO3, кремнезем SiO2 і оксид Плюмбуму(ІІ) PbO, то утвориться кришталь.
- У гончарстві.
До складу глини входять кварц, опал та слюда. Під час виробництва цементу, цегли, кахлю використовують червону глину з домішками гідроксиду Феруму. Для тонкої кераміки застосовують білу глину.
- У ювелірній справі.
У ювелірній справі також використовують оксиди. Коштовні камені рубіни та сапфіри являють собою алюміній оксид Al2O3.колір коштовних каменів великою мірою залежить від домішок.
Всі завдання під час виконання перевіряються за допомогою проектування на екрані. Учні здійснюють самоперевірку, відповіді коментують.
1. Прийом «Хімічний тренінг»
Розділіть оксиди CO2, NO, NO2, Na2O, Al2O3, SiO2, P2O5, Cr2O3, ZnO відповідно до наданих класифікацій:
А) за природою хімічного елемента, який входить до складу оксидів;
Б) за характером хімічних властивостей оксидів;
В) за здатністю утворювати солі;
Г) за розчинністю у воді та здатністю реагувати з нею;
Д) за агрегатним станом за н.у;
Е) за значенням валентності хімічного елемента, який утворює оксид;
Ж) за поширеністю в природі.
 2. Прийом «Сам собі вчитель» (додаткова інформація за QR - кодом)
2. Прийом «Сам собі вчитель» (додаткова інформація за QR - кодом)
1. З’єднайте стрілками воду з тими оксидами та металами, з якими вона взаємодіятиме.
2. Складіть рівняння хімічних реакцій, розставте коефіцієнти, назвіть продукти.
|
ОКСИДИ |
|
МЕТАЛИ |
|
K2O |
|
Na |
|
HgO |
|
Fe |
|
CaO |
|
Cu |
|
PbO |
|
K |
|
ZnO |
|
Zn |
|
CO2 |
Н2О |
Hg |
|
FeO |
|
Ca |
|
Na2O |
|
Mg |
|
SO2 |
|
Ba |
|
P2O5 |
|
Li |
3. Прийом «Слідство ведуть хіміки»
Деякі оксиди замаскувалися під різними назвами: іржа, негашене вапно, сухий лід, лисячий хвіст, вода.
Допоможіть встановити їх хімічне ім’я.
- Прийом «Чарівна квітка»
Складіть та запишіть рівняння реакції взаємодії кисню з простими речовинами
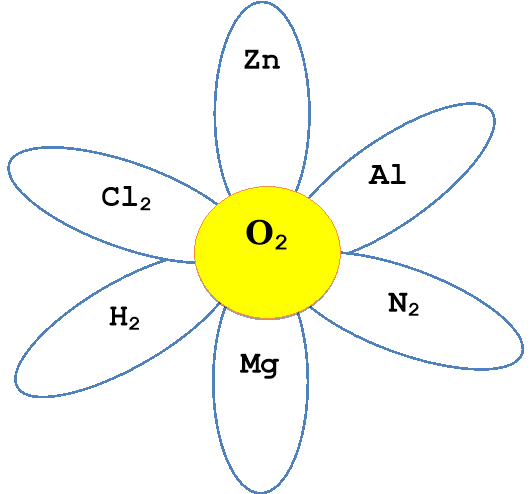
 Прийом «Коло ідей» (завдання для учнів розташовані за посиланням QR - кодом)
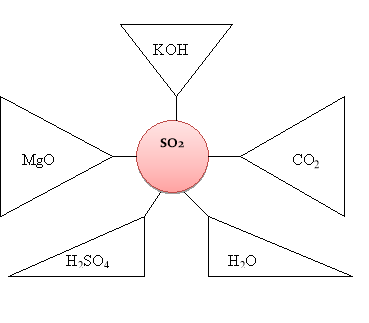
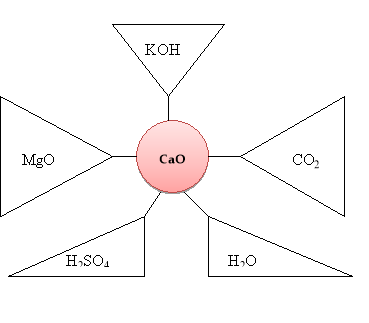
Прийом «Коло ідей» (завдання для учнів розташовані за посиланням QR - кодом)
Запишіть рівняння реакцій з оксидом, розташованим у центрі, в результаті яких можна отримати речовини, вказані у трикутниках.
І варіант
ІІ варіант
VІІІ. Підбиття підсумків
ІХ. Домашнє завдання
Опрацювати § 25 (ст.. 129-136), підручника Дячук Л.С. Хімія. 8 клас.; виконати завдання №18-22 (с.134-135).
-
Дякую за надану розробку!


про публікацію авторської розробки
Додати розробку
