Алгоритм написання електронних і графічних електронних формул атомів
Припустимо, у вас є завдання: "Написати електронну і графічну електронну формулу для атома Na".
Для початку пригадаємо, що
Атом - це найменша електронейтральна частинка речовини, що складається з позитивно зарядженого ядра і негативно заряджених електронів, що рухаються навколо нього
Розглянемо покрокові етапи - як виконувати це завдання.
1. Визначаємо місце заданого елемента в періодичній системі хімічних елементів і деякі його характеристики (усно).
Na знаходиться в І групі (головні підгрупі - лужний метал), 3 періоді (малому).
Порядковий номер (атомне число), кількість електронів, протонів, протонне число - 11.
Нуклонне число - 23.
2. Визначаємо заряд ядра атома Na (усно)
Заряд ядра Na - +11 (обов'язково враховуємо "+").
3. Визначаємо кількість енергетичних рівнів і кількість електронів на них (усно)
Na знаходиться
- в 3 періоді - отже, має 3 енергетичні рівні;
- в І групі - отже, на останньому рівні буде 1 електрон (1е-)
Електронна формула
1. Знаючи дещо про елемент, починаємо оформлювати дані в електронну формулу
Запис починаємо з того, що уже знаємо:
Na +11 ) ) )
Примітка!!!! Дужки - ))) - це кількість енергетичних рівнів, ми уже розібрались, що їх є 3, отже, ставимо три дужки.
2. Починаємо розписувати енергетичні рівні і підрівні. Щоб це робити правильно,
потрібно дуже добре вивчити декілька простеньких правил.
- Завжди починаємо з 1 рівня.
- Усі рівні пишемо за порядком - 1,2,3. Упускати якийсь не можна.
- Номер рівня вказує на кількість підрівнів на ньому. Якщо рівень 1, то підрівень він має лише 1; якщо рівень №2, то підрівнів у нього теж 2.
1 рівень - лише s-підрівень;
2 рівень - s-підрівень і р-підрівень;
3 рівень - s-підрівень, р-підрівень і d-підрівень
4 рівень - s-підрівень, р-підрівень, d-підрівень і f-підрівень.
- Підрівні мають строго визначену кількість електронів:
s-підрівень - 2е-
р-підрівень - 6е-
d-підрівень - 10е-
f-підрівень - 14е-
- Увага! на 4 рівні після 4s-підрівня заповнюється 3d!! -підрівень, а не 4p. (Згідно з принципом Паулі)
- Підрівні заповнюються електронами по порядку - s-підрівень, р-підрівень, d-підрівень і f-підрівень. Перш ніж перейти до заповнення р-підрівня, необхідно заповнити s-підрівень і т.д.
Отже, дописуємо свою електронну формулу. Пам'ятаємо, що у нас є 3 рівні. Кількість е- записуємо над символом підрівня.
Nа +11 ) ) ) 1s22s22p63s1
3. Наступний крок - під кожною дужкою (дужка - це схематичне зображення рівня) вказуємо кількість електронів на ньому
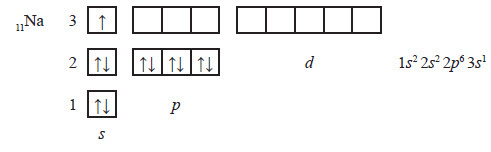
Nа +11 )2)8)1 1s22s22p63s1
Електронна формула для атома Na написана
Увага!!!
Графічна формула
- Графічна формула пишеться на основі електронної. Суть в тому, щоб розмістити електрони по комірках (схематичне зображення орбіталей, по яких вони рухаються навколо ядра)
- Щоб навчитися писати графічні формули правильно, потрібно запам'ятати кілька простих правил
- Одна клітинка в зошиті - це одна комірка (орбіталь).
- В одній комірці може бути не більше 2 електронів
- Електрони в комірках позначаємо стрілочками.
- Важливо! Електрони заповнюються по одному в кожну комірку. Особливо уважним треба бути на р-підрівні - ставимо по одному електрону в кожну комірку, а потім вертаємось до першої. Наприклад. у атома Нітрогену - N чи Р. На 2р-підрівні в цих атомів по 3 електрони - кожен з цих 3-ох електронів зайняв одну комірку.
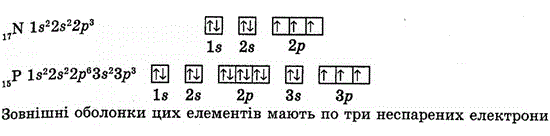
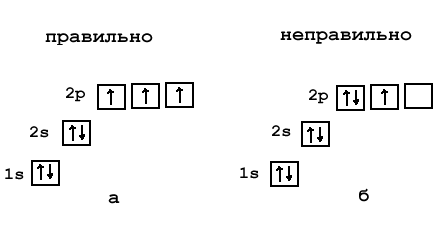
- В одній комірці можуть бути електрони лише з різними спінами (тобто стрілочки повернуті вверх і вниз).
- Електрони заповнюють комірки попорядку від 1 рівня.
- Увага! на 4 рівні після 4s-підрівня заповнюється 3d!! -підрівень, а не 4p. (Згідно з принципом Паулі)
- Рівні підносимо на одну клітинку вгору, а підрівні на пів клітинки.
Наприклад,
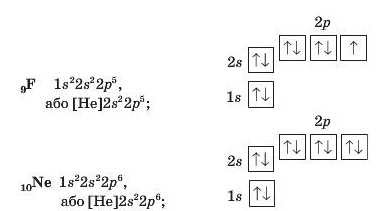
3. Отже, тепер ми можемо записати графічну формулу для атома Na
Це цікаво!!!
Існують різні способи написання графічних формул, але всі вони підпорядковуються одним і тим же правилам:
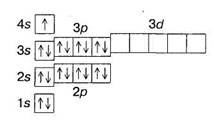 І спосіб
І спосіб
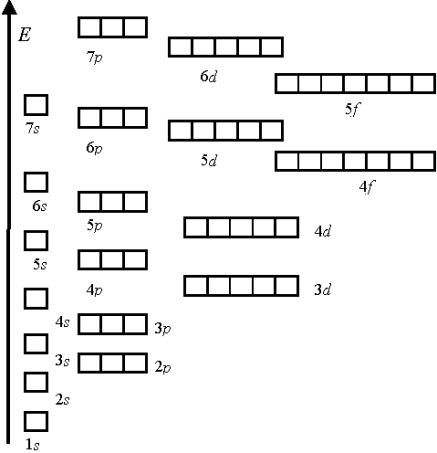 ІІ спосіб
ІІ спосіб
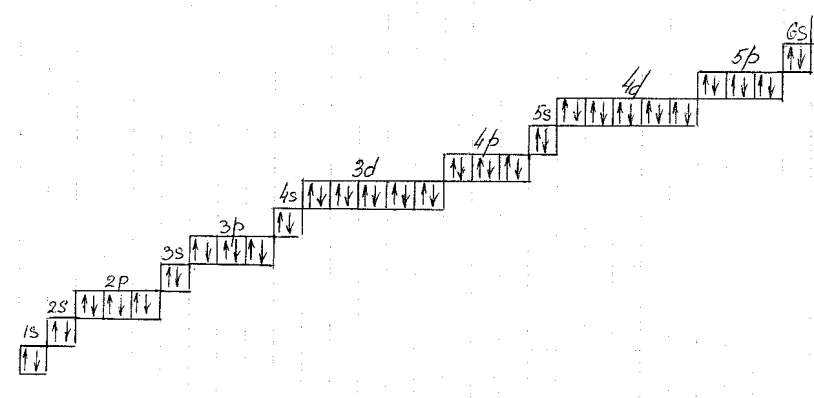 ІІІ спосіб
ІІІ спосіб
-
Щіро дякую!
-
-
Дякую за алгоритм


про публікацію авторської розробки
Додати розробку
