Конспект уроку "Закон Авогадро. Молярний об'єм газів"
Конспект уроку з хімії 8 клас по розділу «Кількість речовини. Розрахунки за хімічними формулами».
Тема уроку. Закон Авогадро. Молярний об’єм газів.
Мета: сформувати знання про молярний об’єм газів та закон Авогадро. Пояснити сутність величини молярного об’єму газів. Навчити встановлювати взаємозв’язок між молярним об’єм газів та кількістю речовини; обчислювати об’єм за відомим значення кількості речовини і навпаки.
Розвивати вміння порівнювати, узагальнювати отримані знання та робити висновки.
Виховувати самостійність, наполегливість у виконанні вправ.
Тип уроку: комбінований.
Хід уроку.
І. Організаційний момент.
ІІ. Актуалізація опорних знань. Перевірка домашнього завдання.
Самостійна робота.
Рішення тестових завдань.
- Визначте та вкажіть масу 5 моль речовини, формула якої – Zn3N2:
а) 395 г ; б) 1115 г ; в) 223 г; г) 44,6 г; д) 220 г.
2. Обчисліть і вкажіть масу води, що міститься у мідному купоросі, кількість речовини якого дорівнює 0,2 моль:
а) 10,8 г ; б) 36 г ; в) 9 г; г) 18 г; д) 24 г.
3. Встановіть відповідність між масою газу та кількістю речовини.
|
А) |
1. |
|
Б) |
2. |
|
В) 2,84 г хлору |
3. |
|
Г) |
4. |
|
|
5. |
ІІІ. Мотивація навчальної діяльності.
Чому дорівнює об’єм 1 моль газуватої речовини?
V. Вивчення нового матеріалу.
У 1 моль будь-якої речовини міститься ![]() структурних частинок. Відстані між структурними частинками різні й невеликі. Тому 1 моль рідин чи твердих речовин займає різні об’єми.
структурних частинок. Відстані між структурними частинками різні й невеликі. Тому 1 моль рідин чи твердих речовин займає різні об’єми.
1 моль - ![]() структурних частинок
структурних частинок
Для газів!
Відстань між молекулами великі і приблизно однакові, тому за об’єм 1 моля газу приймається об’єм простору, який вони займають
![]() 1 моль (Н2)
1 моль (Н2)
1 моль (О2) мають ![]() і займають об’єми 22,4 л
і займають об’єми 22,4 л
1 моль (СО2) тобто, якщо число молекул у 1 моль газів є великою сталою
1 моль (СН4) і становить ![]() , то об’єм, який вони займають,
, то об’єм, який вони займають,
є теж величиною сталою. Він становить за нормальних умов
22,4 л.
Закон Авогадро. В однакових об’ємах газів за однакових умов міститься однакове число молекул.
Тоді, наслідком закону Авогадро є той факт, що однаковому числу молекул газів відповідають однакові об’єми.
Для розрахунків, пов’язаних з визначенням об’єму газів, застосовують поняття молярного об’єму.
Молярний об’єм – це відношення об’єму до відповідної кількості речовини.
Математичні вирази:
![]() ;
; ![]() ;
; 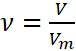
Молярний об’єм (Vm) – це стала фізична величина, яку застосовують під час хімічних обчислень, оскільки вимірювати об’єм газу зручніше, ніж його масу. І за нормальних умов (н.у.) дорівнює 22,4 л/моль
За нормальних умов, тобто при температурі 273,15 К (≈ 273 К) або 00 С і тиску 101325 Па (≈ 101,3 кПа), об’єм 1 моль будь-якого газу дорівнює 22,4 л.
IV. Закріплення вивченого матеріалу.
- Заповнити таблицю.
|
Задано |
Mr |
M |
Маса 1 моль |
Число молекул |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Самостійна робота.
- Обчистіть та вкажіть масу азоту, об’єм якого дорівнює 560 мл:
а) 0,4 г ; б) 0,7 г ; в) 0,35 г; г) 14 г; д) 28 г.
2. Обчисліть і вкажіть, який об’єм (за н.у.) займе 17,75 г хлору.
а) 22,4 л ; б) 11,2 л ; в) 5,6 л; г) 12.2 л; д) 13,6 л.
3.Робота біля дошки.
1. Обчисліть, який об’єм займе водень (н.у.) кількість речовини 0,7 моль.
- Обчисліть, який об’єм займе азот (н.у.) кількістю речовини 2 моль. Яке число молекул у такому об’ємі?
- Обчистіть, який об’єм карбон (IV) оксиду (н.у.) масою 2,4 г.
- Обчисліть, який об’єм карбон (ІІ) оксид масою 25 г. Скільки молекул міститься в такому об’ємі?
- Обчисліть, який об’єм (н.у.) займе невідомий газ, якщо маса його дорівнює 88 г.
V. Підсумок уроку. Оцінювання.
VI. Домашнє завдання. Вивчити параграф підручника. Вправи для закріплення знань.

про публікацію авторської розробки
Додати розробку
