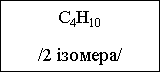Алкани (насичені вуглеводні,або парафіни)
![]() (насичені ВВ, або парафіни).
(насичені ВВ, або парафіни).
CnH2n, n≥1
- Алкани – це ВВ, в молекулах яких всі атоми Карбону знаходяться в
стані SP3 гібридизації і зв’язані один з одним тільки σ- зв’язками.
![]() σ
σ
![]()
![]()
![]() σ С σ
σ С σ
σ
Кожний атом Карбону в молекулі алкану зв’язаний простими зв’язками з чотирма атомами («С» або «Н») і не може приєднувати інші атоми. Тому алкани і називають насиченими вуглеводнями.
Будова алканів
Всі атоми С в молекулах алканів знаходяться в стані SP3 гібридизації, кут між зв’язками
![]()
![]()
![]() С
С
![]()
![]()
![]()
![]() Складає 109028/, тому молекули нормальних алканів
Складає 109028/, тому молекули нормальних алканів
С С з великим числом атомів Карбону мають зигзагоподібну будову (зигзаг):
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Довжина зв’язку -- С – С -- в насичених ВВ дорівнює 0,154 нм
(1нм = 10-9м).
Гомологічний ряд алканів
|
Молекулярна формула алкану СnH2n+2 |
Назва алкану |
Молекулярна формула Одновалентного ВВ Радикалу (алкіла) - CnH2n+1 |
Назва алкіла (алкільного радикала) |
|
СН4 |
Метан |
- СН3 |
Метил |
|
С2Н6 |
Етан |
- С2Н5 |
Етил |
|
С3Н8 |
Пропан |
- С3Н7 |
Пропіл |
|
С4Н10 |
Бутан |
- С4Н9 |
Бутил |
|
С5Н12 |
Пентан |
- С5Н11 |
Пентил |
|
С6Н14 |
Гексан |
- С6Н13 |
Гексил |
|
С7Н16 |
Гептан |
- С7Н15 |
Гептил |
|
С8Н18 |
Октан |
- С8Н17 |
Октил |
|
С9Н20 |
Нонан |
- С9Н19 |
Нонил |
|
С10Н22 |
Декан |
- С10Н11 |
Децил |
Ізомерія і номенклатура алканів
Можлива лише ізомерія ланцюга.
Перші три члена гомологічного ряду алканів (СН4, С2Н6, С3Н8) ізомерів не мають.
|
Н. – Бутан (Нормальний бутан) З нерозгалуженим ланцюгом |
|
1 2 3 Н3С – СН – СН3 СН3 Ізобутан (2 метилпропан), Має розгалужений ланцюг. |
Відповідно до міжнародної номенклатури ізомери з розгалуженим ланцюгом вуглецевих атомів слід розглядати як похідні алканів з самим найдовшим нерозгалуженим ланцюгом.
Правила утворення назв
розгалужених алканів за міжнародною номенклатурою
( І Ю П А К )
- Знайти самий найдовший (головний) нерозгалужений ланцюг вуглецевих атомів.
- Пронумерувати атоми С головного ланцюга.
- Номер атома С, у якого є замісник (алкільний радикал), повинен бути найменшим.
- Вказати положення замісника (номер атома Карбона, біля якого знаходиться замісник (алкільний радикал)).
- Назвати алкільний радикал.
- Назвати алкан, що відповідає даному ланцюгу.
![]() 6 5 4 3
6 5 4 3
СН3 – СН2 – СН2 – СН –
![]() 2
2
СН2
![]() 1
1
СН3 3 метилгексан
В молекулах з декількома однаковими замісниками необхідно вказати положення кожного замісника. Число однакових замісників позначають грецькими числівниками:
![]()
![]()
![]()
![]() Ди – (два); три – (три); тетра – (чотири); пента – (п’ять) і т.д.
Ди – (два); три – (три); тетра – (чотири); пента – (п’ять) і т.д.
СН3
![]() 1 2 3 4 5
1 2 3 4 5
![]() Н3С – СН2 – С – СН2 - СН3 3,3 Диметилпентан
Н3С – СН2 – С – СН2 - СН3 3,3 Диметилпентан
СН3
1 2 3 4 5 6 7 8
СН3 – СН2 – СН – СН – СН2 – СН - СН2 – СН3
![]()
![]()
![]()
С2Н5 С2Н5 С2Н5 3,4,6 триетил-октан
Різні замісники називають в алфавітному порядку.
1 2 3 4 5 6 7 8
![]()
![]() СН3 – СН2 – СН – СН2 – СН – СН2 – СН2 – СН3
СН3 – СН2 – СН – СН2 – СН – СН2 – СН2 – СН3
![]() СН2 СН3
СН2 СН3
СН3 5метил3етил-октан
Фізичні властивості алканів
СН4 … С4Н10 С5Н12 … С15Н32 С16Н34 …
Гази без запаху Рідини (мають запах) Тверді речовини (без запаху)
![]()
t0 кипіння і t0 плавлення збільшуються.
Алкани – безбарвні речовини, легші за воду, погано розчиняються у воді.
Хімічні властивості алканів
Тривіальна назва алканів – «парафіни» - означає «не имеющие сродства».
Алкани хімічно мало активні. Низька реакційна здатність алканів обумовлена дуже малою полярністю зв'язків С – С та С – Н в їх молекулах внаслідок майже однакової електронегативності атомів Карбона і Гідрогена.
Для алканів найбільш характерними є реакції заміщення. В цих реакціях гемолітичний розрив ковалентних зв'язків, тобто вони відбуваються по вільно-радикальному (ланцюговому) механізму.
І. Реакції заміщення (розрив зв’язку С- Н)
1). Г а л о г е н у в а н н я (заміщення атома гідрогена на атом галогена – F, Cl, Bn з утворенням галоген алкана RHal).
Алкани дуже активно реагують з фтором. Хлорування протікає під дією світла і являється фотохімічною ланцюговою реакцією. Молекули нижчих алканів можна хлорувати повністю.
+Сl2, hυ +Сl2 +Сl2 +Сl2
![]()
![]()
![]()
![]() СН4 СН3Сl СН2Сl2 СНСl3 ССl4
СН4 СН3Сl СН2Сl2 СНСl3 ССl4
метан -НСl Хлор- -НСl Дихлор- -НСl Трихлор- -НСl Тетрахлор-
етан етан етан етан
2). Н і т р у в а н н я (заміщення атома гідрогена нітрогрупою з утворенням нітроалканів R – NО2).
Нітруючий реагент – нітратна кислота НNО3 (НО - NО2)
![]()
![]()
![]()
![]()
![]()
![]() Н Н
Н Н
Н – С – Н + НО - NО2 Н – С - NО2 + Н2О
![]()
![]()
![]()
![]() Н Н
Н Н
Нитрометан
Номенклатура нітро- та галоген алканів
![]() СН3
СН3
1 2 3 4 4 3 2 1 5 4 3 2 1
СН3 – СН – СН2 – СН3 СН3 – СН – СН – СН3 СН3 – СН – СН2 – СН – СН3
![]()
![]()
![]()
![]()
NО2 NО2 Сl СН3
2 – Нітробутан 2 метил 3 нітробутан 2 метил 4 хлорпентал
Замісники перераховуються в алфавітному порядку.
3). С у л ь ф у р у в а н н я (заміщення атома гідрогена сульфогрупою SО3Н з утворенням алкан сульфокислот RSО3Н).
Сульфуруючий реагент – сірчана (сульфатна) кислота Н2SО4 (НО-SО3Н).
Сульфурування відбувається при дії дуже концентрованої Н2SО4 при незначному нагріванні:
![]()
![]()
![]()
![]() Н Н
Н Н
![]()
![]() t0
t0
![]() Н – С – Н + НО - SО3Н Н – С - SО3Н + Н2О
Н – С – Н + НО - SО3Н Н – С - SО3Н + Н2О
![]()
![]()
![]()
![]() Н Н
Н Н
Сульфометан
СН3 СН3
![]()
![]()
![]()
![]() t0 4 3 2 1
t0 4 3 2 1
![]()
![]()
![]() СН3 – СН2 – С – СН3 + НО - SО3Н СН3 – СН2 – С – СН3 + Н2О
СН3 – СН2 – С – СН3 + НО - SО3Н СН3 – СН2 – С – СН3 + Н2О
![]()
![]() SО3Н
SО3Н
2 метилбутан 2 сульфокислота
(2 метил – 2 сульфобутан)
Номенклатура сульфоподібних алканів
До назви відповідного алкану необхідно добавити префікс «сульфо-» або закінчення «сульфокислота» із вказівкою положення сульфогрупи:
![]() СН3
СН3
3 2 1
СН3 – СН2 – СН - SО3Н СН3 – СН2 – СН2 - SО3Н
Бутан – 2 - сульфокислота 1 сульфопропан
ІІ. Реакції окиснення
За звичайних умов алкани стійкі до дії окисників (КМnО4, К2Сr2О7).
1). Окиснення киснем повітря при високій температурі (г о р і н н я):
А) повне окиснення (надлишок О2):
![]() -4 t0 +4
-4 t0 +4
СН4 + 2О2 СО2 + 2Н2О
Б) неповне окиснення (недостача О2):
-4 t0 +2
![]() 2СН4 + 3О2 2СО + 4Н2О
2СН4 + 3О2 2СО + 4Н2О
-4 t0 0
![]() СН4 + О2 С + 2Н2О
СН4 + О2 С + 2Н2О
2). Окиснення киснем повітря при невисоких температурах в присутності каталізаторів (неповне каталітичне окиснення):
-4 кат. -2
![]() 2СН4 + О2 t0 1 2СН3ОН
2СН4 + О2 t0 1 2СН3ОН
Метан Метанол
![]()
![]() -4 кат./ О
-4 кат./ О
![]()
![]() СН4 + О2 t0 2 Н – С + Н2О
СН4 + О2 t0 2 Н – С + Н2О
Н
![]()
![]() кат.// О
кат.// О
![]()
![]() 2СН4 + 3О2 t0 3 2Н – С + 2Н2О
2СН4 + 3О2 t0 3 2Н – С + 2Н2О
ОН
ІІІ. Термічне перетворення алканів
1). К р е к і н г (р о з щ е п л е н н я) – це розрив зв'язків С – С в молекулах алканів з довгими вуглецевими ланцюгами, в результаті чого утворюються алкани і алкени з меншим числом атомів С.
![]()
![]() К Р Е К І Н Г
К Р Е К І Н Г
Термічний (піроліз) Каталітичний
t0 = 450-7000С t0 = 400-5000С
каталізатори: Аl2О3 + SіО2
Аl2О3 + Сr2О3
![]() СН3 – СН2 – СН2 – СН3 СН3 – СН3 + СН2 = СН2
СН3 – СН2 – СН2 – СН3 СН3 – СН3 + СН2 = СН2
![]() СН3 – СН2 – СН2 – СН2 – СН3 СН4 + СН3 – СН2 – СН = СН2
СН3 – СН2 – СН2 – СН2 – СН3 СН4 + СН3 – СН2 – СН = СН2
2). Д е г і д р у в а н н я (-Н2):
15000С
![]()
![]() 2СН4 СН ≡ СН + 3Н2
2СН4 СН ≡ СН + 3Н2
Метан етин
t0, кат.
![]() С2Н6 С2Н4 + Н2
С2Н6 С2Н4 + Н2
Етан етен
3). Дегідроциклізація (ароматизація, дегідрування алканів з утворенням ароматичних сполук):
![]()
![]() СН3
СН3
![]()
![]()
![]() 3000С
3000С
![]() СН3 – СН2 - СН2 - СН2 - СН2 - СН2 – СН3 Рt О + 4Н2
СН3 – СН2 - СН2 - СН2 - СН2 - СН2 – СН3 Рt О + 4Н2
![]()
![]()
![]() Гептан
Гептан
Метилбензол
4). Ізомеризація (перетворення хімічної сполуки в його ізомер):
![]() Н – алкан ізоалкан
Н – алкан ізоалкан
1000С 1 2 3
![]()
![]() СН3 – СН2 – СН2 – СН3 СН3 – СН – СН3
СН3 – СН2 – СН2 – СН3 СН3 – СН – СН3
![]() Н бутан АlСl3 СН3 ізобутан
Н бутан АlСl3 СН3 ізобутан
(2 метилпропан)
Добування алканів
Добування метану:
1). В п р о м и с л о в о с т і:
А) із природного газу;
Б) синтез із оксиду карбону(ІІ) і водню:
Nі, 3000С
![]() СО + 3Н2 СН4 + Н2О
СО + 3Н2 СН4 + Н2О
Р
2). В л а б о р а т о р і ї:
![]() А). гідроліз карбіду алюмінію:
А). гідроліз карбіду алюмінію:
![]() Аl4С3 + 12Н2О 3СН4 + 4Аl(ОН)3;
Аl4С3 + 12Н2О 3СН4 + 4Аl(ОН)3;
Б). сплавлення солей оцтової кислоти із лугами:
![]() t0
t0
![]() СН3СООNа + NаОН СН4 + Nа2СО3
СН3СООNа + NаОН СН4 + Nа2СО3
Ацетат натрію
(тв..) (тв..)
Добування гомологів метану:
1). В п р о м и с л о в о с т і:
А). із природної сировини (нафта, газ, гірський віск);
Б). синтез із СО і Н2:
3000С
![]() nСО + (2n + 1)Н2 СnН2n+2 + nН2О
nСО + (2n + 1)Н2 СnН2n+2 + nН2О
Fе
2). В л а б о р а т о р і ї:
А). каталітичне гідрування (+Н2) ненасичених ВВ:
Рt
![]() СnН2n + Н2 СnН2n+2
СnН2n + Н2 СnН2n+2
Алкен Nі, 1500С Алкан
Рt
![]() СnН2n-2 +2Н2 СnН2n+2
СnН2n-2 +2Н2 СnН2n+2
Алкін Алкан
![]()
![]() Б). Реакція В'юруа (взаємодія галоген алканів з металічним натрієм):
Б). Реакція В'юруа (взаємодія галоген алканів з металічним натрієм):
![]() СН3 Сl t0 СН3
СН3 Сl t0 СН3
![]() + 2 Nа + 2 Nа Сl або
+ 2 Nа + 2 Nа Сl або
![]() СН3 Сl СН3
СН3 Сl СН3
![]()
![]()
![]()
![]()
![]()
![]() СН3 - Сl + 2 Nа + Сl - СН3 = СН3 – СН3 + 2 NаСl
СН3 - Сl + 2 Nа + Сl - СН3 = СН3 – СН3 + 2 NаСl
Застосування метану СН4:
Метанол СН3ОН
Розчинники СН3Сl, СН2Сl2, ССl4
Фреони СF2Сl2
Ацетилен С2Н2
![]()
![]()
![]() «Синтез – газ» СО + Н2
«Синтез – газ» СО + Н2
Типографська фарба С
Мурашина кислота НСООН
![]()
![]() О
О
![]() Мурашиний альдегід Н – С
Мурашиний альдегід Н – С
Н
![]()
![]()
![]() СН4 Н2 NН3 НNО3.
СН4 Н2 NН3 НNО3.


про публікацію авторської розробки
Додати розробку