Багатоманітність та взаємозв’язок органічних речовин
Урок з предмету «Хімія» на тему «Багатоманітність та взаємозв'язок органічних речовин». Розробка уроку у 11 класі спрямована на узагальнення та систематизацію знань з органічної хімії шляхом використанням роботи в малих групах та тестування.
Тема уроку: Багатоманітність та взаємозв’язок органічних речовин
Мета уроку: Навчальна – узагальнити, закріпити знання про органічні сполуки, їх класифікацію. Встановити генетичний зв’язок між ними. Перевірити вміння розпізнавати органічні речовини за допомогою якісних реакцій.
Розвиваюча – продовжити розвивати вміння та навички учнів використовувати теоретичні знання під час розв’язування вправ та розрахункових задач.
Виховна – виховувати навички самостійності, наполегливості сприяти глибокому творчому підходу до вивченого матеріалу.
Тип уроку: Узагальнення та систематизація знань.
Обладнання уроку: 1. Періодична система хімічних елементів Д.І.Менделєєва.
- Лабораторне обладнання та реактиви.
- Тести-зіставлення по темі.
Основні поняття та терміни: вуглеводні, спирти, феноли, альдегіди, карбонові кислоти, естери, вуглеводи, амінокислоти, ізомери, гомологи, генетичний зв’язок, полімеризація, поліконденсація.
Міжпредметний зв’язок: біологія, історія, ТБ.
План уроку
І. Організаційний момент уроку.
ІІ. Мотивація навчальної діяльності.
„Широко простигає хімія руки свої у справи людські”. Це висловлювання М.В.Ломоносова особливо справедливе зараз, коли хімія стала безпосередньо виробничою силою суспільства.
Тому я хочу вас запитати: чи можливо створення передових технологій виробництва та ефективний розвиток економіки без знань генетичного зв’язку між основними класами органічних речовин. Не можливо. Отже, сьогодні на уроці ми будемо доводити наявність генетичного зв’язку між класами. Виявляти та обґрунтовувати залежність властивостей органічних сполук від структури їх молекул та наявності функціональних груп. Ви знаєте, що неорганічних речовин відомо близько 500 тисяч, а органічних більш ніж 10 млн. і їх кількість все росте. А в кінці уроку ви повинні будете назвати причини розмаїтості органічних речовин.
ІІІ. Актуалізація опорних знань.
Перед тим, як перейти до систематизації та узагальнення матеріалу, я пропоную виконати завдання. Клас буде працювати в малих групах (2 -3 учні). Ви отримаєте завдання де в залежності від складності ви повинні будете:
- Визначити клас органічних речовин та охарактеризувати їх за планом.
- Розв’язати задачу на виведення формули.
- Провести експеримент – здійснити якісні реакції.
Таких малих груп буде 12 від числа класів органічних речовин. Після того, як ви виконаєте свої завдання, ми будемо заповнювати таблицю, прослухавши ваші відповіді. Актуалізацією опорних знань ми завершимо тестування та зробимо висновки.
Завдання № 1 - 2 учні.
1. За нормальних умов – газ безбарвний, без запаху, майже вдвічі легший за повітря. У воді майже не розчинюється. У природі утворюється внаслідок гниття без доступу повітря рослинних решток. Його називають болотним та рудничним газом. Він становить основу атмосфери планет Юпітер та Сатурн.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Відносна густина за воднем 8. визначити молекулярну формулу речовини, якщо вона містить 25% Гідрогену та 75% Карбону.
Завдання № 2 – 2 учні.
1. Безбарвний газ, майже без запаху, малорозчинний у воді, трохи легший за повітря. У природі у вільному стані не зустрічається. Утворюється під час переробки нафти. Використовується для виготовлення пластмас. Прискорює дозрівання плодів (томатів, груш, лимонів).
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Визначити молекулярну формулу речовини, що містить 85,7% Карбону та 14,3% Гідрогену, а відносна густина за киснем 0,875.
Завдання № 3 – 2 учні.
1. Безбарвний газ, без запаху, малорозчинний у воді, легший за повітря, горить кипт’явим полум’ям, суміш з киснем вибуховонебезпечна. Використовується для різання та зварювання металів. Наприкінці ХІХ ст.. його почали використовувати для освітлення.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Відносна густина за повітрям 0,8966. визначити молекулярну формулу речовини, що містить 92,3% Карбону та 7,7% Гідрогену.
Завдання № 4 – 2 учні.
1. Рідина із специфічним запахом у воді практично не розчинюється, але є розчинником багатьох речовин. Горить сильнокиптявим полум’ям. Отруйна речовина, вдихання парів викликає запаморочення і головний біль. Ця речовина застосовується для синтезу барвників, виготовлення лікарських препаратів, пахучих та вибухових речовин.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Вивести молекулярну формулу органічної речовини, якщо масова частка Карбону – 92,3%, Гідрогену – 7,7%, а відносна густина за воднем – 39.
Завдання № 5 – 2 учні.
1. Рідина легша за воду має специфічний запах, змішується з водою у будь-яких відношеннях. Її одержують із чадного газу та водню. Дуже отруйна речовина, при потраплянні до організму 10 мл сприяє сліпоті, а 25 мл – викликає смерть.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. При спалюванні 4,8 г органічної речовини утворилось 3,36 л вуглекислого газу (н.у.) та 5,4 г води. Відносна густина по металу – 2. Обчислити молекулярну формулу речовини.
Завдання № 6 – 3 учні.
1. Безбарвна, сиропоподібна речовина, солодкувата на смак, важча за воду, добре розчиняється у воді, неотруйна. Вперше була добута у ХVIII столітті із маслинової олії і отримала назву „олійний цукор”. Її використовують у медицині, парфумерії, вичинюванні шкір, для виробництва вибухових речовин.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Визначити молекулярну формулу речовини, що містить 39,1% Карбону, 8,7% Гідрогену та 52,2% Оксигену, а відносна густина пари цієї речовини за воднем – 46.
3. Зробіть якісну реакцію на цю речовину. Спостереження опишіть. Напишіть відповідні рівняння реакцій.
Завдання № 7 – 3 учні.
- Безбарвна кристалічна речовина з різким характерним запахом. Під час зберігання поступово набуває рожевого забарвлення. Отруйна. Має сильні антисептичні властивості. Її використовували при операціях під час російсько-турецької війни (1877-1878 р) і це привело до зниження смертності після операцій.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Органічна речовина містить 76% Карбону, 6,4% Гідрогену та 17% Оксигену. Відносна густина за повітрям 3,24. Визначити молекулярну формулу.
3. Здійснити якісну реакцію на цю речовину, спостереження описати, дотримуючись правил ТБ.
Завдання № 8 – 3 учні.
1. Газ має специфічний запах, добре розчиняється у воді. Водний 40% - ний розчин називається формаліном. Застосовується для дезинфекції приміщень та для консервації анатомічних препаратів, як дубильний засіб.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. При згоранні 3,75 г органічної речовини утворилось 5,5 г вуглекислого газу і 2,25 г води. Відносна густина по водню 15. Обчислити молекулярну формулу речовини.
3. Здійснити якісну реакцію на цю речовину, спостереження описати, скласти рівняння відповідних реакцій.
Завдання № 9 – 3 учні.
1. За кімнатної температури безбарвна рідина з різким характерним запахом. При температурі нижче за 17°С кристалізується, тому її називають „крижаною”. Добре розчиняється у воді в будь-яких кількостях. Цю речовину використовують як консервант у харчовій промисловості, вона освітлює малюнок на тканині, з її допомогою зберігають м’ясо.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. На нейтралізацію органічної речовини масою 3,7 г витратили розчин об’ємом 5 мл з масовою часткою калій гідроксиду 40% та густиною 1,4 г/мл. Визначити формулу речовини.
3. Здійсніть якісну реакцію на кислотний залишок цієї речовини, а спостереження запишіть.
Завдання № 10 – 2 учні.
1. Леткі рідини, малорозчинні у воді, мають приємний запах. Містяться у квітах, фруктах, ягодах де визначають їхній специфічний запах. Бджолиний віск переважно складається з цих речовин. Застосовується для виробництва парфумів та фруктових есенцій.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. У результаті гідролізу жиру масою 44,33 г утворився гліцерин масою 5,06 г та одноосновна карбонова кислота. Визначити формулу жиру.
Завдання № 11 – 2 учні.
1. Позбавлений смаку білий порошок, нерозчинний у холодній воді, а в гарячій воді набрякає. Запасна поживна речовина рослин і є одним із продуктів фотосинтезу. Міститься у рисі, пшениці, кукурудзі.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Здійсніть якісну реакцію на цю речовину, а спостереження опишіть.
Завдання № 12 – 2 учні.
1. Тверда кристалічна речовина , добре розчинна у воді. Існує у всіх живих організмах. Людина одержує її у складі білкової їжі. Цей клас органічних речовин видатний український біохімік І.Я.Горбачевський сказав, що вони є „цеглинами” з яких побудовані білки.
Охарактеризувати клас речовин за планом:
а) назва класу, визначення;
б) загальна формула;
в) особливості будови;
г) особливості назви;
д) пояснення залежності властивостей речовин від їхньої будови.
2. Органічна речовина містить 32% Карбону, 6,67% Гідрогену, 42,67% Оксигену та 18,67% Нітрогену. Визначити молекулярну формулу речовини, якщо її молекулярна маса дорівнює 75 г/моль.
IV. Підбиття підсумків роботи в малих групах:
а) учні по черзі характеризують свій клас органічних речовин, складають таблицю;
б) здають розв’язок задачі вчителю;
в) здійснюють якісні реакції.
|
Гомологічний ряд |
Загальна формула |
Особливості будови |
Особливості назви |
|
Алкани (насичені вуглеводні) Алкени (етиленові вуглеводні Алкіни (ацетиленові вуглеводні) Арени (ароматичні вуглеводні) Насичені одноатомні спирти Багатоатомні спирти Феноли Альдегіди Одноосновні карбонові кислоти Складні естери Вуглеводні Амінокислоти |
|
|
|
- Тестування.
Мета: перевірити рівень знань про номенклатуру, характер міжкарбонових зв’язків, функціональні групи, властивості органічних речовин.
Тест №
1. Із розчином йоду утворює речовину синього кольору. а) ізомери;
2. Загальна формула насичених вуглеводнів. б) суфікс - ол;
3. Основні властивості амінокислот пояснюються функціональною групою. в) CnH2n+2;
4. Хімічні зв’язки між атомами Карбону в молекулі ацетилену. г) гліцерин;
![]() О
О
5. Сполуки, що мають однакову молекулярну формулу. д) CnH2n+1 - C
![]() Н
Н
6. Особливості назви одноатомних спиртів. е) - NH2 ;
7. Представником якого гомологічного ряду являється речовина C6H5OH. ж) етиловий спирт
8. Складні естери утворені триатомним спиртом. з) (C6H10O5)n
9. Загальна формула альдегідів. і) фенол
10.Внутрішньо молекулярна дегідратація характерна. к) потрійні
Тест №
1. Функціональна група альдегідів. а) суфікс – ан ;
2. Представником якого гомологічного ряду являється речовина
CH3 – CH – COOH. б) мурашина кислота;
![]()
CH3
3. Руйнування структури білка під дією деяких чинників. в) CnH2n+1COOH;
4. Загальна формула карбонових кислот. г) бромна вода;
5. Органічна речовина з двома функціональними групами. д) C12H22O11;
6. Якісна реакція на ненасичені вуглеводні. е) CnH2n;
7. Особливості назви насичених вуглеводнів. ж) денатурація
![]() O
O
8. Хімічні зв’язки між атомами Карбону в молекулі бензену. з) – C
![]() H
H
9. Молекулярна формула сахарози. і) карбонова кислота;
10.Загальна формула етиленових вуглеводнів. к) ароматичні
Тест №
1. Загальна формула ацетиленових вуглеводнів. а) – COOH;
2. Хімічні зв’язки між атомами Карбону в молекулі етилену. б) глюкоза;
3. Особливості назви альдегідів. в) целюлоза;
4. Стінки клітин рослин складаються в основному. г) одноатомний спирт;
5. Функціональна група карбонових кислот. д) фенол;
6. Якісна реакція на білки. е) CnH2n+1OH;
7. Альдегідоспиртом являється. ж) суфікс – аль;
8. Представником якого гомологічного ряду являється речовина
CH3 – CH2 – CH2 – OH . з) біуретова реакція;
9. Загальна формула одноатомних спиртів. і) подвійні;
10.Органічні сполуки, у молекулах яких гідроксильні групи зв’язані
з бензеновим ядром. к) CnH2n-2.
Тест №
1. Взаємодія з ферум (ІІІ) хлоридом, якісна реакція на. а) ферментативний гідроліз;
2. Особливості назви карбонових кислот. б) прості;
3. Піддається реакціям бродіння. в) алкан;
4. Загальна формула ароматичних вуглеводнів. г) фенол;
5. Представником якого гомологічного ряду являється речовина
CH3 – CH2 – CH3 . д) NH2 – CnH2n – COOH;
6. Загальна формула амінокислот. е) складні естери;
7. Які органічні речовини добувають реакцією естерифікації. ж) CnH2n-6;
8. Хімічні зв’язки між атомами карбону в молекулі етану. з) – OH;
9. Найважливіша хімічна властивість білків. і) C6H12O6;
10.Функціональна група спиртів. к) суфікс – ова.
VI. Узагальнення та систематизація знань.
В результаті роботи малих груп були встановлені такі причини розмаїтості органічних речовин:
а) Атоми карбону з’єднуються між собою, утворюючи різноманітні ланцюги: прості, розгалужені, циклічні.
- Напишіть структурні формули гексану і бензену.
б) Хімічні зв’язки між атомами Карбону бувають прості, кратні (подвійні і потрійні), ароматичні.
- Наведіть структурні формули етану, етилену, ацетилену, бензину.
в) Наявність функціональних груп.
- Наведіть формули таких речовин: метанол, метаналь, мурашина кислота, амінооцтова кислота.
г) Явище гомології.
- Наведіть формули і назви гомологів метану.
Д) Явище ізомерії – з однієї кількості атомів можуть утворитися різні за будовою і властивостями речовини.
_ Наведіть приклади ізомерів для пентану, дайте їм назви.
е) Здатність деяких органічних сполук з кратними зв’язками утворювати полімери.
- Напишіть рівняння полімеризації етилену.
Названі ознаки в сукупності зумовлюють існування великої кількості органічних сполук. Органічні сполуки здатні до взаємоперетворень. Взаємозв’язок між органічними речовинами полягає в тому, що за допомогою хімічних реакцій можна із сполук одного класу перейти до сполук іншого класу. Органічні речовини генетично пов’язані між собою і з неорганічними речовинами.
- Закріплення та систематизація нового матеріалу.
- Напишіть рівняння реакцій за допомогою яких можна здійснити такі перетворення:
Високий рівень:
а) Ca![]() A
A![]() Б
Б![]() В
В![]() Г
Г![]() Д
Д![]() Е
Е
б) СН4![]() А
А![]() Б
Б![]() В
В![]() Г
Г![]() Д
Д
Достатній рівень:
а) CH3 – CH3 ![]() CH3 - CH2Cl
CH3 - CH2Cl ![]() A
A ![]() CH2 = CH2
CH2 = CH2 ![]() (- CH2 – CH2 -)n .
(- CH2 – CH2 -)n .
![]() O
O
б) CH3 – CH2 - OH ![]() CH3 - C
CH3 - C ![]() CH3COOH
CH3COOH ![]() CH2ClCOOH
CH2ClCOOH ![]() CH2NH2COOH .
CH2NH2COOH .
![]() H
H
Середній рівень:
а) CH4 ![]() CH3Cl
CH3Cl ![]() CH3 – CH3
CH3 – CH3 ![]() CH2 = CH2
CH2 = CH2
б) (C6H10O5)n ![]() C6H12O6
C6H12O6 ![]() CH3 – CH2 - OH
CH3 – CH2 - OH ![]() CH3 - CH2Cl .
CH3 - CH2Cl .
- Залікова робота.
Мета: перевірити уміння учнів здійснювати перетворення, визначити тип та умови реакцій.
Здійсніть перетворення, вкажіть умови та тип реакцій.
Середній рівень.
1 варіант. CH4 ![]() CH
CH ![]() CH
CH ![]() CH2 = CH2
CH2 = CH2 ![]() CH
CH![]() - CH2 – OH
- CH2 – OH
2. варіант. C6H6![]() C6H5Cl
C6H5Cl ![]() C6H5OH
C6H5OH ![]() C6H5ONa .
C6H5ONa .
Достатній рівень.
1 варіант. CH3 - CH3 ![]() CH3 - CH2Cl
CH3 - CH2Cl ![]() CH3 - CH2 - OH
CH3 - CH2 - OH ![]() CH2 = CH2
CH2 = CH2 ![]() CH2 - CH2 .
CH2 - CH2 .
I I
![]() O Br Br
O Br Br
-
 варіант. CH3 – CH2 - OH
варіант. CH3 – CH2 - OH 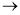 CH3 -
CH3 - 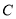
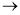 CH3 – COOH
CH3 – COOH 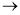 CH3COONa
CH3COONa 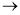 CH4 .
CH4 .
H
Високий рівень: скласти ланцюг з чотирьох перетворень
1 варіант - етиловий спирт ![]() амінооцтова кислота.
амінооцтова кислота.
2 варіант - ацетилен ![]() хлорид феніламонія.
хлорид феніламонія.
VII. Домашнє завдання:
Опрацювати §36. Виконати вправи 7, 8*.


про публікацію авторської розробки
Додати розробку
