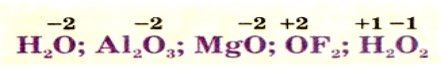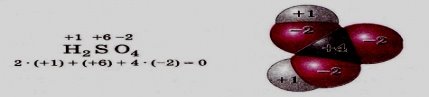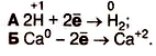Цикл уроків з розділу "Хімічні реакції"
1
ВІДДІЛ ОСВІТИ ТУЛЬЧИНСЬКОЇ РАЙДЕРЖАДМІНІСТРАЦІЇ
МЕТОДИЧНИЙ КАБІНЕТ
МИХАЙЛІВСЬКА ЗАГАЛЬНООСВІТНЯ ШКОЛА I-II СТУПЕНІВ
ЦИКЛ УРОКІВ З ТЕМИ «ХІМІЧНІ РЕАКЦІЇ»

З досвіду роботи
вчителя хімії Михайлівської ЗШ
Українець Олени В’ячеславівни
Тульчин -2017
Зміст програмного матеріалу за темою:
«ХІМІЧНІ РЕАКЦІЇ»
|
№ з п/п |
Тема уроку |
Домашнє завдання |
|
|
1 |
Класифікація хімічних реакцій за різними ознаками |
Вивчити § 13 |
|
|
2 |
Ступінь окиснення. Окисно – відновні реакції, їхнє значення. |
Вивчити § 14 |
|
|
3 |
Окислення та відновлення – дві протилежні сторони одного окисно – відновного процесу |
Вивчити § 14 |
|
|
4 |
Тепловий ефект реакції. Ендотермічні та екзотермічні реакції. Термохімічні рівняння |
Вивчити § 15 |
|
|
5 |
Швидкість хімічної реакції. Лабораторний дослід №5 |
Вивчити § 16 |
|
|
6 |
Узагальнення й систематизація знань з теми «Хімічні реакції» |
Вивчити § 13 -16 |
|
|
7 |
Тематичне оцінювання з теми «Хімічні реакції» |
Повторення матеріалу |
|
Мета теми :
навчальна - ввести поняття хімічна реакція, роз'яснити види хімічних реакцій, різницю між оборотними та необоротними реакціями, реакції розкладу, сполучення, заміщення та обміну, сформулювати поняття гідратація, ендотермічна та екзотермічна реакція, швидкість хімічної реакції.
розвивальна - розвивати ставлення в учнів цілісного наукового світогляду, загальнонаукової, загальнокультурної, технологічної, комунікативної і соціальної компетентності на основі засвоєння системи знань.
виховна - сформувати в учнів бажання і вміння вчитися, виховати потреби і здатності до навчання упродовж всього життя, вироблення умінь практичного і творчого застосування здобутих знань.
Під час вивчення даної теми учні повинні знати:
– види окисно-відновних реакцій
– види ендо - та екзотермічних реакцій
– визначати сутність поняття «тепловий ефект»
– про каталізатори, розглянути значення каталізаторів у техніці й житті людини
– класифікацію хімічних реакцій за різними ознаками
вміти:
відрізняти окисно-відновних реакції за їх рівняннями
визначати процеси окиснення і відновлення
складати електронний баланс для окисно-відновних реакцій
складати термохімічні рівняння реакцій та проводити за ними найпростіші обчислення
Підручник : Г.А .Лашевська. Хімія для 9 класу загальноосвітніх навчальних закладів. Київ,:Генеза,2009 – 280 с.
Урок 1

Тема. Класифікація хімічних реакцій за різними ознаками. Реакції сполучення, розкладу, заміщення, обміну.
Мета.
Навчальна:
узагальнити й систематизувати знання учнів про хімічні реакції;
розвивати вміння й навички визначення типів хімічних реакцій за рівнянням хімічних реакцій;
формувати знання учнів про хімічні рівняння на прикладі класифікації рівнянь за ознакою – кількість і склад реагентів. Розвивати навички й уміння складати рівняння хімічних реакцій; Сформувати уявлення про реакцію нейтралізації.
Розвивальна:
формувати навички розпізнавання типів реакцій теоретично за рівняннями реакції, експериментально – за ознаками хімічних реакцій;
формувати навички працювати в колективі; розвивати вміння порівнювати та робити висновки;
розвивати пізнавальну активність учнів, логічне мислення, пам'ять, увагу;
вдосконалювати вміння аналізувати, порівнювати, малювати схеми, виділяти головне;
Виховна:
виховувати працездатність, дисциплінованість, сприяти вихованню дотримання правил техніки безпеки при роботі з хімічними реактивами;
виховувати бережливе ставлення до власного здоров’я та оточуючих людей.
Тип уроку: урок засвоєння нових знань.
Форма уроку. Синтетична.
Місце уроку в навчальній темі. Перший у темі.
Методи і методичні прийоми:
1Інформаційно- рецептивний:
а)словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3.Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4. Візуальний: складання схем.
5. Динамічні рухи
Міжпредметні зв ́язки: медицина, біологія, географія.
Матеріали та обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів, таблиця «Класифікація хімічних реакцій», схеми, малюнки.
Для демонстрації дослідів: паперова стрічка з наклеєним магнієм, залізний цвях, купрум (ІІ) сульфат натрій гідроксид, хлорид на кислота, фенолфталеїн, свіже осаджений купрум (ІІ) гідроксид, порошки сірки і заліза, кристали калій перманганату, розчини: купрум (II) хлориду, барій хлориду, сульфатної кислоти; залізний цвях, скіпка, пробірки, корок з газовідвідною трубкою сірники, пробірки, тримач.
Основні поняття та терміни: хімічна реакція, хімічне рівняння, реакція сполучення, реакція заміщення, реакція розкладу, реакція обміну, реагенти, продукти реакції, реакції нейтралізації
|
знати |
вміти |
|
|
класифікацію хімічних реакцій за кількістю та складом реагентів і продуктів. . |
дає визначення основним типам хімічних реакцій; наводить приклади основних типів хімічних реакцій; розрізняє реакції сполучення, заміщення, обміну , розкладу; складає самостійно реакції сполучення, заміщення, обміну, розкладу. |
|
ХІД УРОКУ
|
Етап уроку |
Зміст уроку |
Дія учнів |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
І.
ІІ
ІІІ
ІV
V
VІ.
VІІ. |
Організаційний момент
1. Розминка Кожного дня ми з вами отримуємо масу інформації із навколишнього світу. Частина цієї інформації накопичується і зберігається у нашій пам’яті. Хороша пам’ять – запорука високих результатів у навчанні. Що треба зробити для покращення пам’яті? Насамперед треба запам’ятати головне – ніколи не скаржитись на свою пам’ять. У вас чудова пам’ять. І на сьогоднішньому уроці ми з вами у цьому переконаємося
Актуалізація опорних знань учнів
Хімічні реакції – це
Ознаки хімічних реакцій, це…
Хімічні реакції об’єднуються у групи:
Реакція сполучення – це…
Реакція між простою і складною речовинами, під час якої атоми простої речовини заміщують атоми (йони) у складній речовині, називається…
Реакція розкладу – це…
Реакція між двома складними речовинами, під час якої вони обмінюються своїми складовими частинами, це…
Заповнити схему класифікації хімічних реакцій
Встановити, яке твердження правильне, а яке ні: Вправа на інтерактивній дошці
Новий матеріал Проблемне питання
Розповідь супроводжується демонстрацією відеофрагментів хімічних реакцій
А +В = АВ Запропонуйте і запишіть реакції сполучення. Наприклад: Zn + S → ZnS CaO +H2O → Ca(OH)2
АВ → А +В Запропонуйте і запишіть реакції розкладу. Наприклад: (NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O Cu(OH)2 → CuO + H2O
А +ВС = АС + В Запропонуйте і запишіть реакції заміщення. Наприклад: Zn + 2HCl → ZnCl2 + H2 Fe + CuSO4 → FeSO4 + Cu
АВ +СD = АD + CВ Запропонуйте і запишіть реакції обміну. Наприклад: NaOH + HCl → NaCl + H2O CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Творче застосування знань, умінь, навичок Вправа на інтерактивній дошці Установіть відповідність між рівнянням реакції та типом хімічної реакції: Рівняння реакцій: Тип реакцій: : 1. 2НCl + Ca = CaCl2 + H2; А.Сполучення. 2. 2Fe + 3Cl2 = 2FeCl3; Б. Розкладу. 3. CuSO4 + 2NaOH= Cu(OH)2+ Na2SO4; В. Заміщення. 4. Zn + H2SO4 = ZnSO4 + H2; Г. Обміну. 5. 4Al + 3O2 = 2Al2O3; 6. CaCO3 = CaO + CO2. Демонстрація хімічних реакцій Перед учнями на демонстраційному столі стоять реактиви: залізний цвях, купрум (ІІ) сульфат, натрій гідроксид, хлоридна кислота, фенолфталеїн.
Запропонуйте реакції заміщення і обміну, які можливі між даними речовинами. Проведіть експеримент. Запишіть відповідні рівняння реакцій.
Можливий варіант відповіді учнів: Fe + CuSO4 → Cu + FeSO4 – реакція заміщення NaOH + HCl → NaCl + H2O – реакція обміну Fe + HCl → FeCl2 + H2 - реакція заміщення 2NaOH+CuSO4→Cu(OH)2 +H2O–реакція обміну
Робота учнів з картками Кожен учень отримає картку і завдання. В картку вкладається чистий аркуш паперу. Учні читають завдання. Відповідь позначають у вигляді хрестика у відповідній комірці.
І варіант
А – реакції сполучення. Б - реакції розкладу. В - реакції заміщення. Г - реакції обміну
Cu → CuO → CuCl2 →Cu(OH)2 → CuO → Cu.
ІI варіант
А – реакції сполучення. Б - реакції розкладу. В - реакції заміщення. Г - реакції обміну
Р → Р2О5 → Н3РО4 → Na3PO4 → Ca3(PO4)2
Підсумки уроку
Домашнє завдання Повторити §13 Підручник : Г.А .Лашевська. Хімія для 9 класу загальноосвітніх навчальних закладів. Київ,:Генеза,2009 – 280 с. Вправа 3 с. 84, Вправа 4, 5 с. 85 (всім обов’язково) Творче завдання: скласти кросворд із словами, що зустрічаються в темі «Типи хімічних реакцій»
Рефлексія
|
(Обговорення відповідей учнів)
Відповіді учнів
Робота у парах за допомогою таблиць та запитань.
Фронтальне опитування
Робота з підручником
По ходу пояснення учні складають опорні схеми
Робота в парах
Робота в парах
Індивідуальна робота |
Додаток до уроку №1
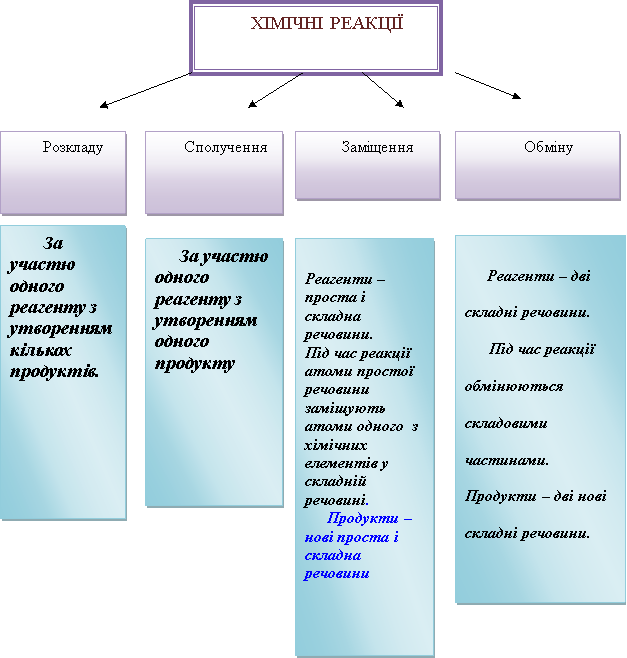
КЛАСИФІКАЦІЯ ХІМІЧНИХ РЕАКЦІЙ ЗА РІЗНИМИ ОЗНАКАМИ
![]()
![]()
![]() Хімічні реакції класифікують за різними ознаками
Хімічні реакції класифікують за різними ознаками
![]()
![]() Реакції розкладу (AB A + B)
Реакції розкладу (AB A + B)
Під дією електричного струму вода розкладається на кисень і водень:
![]()
![]()
![]() 2Н2О 2Н2 + О2
2Н2О 2Н2 + О2
![]() C2H5 Br C2H4 + HBr
C2H5 Br C2H4 + HBr
Електро́ліз – розклад речовин (напр., води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
Електроліз полягає в електрохімічних процесах окиснення та відновлення на електродах. При електролізі позитивно заряджені йони (катіони) рухаються до катода, на якому електрохімічно відновлюється. Негативно заряджені йони (аніони) рухаються до анода, де електрохімічно окиснюються. В результаті електролізу на електродах виділяються речовини 
в кількостях, пропорційних кількості пропущенного струму.
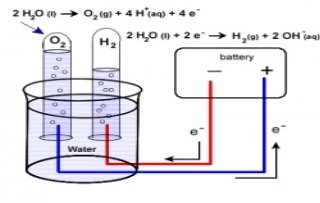
Електроліз води. Схематичне зображення
Реакції сполучення (A + B → AB)
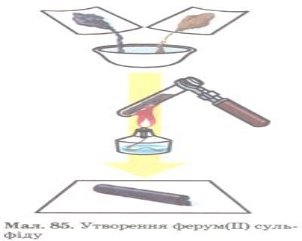 Протилежні реакціям розкладу. Вони можуть відбуватися за участю як молекул простих, так і молекул складних речовин. В результаті реакції утворюються молекули одної складної речовини.
Протилежні реакціям розкладу. Вони можуть відбуватися за участю як молекул простих, так і молекул складних речовин. В результаті реакції утворюються молекули одної складної речовини.
Наприклад :
-
 Fe + S FeS
Fe + S FeS
-
 Ca O + H2O Ca (OH)2
Ca O + H2O Ca (OH)2
-
 SO3 + H2O H2SO4
SO3 + H2O H2SO4
Гідратація- (взаємодія з водою) кислотних оксидів – приклад реакції сполучення за участю двох складних речовин.
![]() SO3 + H2O H2SO4
SO3 + H2O H2SO4
Реакції заміщення ( A + BC → B + AC)
Вивчали, досліджуючи взаємодію металів із кислотними та солями у розчинах. За допомогою ряду активності металів (починаючи від магнію кожний член ряду витісняє наступні з розчинів їхніх солей та водень з розчинів кислот) умієте спрогнозувати можливість перебігу цих реакцій. Приміром, алюміній витісняє водень з хлоридної кислоти. Натомість мідь, срібло, золото тощо стійкі до дії розчину кислот.
Реакція заміщення – реакція між простою і складною речовинами, у процесі якої атоми простої речовини заміщують атоми одного з елементів у складній речовині, внаслідок чого утворюються нова проста і нова складна речовини.
Zn + CuSO4 → Cu + ZnSO4
2 Al + 6 HCl → 2 AlCl3 + 3 H2 ↑
O2 (г) + HgS (тв) → Hg (г) + SO2 (г)
Реакції обміну (AB + CD → AD + CB)
Реакція обміну – це реакція, у процесі якої дві складні речовини обмінюються своїми складовими частинами.
Здебільшого відбуваються між електролітами у розчинах. Ці реакції проходять до кінця лише за певних умов. Загальний вигляд реакцій обміну, які ви вивчали, такий:
![]() Основний оксид + кислота сіль + вода.
Основний оксид + кислота сіль + вода.
![]() Кислотний оксид + луг сіль + вода.
Кислотний оксид + луг сіль + вода.
![]() Луг + кислота сіль + вода.
Луг + кислота сіль + вода.
![]() Нерозчинна основа + кислота сіль + вода.
Нерозчинна основа + кислота сіль + вода.
![]() Сіль + кислота сіль + кислота.
Сіль + кислота сіль + кислота.
![]()
![]() Сіль + луг сіль + основа ..
Сіль + луг сіль + основа ..

Реакція між калій йодидом (I) плюмбумом (II) нітратом (2) - у розчині утворюється яскраво жовтий осад плюмбуму(II)йодиду (3)
C2H5OH + HONO2 → C2H5ONO2 + H2O
BaCl2 + H2SO4 → BaSO4 + 2 HCl
CuCl2 + NaOH → Cu(OH)Cl ↓ + NaCl
Cu(OH)Cl + HCl → CuCl2 + HOH
NaOH (aq) + HCl (aq) → NaCl (aq) + HOH (р)
NaCl (aq) + AgNO3 (aq) → T ≈ 298 K, P ≈ 100 кПа NaNO3 (aq) + AgCl (тв)
![]()
![]()
Опорна схема «Класифікації хімічних реакцій»

![]()
ПІБ Дата Оцінка
Початковий рівень
1.Виберіть схему реакцій заміщення: (1 бал)
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
![]() А) СО + Сl2 COCI2;
А) СО + Сl2 COCI2;
![]() Б) CH4 C + 2H2
Б) CH4 C + 2H2
![]() В) MgO + НNO3 Mg (NO3)2 + H2
В) MgO + НNO3 Mg (NO3)2 + H2
![]() Г) MnO2 + Al AI2O3 + Mn.
Г) MnO2 + Al AI2O3 + Mn.
2.Встановіть відповідність між схемами хімічних реакцій та їхніми типами: (1 бал)
|
|
Схема реакцій |
Тип |
|
|
|
1. Реакції сполучення 2. Реакції заміщення 3. Реакції розкладу 4. Реакції обміну |
|
|
А |
Б |
В |
Г |
|
2 |
|
|
|
|
3.Виберіть реакцію, яка є різновидом реакції обміну: ( 1 бал)
А. Горіння кальцію
|
|
А |
Б |
В |
Г |
|
3 |
|
|
|
|
Б. Взаємодія хлору з воднем
В. Реакція нейтралізації
Г. Добування кисню з гідроген пероксиду
Середній рівень
4.Яка з речовин :натрій карбонат, аргентум (І) нітрат, нітратна кислота – взаємодіє з хлоридною кислотою з утворенням газу? Складіть відповідне рівняння реакції. Вкажіть тип реакції.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3 бали)
Достатній рівень
5. До складу антацидних (проти печії) лікарських препаратів «Маалокс» і «Алмагель» входять магній гідроксид і алюміній гідроксид. Складіть рівняння реакцій цих сполук із хлоридною кислотою – головного складовою шлункового соку. Класифікуйте реакції за кількість та складом реагентів і продуктів. Запишіть їхні рівняння у повній і скороченій йонній формах. Визначте, які йони у складі шлункового соку є причиною печії.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3 бали)  Урок 2
Урок 2
Тема: Ступінь окиснення. Окисно – відновні реакції, їхнє значення. Процеси окиснення,відновлення, окисники, відновники.
Мета.
Навчальна:
сформувати поняття про окисно-відновні реакції;
визначити місце окисно-відновних реакцій серед основних типів реакцій;
розглянути сутність процесів окиснення й відновлення та їхній взаємозв’язок;
ознайомити учнів з поняттями «окисник», «відновник»; розвивати вміння порівнювати та робити висновки;
розширити уявлення про хімічні реакції на прикладі реакцій окиснення й відновлення
Розвивальна:
формувати навички розпізнавання типів реакцій теоретично за рівняннями реакції, експериментально – за ознаками хімічних реакцій;
формувати навички працювати в колективі; розвивати вміння порівнювати та робити висновки;
розвивати пізнавальну активність учнів, логічне мислення, пам'ять, увагу;
вдосконалювати вміння аналізувати, порівнювати, малювати схеми, виділяти головне;
Виховна:
виховувати працездатність, дисциплінованість, сприяти вихованню дотримання правил техніки безпеки при роботі з хімічними реактивами;
виховувати бережливе ставлення до власного здоров’я та оточуючих людей.
Тип уроку: комбінований.
Форма уроку. Синтетична.
Місце уроку в навчальній темі. Другий у темі.
Методи і методичні прийоми:
1Інформаційно- рецептивний:
а)словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3.Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4. Візуальний: складання схем.
5. Динамічні рухи
Міжпредметні зв’язки: внутрішньоциклові: фізика, біологія, географія; між циклові: математика; міжтемні: «Періодична система хімічних елементів Д.І.Менделєєва. Будова атома», «Типи хімічних реакцій».
Матеріали та обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів, таблиця «Класифікація хімічних реакцій», схеми, малюнки, опорні конспекти.
Для демонстрації дослідів: реактиви: Zn, НСl, Н202, картопля, бенгальський вогонь, сірники.
Основні поняття та терміни: хімічні реакції, ступінь окиснення, окисник, відновник, окиснення, відновлення, окисно-відновні реакції, електронегативність.
|
знати |
вміти |
|
|
суть процесів окиснення і відновлення, їх взаємозв’язок і протилежність; -суть ОВР, їх місце у класифікації реакцій; суть методу електронного балансу.
|
дає визначення ступені окиснення, окисно – відновній реакції, процесам окиснення, відновлення, окиснику, відновнику; наводить приклади окисно – відновних реакцій; розрізняє окисно – відновні реакції та реакції без зміни ступеня окиснення; характеризує суть процесів окиснення і відновлення; визначає ступінь окиснення елементів за формулою речовини. |
|
ХІД УРОКУ
|
Етап уроку |
Зміст уроку |
Дія учнів |
|||||||||||||||||||||||||||
|
I.
II.
III.
IV. V.
VI.
VII.
VIII.
|
«Ступінь окиснення»
Вправа «Хрестики та нулики» Середній рівень: Закреслити речовини, які мають ступінь окиснення 0:
Достатній рівень: Закреслити речовини, в яких елементи мають ступінь окиснення +2:
Високий рівень: Закреслити речовини, в яких елементи мають ступінь окиснення +5:
У III столітті до н.е. на острові Родос був побудований пам'ятник у вигляді величезної статуї Геліоса (у греків Бог Сонця). Грандіозний задум і досконалість виконання Колоса Родоського - одного з чудес світу - вражали всіх, хто його бачив. (показ колоса на слайді). Ми зараз не можемо сказати, як виглядала статуя, але відомо, що вона була зроблена з бронзи і досягала у висоту близько 33 м. Статуя була створена скульптором Харетом, на її будівництво пішло 12 років. Бронзова оболонка кріпилась до залізного каркасу. Порожнисту статую почали будувати знизу і, у міру того як вона росла, заповнювали каменями, щоб зробити її стійкішою. Приблизно через 50 років після завершення будівництва Колос звалився. Під час землетрусу він зламався на рівні колін. Вчені вважають, що причиною недовговічності цього чуда стала корозія металу, а в основі процесу корозії лежать окисно-відновні реакції. Повідомлення теми та мети уроку. Вивчення нового матеріалу 1. Формування понять «окисно-відновні реакції», «окиснення», «відновлення», «окисник», «відновник» 1) Допишіть рівняння реакцій, визначте ступені окиснення елементів: Al + HCl → Al₂O₃ + HCl → 2) Евристична бесіда: 1. Який ви можете зробити висновок про зміну ступенів окиснення елементів в запропонованих рівняннях? 2. Як ви вважаєте, яка із запропонованих реакцій є окисно-відновною? 3. Сформулюйте поняття: «окисно-відновна реакція» (запис поняття) 4. Як ви вважаєте, з яких процесів складається окисно-відновна реакція? 5. За допомогою смайликів позначте процес окиснення та процес відновлення.
6. Які математичні знаки ви використаєте для позначення процесів окиснення та відновлення? 7. Сформулюйте поняття «процес окиснення» та «процес відновлення» (робота з підручником, запис поняття) 8. Які асоціації у вас пов’язані з поняттями «окисник», «відновник»? 9. Які математичні знаки ви використаєте для окисника та відновника? (робота з підручником, запис поняття)
Формування навичок визначення процесів окиснення та відновлення 1) Проаналізуйте запропоновані напівреакції електронного балансу, зробіть висновки про зміну ступенів окиснення в процесах окиснення та відновлення a) S? - 6ē → S⁶ б) S? +2ē → S⁻?
1. Які процеси відбувається в запропонованих варіантах? 2. Що відбувається зі ступенем окиснення в процесах окиснення та відновлення? Формулювання поняття (вставити слова) Якщо ступінь окиснення елемента в результаті реакції підвищується, то відбувається процес __________ (окиснення). Якщо ступінь окиснення елемента в результаті реакції знижується, то відбувається процес __________ (відновлення). Формування практичних навичок Вставити кількість приєднаних або відданих електронів, визначити процеси окиснення та відновлення, окисник та відновник.
а) N⁵ → N⁻? б) Mg? →Mg? в) N₂ → N? г) H? →H₂?
Складання електронного балансу окисно-відновних реакцій 1. Алгоритм складання електронного балансу ОВР. 2. Записати схему реакції. 3. Визначити ступені окиснення елементів в запропонованій реакції. 4. Визначити елементи, які змінюють ступені окиснення. 5. Скласти електронні рівняння. 6. Збалансувати кількість приєднаних та відданих електронів. 7. Визначити процеси окиснення та відновлення, окисник та відновник. 8. Розставити коефіцієнти в рівнянні. 1) Приклад (пояснення вчителя) Mg? + О₂? → Mg?О⁻? Mg? -2ē → Mg? 2 4 2 процес окиснення відновник О₂? +4ē → 2 О⁻? 4 1 процес відновлення окисник
2Mg? + О₂? → 2Mg?О⁻?
А) Na +H₂O → NaOH + H₂ Б) Zn + HCl → ZnCl₂ + H₂ B) KClO₃ → KCl + O₂
Опрацювати §14 Підручник : Г.А. Лашевська. Хімія для 9 класу загальноосвітніх навчальних закладів. Київ,:Генеза,2009 – 280 с., вивчити поняття, №. 1,2 (п.) Підсумки уроку
|
Фронтальна бесіда
Індивідуальна робота
Робота з підручником
Індивідуальна роботи
Евристична бесіда
Робота в парах
Індивідуальна робота
|
Додаток до уроку №2
ОКИСНО – ВІДНОВНІ РЕАКЦІЇ
О́кисно - відно́вна реакція ( оки́снювально-відно́вна реа́кція) - хімічна реакція, яка відбувається зі зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником та атомом-відновником.
У процесі окисно-відновної реакції відновник віддає електрони, тобто окиснюється; окисник приєднує електрони, тобто відновлюється. Причому будь-яка окисно-відновна реакція являє собою єдність двох протилежних перетворень - окиснення та відновлення, що відбуваються одночасно та без відриву одне від одного.
![]()
Окиснення: Речовина A як відновник віддає один електрон.
![]()
Відновлення: Речовина В як окисник приймає електрон.
![]()
Окисно-відновна реакція: Речовина А віддає електрон речовині В.
Види окисно-відновних реакцій
- міжмолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в різних молекулах, наприклад:
![]()
- внутрішньомолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в одній і тій ж самій молекулі, наприклад:
![]()
- репропорціонування (компропорціонування)
![]()
-
диспропорціонування (самоокиснення-самовідновлення) - реакції, в яких атоми одного елементу перетворюються на речовину (речовини) зі змінною ступенів окиснення, наприклад:
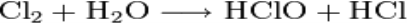
Сту́пінь окиснення - умовний електростатичний заряд, який приписують атому в молекулі, припускаючи, що електронні пари, які здійснюють зв’язок, повністю зміщені в бік більш електронегативних атомів (тобто припускаючи, що всі зв’язки даного атома мають 100% йонний характер).
Ступінь окиснення, на відміну від валентності, може мати позитивне, негативне, нульове і дробове значення. Це значення зі знаком плюс чи мінус перед арабською цифрою зазначається над символом елемента.
Наприклад: Н2+1O−2, або справа зверху від нього (в текстовому режимі): Н+12O−2.
Ступені окиснення позначаються у формулах речовин над символами елементів:

Ступінь окиснення у простих речовинах дорівнює нулю:
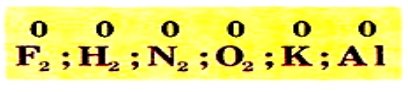
Максимальний позитивний ступінь окиснення елемента зазвичай дорівнює номеру групи, в якій він розміщений. Мінімальний (негативний) ступінь окисненнянеметалічного елемента дорівнює різниці між номером групи і числом вісім.Ступінь окиснення Гідрогену в сполуках з неметалічними елементами, зазвичай, становить + 1,а з металічними – -1:
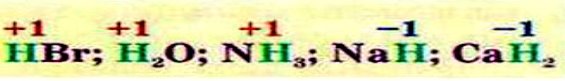
Флуор в усіх сполуках з іншими елементами має ступінь окиснення -1:
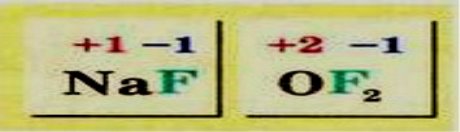
Оксиген практично в усіх сполуках з іншими елементами виявляє ступінь окиснення -2. Утім трапляються й сполуки, де цей елемент має ступінь окиснення -1. У сполуці з Флуором ступінь окиснення Оксигену +2:
Сума ступенів окиснення всіх атомів у сполуці дорівнює нулю (пересвідчіться у цьому на прикладі сульфатної та карбонатної кислот):
Окисно – відновні реакції супроводжуються переходом або зміщенням валентних електронів від атомів з меншою електронегативністю до атомів з більшою електронегативністю. З – поміж двох реакцій - взаємодія хлоридної кислоти з магнієм та магній оксидом – лише одна є окисно - відновною. Аби визначити, яка саме, запишімо їхні схеми й зазначмо ступені окиснення елементів.
0 +1 -1 +2 -1 0
![]()
![]() Mg + HCl Mg Cl2 + H2 Реакція магнію з хлоридною кислотою є окисно – відновною. Магній
Mg + HCl Mg Cl2 + H2 Реакція магнію з хлоридною кислотою є окисно – відновною. Магній
+2 -2 +1 -1 +2 -1 +1 -2 відновник,Гідроген – окисник.
![]() MgO + HCl Mg Cl2 + H2O
MgO + HCl Mg Cl2 + H2O
Процес втрати електронів атомом називається - окиснення, а процес приєднання електронів – відновленням. Атоми або йони, які приєднують електрони, - називаються окисниками, а ті, які віддають електрони, - відновниками.
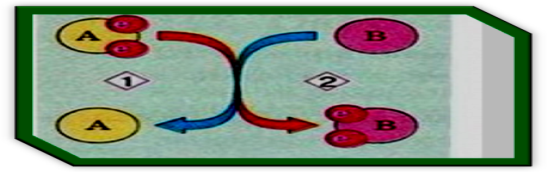
Окисно – відновний процес: 1) Окиснення: відновник А втрачає електрони і окиснюється
2) Відновлення: окисник В приєднує електрони і відновлюється
Зміна ступенів окиснення хімічних елементів (чи їхня незмінність) - одна з ознак, за якими класифікують хімічні реакції.
![]()
ПІБ________________________________ Дата____________ Оцінка____________
Початковий рівень
 1.Виберіть записи процесів окиснення: (1 бал)
1.Виберіть записи процесів окиснення: (1 бал)
2. Ступінь окиснення Оксигену найчастіше: (1 бал)
|
|
А |
Б |
В |
Г |
|
2 |
|
|
|
|
|
|
А |
Б |
В |
Г |
Д |
|
1 |
|
|
|
|
|
а) +4 б) +6 в) -2 г) +1
|
|
А |
Б |
В |
Г |
Д |
|
3 |
|
|
|
|
|
3. Можливі ступені окиснення Sn: (1 бал) а) -2, +4, +6 б) +2, +3 в) –1, +1; г) –4, +2, +4; д) –3, +3, +5.
Середній рівень
4. Визначте окисно-відновні рівняння : (1.5 бали)
a) SnO2 + K2O → K2SnO4 ; б) N2 + 3H2 → 2NH3 ; в ) 2CO + O2 →2CO2
5. Виберіть записи процесів, у яких Манган - окисник: (1.5 бали)
![]()
Достатній рівень
6. Запишіть механізм утворення зв’язку у речовинах: а) Br2; б) ScF3; в) CaS
(3 бали)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Урок 3
 Тема. Окиснення та відновлення – дві протилежні сторони одного окисно – відновного процесу. Значення окисно-відновних реакцій у природі, техніці, побуті.
Тема. Окиснення та відновлення – дві протилежні сторони одного окисно – відновного процесу. Значення окисно-відновних реакцій у природі, техніці, побуті.
Мета
Навчальна:
розкрити роль окисно-відновних реакцій у природі, техніці, побуті;
удосконалити вміння визначати ступінь окиснення за формулою речовини;
закріпити навички складання електронного балансу та підбору коефіцієнтів для рівнянь окисно-відновних реакцій.
Розвивальна:
формувати навички працювати в колективі; розвивати вміння працювати парами;
виховувати творче ставлення до практичного використання знань з хімії;
формувати життєві компетенції звивати вміння порівнювати та робити висновки;
розвивати пізнавальну активність учнів, логічне мислення, пам'ять, увагу;
вдосконалювати вміння аналізувати, порівнювати, малювати схеми, виділяти головне;
Виховна:
виховувати працездатність, дисциплінованість, сприяти вихованню дотримання правил техніки безпеки при роботі з хімічними реактивами;
виховувати бережливе ставлення до власного здоров’я та оточуючих людей.
Тип уроку: урок засвоєння знань, умінь і навичок і творчого застосування і їх на практиці.
Форма уроку. Синтетичний з домінуванням евристичного методу навчання.
Місце уроку в навчальній темі. Третій у темі.
Методи і методичні прийоми:
1Інформаційно- рецептивний:
а)словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3.Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4. Візуальний: складання схем.
5. Динамічні рухи
Міжпредметні зв’язки: медицина, біологія, географія, фізика.
Матеріали та обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів, таблиця «Класифікація хімічних реакцій», схеми, малюнки, опорні конспекти.
Для демонстрації дослідів: реактиви: Zn, НСl, Н202, картопля, бенгальський вогонь, сірники.
Основні поняття та терміни: хімічні реакції, ступінь окиснення, окисник, відновник, окиснення, відновлення, окисно-відновні реакції, електронегативність.
|
знати |
вміти |
|
|
суть процесів окиснення і відновлення, їх взаємозв’язок і протилежність; суть ОВР, їх місце у класифікації реакцій; суть методу електронного балансу.
|
дає визначення ступені окиснення, окисно – відновній реакції, процесам окиснення, відновлення, окиснику, відновнику; наводить приклади окисно – відновних реакцій; розрізняє окисно – відновні реакції та реакції без зміни ступеня окиснення; характеризує суть процесів окиснення і відновлення; визначає ступінь окиснення елементів за формулою речовини. |
|
ХІД УРОКУ
|
Етап уроку |
Зміст уроку |
Дія учнів |
|
I. II.
III.
IV
V.
VI.
VII.
|
Організаційний момент Актуалізація опорних знань, умінь та навичок.
Метод «Мікрофон» – повторення основних питань з теми «Ступінь окиснення». а) Що таке ступінь окиснення (СО)? б) Від чого залежить, який СО елемента у сполуці? в) Що таке електронегативність? г) СО атома елемента F, О, Н? д) СО елементів-металів, неметалів? е) СО атомів елементів у простих речовинах? є) Чому дорівнює алгебраїчна сума СО елементів у сполуці? ж) Як правильно записується значення СО? з) Як змінюється СО атома при віддаванні електронів? и) Як змінюється СО атома при прийманні електронів?
Виконання завдань за схемою «Два-чотири-всі разом».
P2O5, N2O, NH3, KClO3, Na2Cr2O7, KMnO4, Ca3(PO4)2
+1 -2, -3 +1, +1 -2, +3 -2, +2 -2, +1 +4 -2, +1 +6 -2 NaO, PH, HS, AlO, CuO, HCO, HSO.
а) виконайти дослід із заданою парою речовин, проведіть спостереження; б) чи відбувається хімічна реакція між заданою парою речовин? за якими ознаками? в) запишіть рівняння реакції, визначіть ïï тип та СО елементів усіх речовин.
I група – Zn і HCl ІІІ група – Na2CO3 і HCl ІІ група – Mg і H2SO4 IV група – Cu і HCl
а) Чи змінюється СО атомів елементів до і після реакції? б) Чи відображає це тип реакції (сполучення, заміщення, розкладу, обміну)? (Учні роблять висновок, що класифікація хімічних реакцій за складом і кількістю речовин неповна і не виявляє глибинних змін у речовинах).
Мотивація навчальної діяльності учнів, повідомлення теми та мети уроку На планеті Земля постійно відбуваються хімічні перетворення. Окисно-відновні процеси належать до числа найбільш розповсюджених хімічних реакцій і мають величезне значення в теорії і практиці. Окисно-відновні процеси - одні з найважливіших процесів природи.
Вивчення нового матеріалу Значення окисно-відновних реакцій Перша група: значення окисно-відновних процесів в природі. Друга група: значення окисно-відновних реакцій в житті людини. Третя група: значення окисно-відновних реакцій в техніці.
Перша група Окисно-відновні реакції у природі: 1. Фотосинтез: 6CO2 + 6H2O = C6H12O6 + 6O2 2. Процеси травлення: C6H12O6 + 6O2 = 6CO2 + H2O 3. Вулканічна діяльність: H2S + O2 = 2H2O + 2S 4. Блискавка: N2 + O2 = 2NO Друга група -Окисно-відновні реакції у побуті: 1. Горіння вугілля, природного газу: CH4 + O2 = CO2 + 2H2O 2. Горіння сірника: 4Р + 5O2 = 2Р2O5 3. Горіння бенгальського вогню: 2Mg + O2 = 2MgO 4. Виготовлення фотокарток: 2AgBr = 2Ag + Br2 Третя група Окисно - відновні реакції у техніці: 1. Корозія заліза: 4Fe + 3O2 = 2Fe2O3 2. Горіння вугілля: C + O2 = CO2 3. Газозварювання: 2C2H2 + 3O2 = 2CO2 +2H2O 4. Металургія ( виробництво чавуну): Fe2O3 + 3C = 2Fe + 3CO 5. Космос (добування кисню для дихання на космічних кораблях): 4KO2 + 2CO2 = 2K2CO3 + 3O2
4FeS2 + 11O2 = 8SO2 + 2Fe2O3 2SO2 + O2 = 2SO3
4NH3 + 5O2 = 4NO + 6H2O 2NO + O2 = 2NO2 4NO2 + 2H2O + O2 = 4HNO3 Узагальнення та систематизація знань.
Al+ HCl→AlCl3+H2 FeCl3+H2S→FeCl2+HCl+S Fe+ HCl→FeCl2+H2 HI+H2SO4→I2+H2S+H2O HgO→ Hg+ O2 K+H2SO4→K2SO4+H2S+H2O 7. У якій сполуці Карбон проявляє ступінь окиснення +2 а) CH4; б) CO; в) CO2; г) K2CO3? 8. Визначіть ступінь окиснення Хлору в сполуках: KCl, KClO, KClO2, KClO4, KClO3. 9.Оксид хімічного елемента I групи головної підгрупи має відносну молекулярну масу 62. Назвіть елемент, складіть формулу його оксиду і гідроксиду.
Підсумок уроку Дайте відповідь на проблемне питання : «Що було б у світі без окисно-відновних реакцій?» 1. Чи досягли ми поставлених цілей? 2. Над чим потрібно ще працювати?
Домашнє завдання Повторити §14 Г.А. Лашевська «Хімія 9 клас», вправа 8,9,10. ст.109, вивчити значення окисно – відновних реакцій. Записати два окисно – відновні рівняння, де реагентом виступає вода, та урівняти їх методом електронного балансу. |
Фронтальна бесіда
Індивідуальна робота Взаємоперевірка
Робота в парах Перевірка за зразком Повторення правил ТБ З кожної групи один учень записує на дошці рівняння реакції і дає пояснення.
Робота в групах з підручником та додатковою літературою про значення окисно-відновних реакцій (отримують картки з завданням)
Виступи учнів
Питання до учнів Самостійна робота учнів.
|
Додаток до уроку №3
ОКИСНЕННЯ ТА ВІДНОВЛЕННЯ – ДВІ ПРОТИЛЕЖНІ СТОРОНИ ОДНОГО ОКИСНО – ВІДНОВНОГО ПРОЦЕСУ
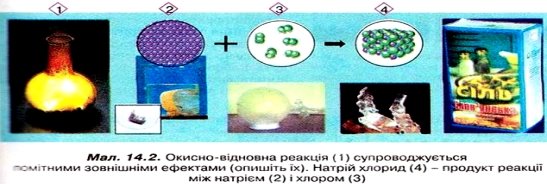
Окиснення та відновлення - дві протилежні сторони одного окисно-відновного процесу. Кількість електронів, які приймає окисник, дорівнює кількості електронів, які віддає відновник, - існує електронний баланс. Методом електронного балансу добирають коефіцієнти в окисно-відновних реакціях. Розгляньмо це докладніше на прикладі реакції між натрієм і хлором (мал. 14.2).
Позначимо ступені окиснення хімічних елементів у реагентах і продуктах реакції: ![]()

Вочевидь, Натрій і Хлор змінили ступені окиснення, тож складемо схеми переходу електронів. Кількість відданих і приєднаних електронів запишемо за вертикальною рискою праворуч. Аби дотримати електронного балансу, обчислимо найменше спільне кратне для кількості відданих і приєднаних електронів: воно дорівнює двом. Запишемо найменше спільне кратне після другої вертикальної риски. Діленням найменшого спільного кратного на кількості відданих і приєднаних електронів дістанемо додаткові множники, які будуть коефіцієнтами перед відповідними формулами у хімічному рівнянні. Позначемо після третьої вертикальної риски окисник і відновник, а після четвертої процеси окиснення і відновлення. Доберемо решту коефіцієнтів: Оскільки ця реакція відбувається у розчині, маємо підстави записати рівняння у йонному вигляді:

Cu0 + 2Ag+ + 2N![]() O = 2Ag0 + Cu2+ + 2NO
O = 2Ag0 + Cu2+ + 2NO![]() Cu0 + 2Ag+ = 2Ag0 + Cu2+
Cu0 + 2Ag+ = 2Ag0 + Cu2+
Отже, суть цієї окисно-відновної реакції - окиснення атомів Купруму катіонами Аргентуму(І) (або відновлення катіонів Аргентуму(І) атомами Купруму).
![]()
![]()
![]() ПІБ Дата Оцінка
ПІБ Дата Оцінка
Початковий рівень
1.За малюнком розгляньте з точки зору окиснення – відновлення реакцію заліза з купрум (II) сульфатом у розчині. Виберіть окисник у цій реакції: А )Fе0; Б) Сu0; В ) Fе+2; Г )Сu+2
(1 бал)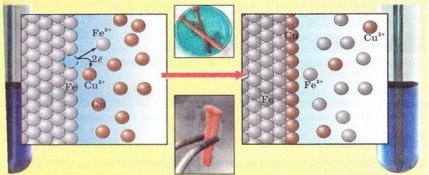
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
|
А |
Б |
|
2 |
|
|
2. На у схемі Ва0 – 2е → Ва+2 є: а) відновником; б) окисником. (1 бал)
3. У СО2 атом С може проявляти властивості: (1 бал)
|
|
А |
Б |
В |
|
3 |
|
|
|
а) тільки відновника; б) окисника та відновника; в) тільки окисника.
Середній рівень (3 бали)
4.Перетворіть, використовуючи метод електронного балансу, схему реакції на хімічне рівняння
Н2S + О2 → SО2 + Н2О.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Достатній рівень (3 бали)
5.Перетворіть схеми реакцій на хімічні рівняння, використовуючи метод електронного балансу:
А. Р + О2→ Р2О5; Б. Р + КСlOз → Р2О5 + KCl; В. S + КСlO3 → KCl + SО2↑
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Значення окиснення і відновлення.
Окисно-відновні процеси належать до числа найбільш розповсюджених хімічних реакцій і мають величезне значення в теорії і практиці. Окисно-відновні процеси - одні з найважливіших процесів природи, їх ще називають окисно-відновними реакціями (ОВР)
Значення окисно-відновних реакцій
І. Значення окисно-відновних реакцій в біосистемах
- дихання;
- фотосинтез;
- травлення;
- обмін речовин і енергії.
ІІ. Значення окисно-відновних реакцій в природі:
- грозові розряди;
- виверження вулканів;
- процеси гниття та інші.
ІІІ. Значення окисно-відновних реакцій в хімічному виробництві:
- одержання металів, галогенів, лугів тощо.
- одержання органічних речовин.
- очищення стічних вод, газових викидів підприємств.
- виробництво лікарських препаратів;
- виробництво предметів побуту та інше.
ІV. Значення окисно-відновних реакцій в побуті :
- Корозія металів;
- Потемніння срібних виробів;
- Хімічна завивка волосся;
- Вироблення кисломолочних продуктів;
- Горіння бенгальського вогню;
- Горіння сірників;
- Горіння пропану, бутану в газовій плиті;
- Відбілювання і дезінфекція.
![]()
П.І.Б._________________________________ Дата_______ Оцінка ________
Початковий рівень (1 бал)
1. Виберіть запис, який відповідає процесу окиснення:
2. Виберіть відновник у реакції між цинком і розбавленою сульфатною кислотою:
А. Н+ Б .S+6 В .Zn° Г. O-2.
3. Виберіть загальне число приєднаних електронів в електронному балансі реакції,
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
схема якої С + 02 → С02
А .1 Б. 2 В. 3 Г .4.
Середній рівень………………………………. ( 3 бали)
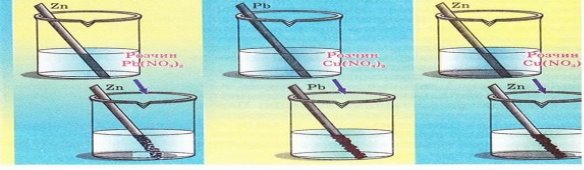
4. Опишіть перебіг хімічних реакцій, схематично зображених на малюнку. Поясніть спостережувані зовнішні ефекти, розглянувши реакції з точки зору окиснення-відновлення. Запишіть у повному та скороченому йонному вигляді відповідні хімічні рівняння.
______________________________________________________________________________________________________________________________________________________
Достатній рівень ( 3 бали)
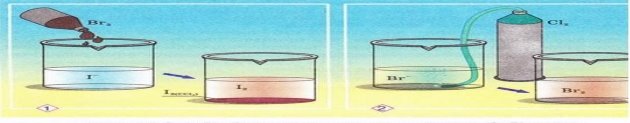
5. За схематичними зображеннями на малюнку визначте, у якій з реакцій Бром є відновником. За таблицею розчинності визначте, йодиди й броміди яких саме металічних елементів можна використати у цій реакції. Складіть хімічні рівняння обох реакцій, розгляньте їх з точки зору окиснення-відновлення, запишіть у повному й скороченому йонному вигляді. Поясніть, чого після закінчення реакції (1) до її продуктів добавили неполярний чинник ССІ4.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Урок 4
 Тема. Тепловий ефект реакції. Екзотермічні та ендотермічні реакції. Термохімічні рівняння.
Тема. Тепловий ефект реакції. Екзотермічні та ендотермічні реакції. Термохімічні рівняння.
Мета.
Навчальна:
розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій;
ознайомити учнів з поняттями «тепловий ефект хімічної реакції», «термохімічні рівняння»;
удосконалювати навички розв’язування розрахункових задач;
формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням.
Розвивальна:
формувати навички працювати в колективі; розвивати вміння працювати парами;
виховувати творче ставлення до практичного використання знань з хімії;
формувати життєві компетенції звивати вміння порівнювати та робити висновки;
розвивати пізнавальну активність учнів, логічне мислення, пам’ять, увагу;
вдосконалювати вміння аналізувати, порівнювати, малювати схеми, виділяти головне;
Виховна:
виховувати працездатність, дисциплінованість, сприяти вихованню дотримання правил техніки безпеки при роботі з хімічними реактивами;
виховувати бережливе ставлення до власного здоров’я та оточуючих людей.
Тип уроку: комбінований урок.
Форма уроку. Синтетичний з домінуванням евристичного методу навчання.
Місце уроку в навчальній темі. Четвертий у темі.
Методи і методичні прийоми:
1Інформаційно- рецептивний:
а)словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3.Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4. Візуальний: складання схем.
5. Динамічні рухи
Міжпредметні зв ́язки: медицина, біологія, географія, фізика.
Матеріали та обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів, таблиця «Класифікація хімічних реакцій», схеми, малюнки, опорні конспекти.
Основні поняття та терміни: хімічні реакції, енергетичний ефект хімічних реакцій, внутрішня енергія, реакції: ендотермічні, екзотермічні, термохімічні рівняння, тепловий ефект реакції.
|
знати |
вміти |
|
|
- що таке хімічне рівняння; - які зовнішні ефекти свідчать про перебіг хімічних реакцій; - що таке внутрішня енергія та які способи її можна змінити; у чому суть закону збереження енергії; як повязані енергія та робота, кінетична і потенціальна енергія; чим зумовлені теплові ефекти під час розчинення й кристалізації; - що таке теплота згорання палива; - що таке екзо – та ендотермічні реакції; - що таке тепловий ефект реакції; - яке значення енергії та енергозберігаючих технологій у житті людини.
|
дає визначення тепловому ефекту, екзо та ендотермічним реакціям; наводить приклади термохімічних рівнянь; розрізняє екзо та ендотермічні реакції ; застосовує поняття тепловий ефект реакції; складає термохімічні рівняння. |
|
ХІД УРОКУ
|
Етап уроку |
Зміст уроку |
Дія учнів |
|
I. II.
III.
IV
V.
VI.
VII.
VIII.
|
Організаційний момент Актуалізація опорних знань, умінь та навичок. Завдання «Відновіть сторінки зошита». До нас звернувся учень зі своєю проблемою: «Я знайшов старий зошит з хімії моєї сестри, який я порвав, коли був малим. Учитель завжди говорить, що зошити з хімії слід зберігати. А зараз мені потрібно відновити порвані сторінки. Хто мені допоможе?» Закінчіть… та складіть… баланс. … ZnO + SO2 FeO + Al … (Учитель пропонує учням відновити записи в зошиті та допомогти учневі - закінчити рівняння реакцій і скласти електронний баланс).
Мотивація навчальної діяльності учнів, повідомлення теми та мети уроку Під час хімічних реакцій зберігається число атомів, їхня маса, але змінюються хімічні зв’язки між атомами: одні руйнуються (при цьому енергія витрачається), інші виникають (при цьому енергія вивільняється). В результаті реакції тепло виділяється або поглинається. Саме за цією ознакою реакції поділяються на екзотермічні і ендотермічні. Познайомимося докладніше з цією класифікацією.
Вивчення нового матеріалу
Тепловий ефект реакції – кількість теплоти, що виділяється чи поглинається під час хімічних реакції. 2. Тепловий ефект позначається: а) Q – показує скільки теплоти (в кДж) виділилося або поглинулося під час реакції; б) ∆ Н – показує різницю між вмістом енергії у вихідних речовинах і кінцевих продуктах (ентальпія) ∆ Н = - Q 3. Тепловий ефект вимірюється в Дж або в кДж 4. Знайдіть в підручнику як називаються хімічні реакції, в яких зазначається тепловий ефект реакції? Хімічні рівняння, в яких зазначено кількість теплоти, що виділяється або поглинається, називаються термохімічними рівняннями. Пояснення схеми з демонстраціями дослідів: А) горіння магнію – екзотермічна реакція (Підпалюємо магнієву стрічку. Реакція супроводжується виділенням світла і теплоти. Запишіть рівняння реакції:2Mg +O2 =2MgO б) розклад малахіту – ендотермічна реакція (Насипаємо у пробірку малахіт, закриваємо корком з газовідвідною трубкою, кінець якої занурюємо в стакан з вапняною водою. Нагріваємо. Вапняна вода помутніла, бо під час реакції виділився вуглекислий газ; у пробірці зелений колір змінився на чорний – це утворився купрум (II) оксид; на стінках пробірки з’явилися крапельки води). Запишіть рівняння реакції: Cu2(OH)2CO3= 2CuO +CO2↑ +H2O
Теплота, яка виділяється або поглинається під час хімічної реакції, називається тепловим ефектом реакції. Тепловий ефект показує різницю між вмістом енергії у вихідних речовинах і продуктах реакції. Хімічні рівняння, у яких зазначено тепловий ефект реакції, називаються термохімічними. Тепловий ефект реакції позначається ∆Н (ентальпія) і записується окремо від хімічного рівняння, після крапки з комою. Його одиницею вимірювання є кДЖ. Якщо теплота поглинається, то ∆ Н має знак «-» , а якщо поглинається – «+». Робота з графіками: Розгляньте мал.53, 54 підручника і дайте відповідь на питання: як змінюється вміст енергії у вихідних речовинах і продуктах реакції під час екзо- і ендотермічної реакції?
Обчислення за термохімічними рівняннями №1. Скільки тепла виділиться в результаті спалювання 18г вугілля? С + О2 → СО2 +410 кДж Розв’язок: Дано: 18 г Х кДж
12 г Q - ? 18 Х 18∙ 410
12 410 12
Відповідь: Q = 615 кДж
№2. У результаті взаємодії алюмінію масою 9 г з киснем виділилося 274,44 кДж теплоти. Скласти термохімічне рівняння. Розв’язок:
m(Аl) = 9 г 4Аl + 3О2 → 2Al2О3 +Х кДж Q = 274,44 кДж 4∙27 г
∆Н - ? 9 274,44 4∙27 ∙ 274,44
4*27 Х 9
Відповідь: 4Аl + 3О2 → 2Al2О3 +3293,28 кДж
Узагальнення та систематизація знань.
1. Укажіть тип хімічних реакцій (за знаком теплового ефекту): N2 + O2 = 2NO – 90,4 кДж (Ендотермічна.) CaCO3 = CaO + CO2 – 157 кДж (Ендотермічна.) 2NO + O2 = 2NO2 + 116 кДж (Екзотермічна.) 2CO + O2 = 2CO2; Q = –566 кДж (Екзотермічна.) 2HBr = Н2 + Вr2; Q = +72 кДж (Ендотермічна.) № 2. При згорянні Карбону (у вигляді графіту) кількістю речовини 1 моль виділяється 394 кДж теплоти. Запишіть термохімічне рівняння реакції. Як змінюється внутрішня енергія речовин у процесі реакції? (Відповідь: С + О2 = СО2 + 394 кДж.)
№3. Яка маса металу утвориться, якщо для розкладу меркурій оксиду витратилося 33,4 кДж теплоти? 2HgO →2Hg + O2 ─ 167кДж.
Розв’язок:
Q = -33,4 кДж 2HgO →2Hg + O2 ─ 167кДж.
m(Hg) -? Х 33,4 2∙201 ∙ 33,4
2∙201 167 167
Відповідь: m(Hg) = 80,4г
Підсумок уроку Дайте відповідь на проблемне питання : «Що було б у світі без окисно-відновних реакцій?» 1. Чи досягли ми поставлених цілей? 2. Над чим потрібно ще працювати?
Рефлексія Продовж речення: -Сьогодні я довідався… - Було цікаво… - Я зрозумів, що… - Тепер я можу… - Мене здивувало…
Домашнє завдання Повторити §14 Г.А. Лашевська «Хімія 9 клас», вправа 8,9,10. ст.109, вивчити значення окисно – відновних реакцій. Записати два окисно – відновні рівняння, де реагентом виступає вода, та урівняти їх методом електронного балансу. |
Самостійна робота Взаємоперевірка
Робота з підручником
Індивідуальна робота
Робота в парах. Повторення правил ТБ З кожної пари один учень записує на дошці рівняння реакції і дає пояснення. Заповнення опорної схеми
Робота в групах з підручником
Розв’язування задач
Питання до учнів Самостійна робота учнів.
|
Додаток до уроку 4
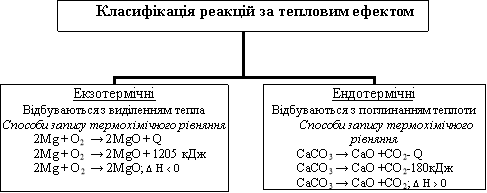
 КЛАСИФІКАЦІЯ ХІМІЧНИХ РЕАКЦІЙ ЗА ТЕПЛОВИМ ЕФЕКТОМ. ТЕРМОХІМІЧНЕ РІВНЯННЯ
КЛАСИФІКАЦІЯ ХІМІЧНИХ РЕАКЦІЙ ЗА ТЕПЛОВИМ ЕФЕКТОМ. ТЕРМОХІМІЧНЕ РІВНЯННЯ
Вивчаючи природознавство та фізику, ви дізналися про хімічну, електричну, механічну, ядерну, сонячну форми існування енергії. Відповідно до різних форм енергії по-різному виявляються й енергетичні ефекти хімічних реакцій. Пригадаймо, розкласти воду на водень і кисень можна електролізом. Потрібна для цього електрична енергія виділяється внаслідок перебігу окисно-відновних реакцій під час роботи акумулятора. Згоряння магнію супроводжується виділенням теплової та світлової енергії. А розкладання хлориду й броміду Аргентуму(І) у фотографічному процесі відбувається з поглинанням світлової енергії. Також унаслідок перебігу хімічних реакцій може виконуватись механічна робота - наприклад, під час вибуху або роботи двигуна внутрішнього згоряння.
Усі ці факти доводять існування внутрішньої енергії, яка «прихована» в речовинах і вивільняється під час хімічних процесів. Тобто хімічні х акції супроводжуються зміною не тільки складу й будови речовин, а й зміною їхньої внутрішньої енергії. Енергію, виділену або поглинуту системою під час перебігу в ній хімічної реакції, називають енергетичним ефектом реакції. Він становить різницю між внутрішньою енергією реагентів і продуктів реакції
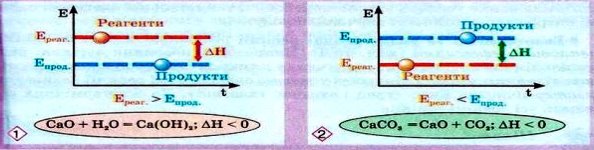
Екзо- (1) та ендо- (2) термічні реакції
 Часто внаслідок перетворення одних речовин на інші виділяється або поглинається теплова енергія, її кількість (позначають ΔН, вимірюють у Дж, кДж тощо) називають тепловим ефектом хімічної реакції. Він залежить від природи реагуючих речовин, їхньої кількості та агрегатного стану, тиску тощо. Тому з метою стандартизації теплові ефекти зазначають для температури 25°С і тиску 0,101 мПа. Теплові ефекти визначають експериментально в спеціальних приладах - калориметрах. На практиці обчислюють теплові ефекти для оцінювання теплоти згоряння речовин, теплотворної здатності палива, енергетичної цінності харчових продуктів.
Часто внаслідок перетворення одних речовин на інші виділяється або поглинається теплова енергія, її кількість (позначають ΔН, вимірюють у Дж, кДж тощо) називають тепловим ефектом хімічної реакції. Він залежить від природи реагуючих речовин, їхньої кількості та агрегатного стану, тиску тощо. Тому з метою стандартизації теплові ефекти зазначають для температури 25°С і тиску 0,101 мПа. Теплові ефекти визначають експериментально в спеціальних приладах - калориметрах. На практиці обчислюють теплові ефекти для оцінювання теплоти згоряння речовин, теплотворної здатності палива, енергетичної цінності харчових продуктів.
Електротермометр (1) та Калориметр (2)
Екзотермічні та ендотермічні реакції розрізняють саме за їхніми тепловими ефектами (мал. 15.1). Наприклад, згоряння вугілля, нейтралізація кислот лугами, сполучення цинку із сіркою супроводжуються виділенням значної кількості теплової енергії. Такі реакції називають екзотермічними. Екзо- (грец.) означає «назовні». До екзотермічних належать усі реакції горіння. Перебіг реакцій термічного розкладання кальцій карбонату, калій перманганату, малахіту потребує безперервного надходження теплової енергії ззовні. За відсутності нагрівання ці реакції негайно припиняються, їх називають ендотермічними.
Ендотермічна реакція: реагенти + теплова енергія → продукти.
Екзотермічна реакція: реагенти → продукти + теплова енергія.
Термохімічне рівняння - рівняння хімічної реакції, у якому зазначають агрегатні стани речовин і для якого наводять числове значення теплового ефекту.
![]()
ПІБ__________________________________Дата________ Оцінка_________
Початковий рівень (1 бал)
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
1.Виберіть одиниці виміру теплового ефекту хімічної реакції:
А.°С Б. К В .кДж Г .кг.
2. Виберіть правильне твердження. Енергетичний ефект реакції дорівнює
А) Різниці між внутрішньою енергією реагентів і продуктів реакції;
Б )Добутку внутрішньої енергії реагентів і продуктів реакції;
В )Сумі внутрішніх енергій-реагентів і продуктів реакції;
Г )Відношенню внутрішніх енергій реагентів продуктів реакції.
3.Наведіть приклади екзо- та ендотермічних реакцій.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
Середній рівень (3 бали)
4. Аби виготовити хімічну грілку, у мішечок з водонепроникного матеріалу вміщують суміш купрум(ІІ) хлориду, порошку алюмінію та наповнювача (деревні ошурки). Після добавляння води відбувається хімічна реакція, яка супроводжується виділенням теплової енергії. Поясніть, чому реакція відбувається лише після добавляння води. Класифікуйте цю реакцію за тепловим ефектом, запишіть її термохімічне рівняння. Розгляньте реакцію між металом і сіллю у розчині з точки зору окиснення-відновлення та електролітичної дисоціації. Визначте, у чому полягає суть цієї реакції.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
Достатній рівень (3 бали)
5. Запишіть два рівняння реакції нейтралізації у повній і скороченій йонній формах. Поясніть, у чому полягає суть реакції нейтралізації. Висловіть припущення, чому всі реакції нейтралізації мають приблизно однаковий тепловий ефект.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Урок 5
 Тема. Швидкість хімічної реакції, залежність швидкості реакції від різних чинників
Тема. Швидкість хімічної реакції, залежність швидкості реакції від різних чинників
Мета.
Навчальна:
формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів;
показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації;
Розвивальна:
розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції;
формувати навички розв’язання задач із використанням « швидкість хімічної реакції»
формувати навички працювати в колективі; розвивати вміння працювати парами;
виховувати творче ставлення до практичного використання знань з хімії;
формувати життєві компетенції звивати вміння порівнювати та робити висновки;
розвивати пізнавальну активність учнів, логічне мислення, пам’ять, увагу;
вдосконалювати вміння аналізувати, порівнювати, малювати схеми, виділяти головне;
Виховна:
виховувати працездатність, дисциплінованість, сприяти вихованню дотримання правил техніки безпеки при роботі з хімічними реактивами;
виховувати бережливе ставлення до власного здоров’я та оточуючих людей.
Тип уроку: комбінований урок
Форма уроку. Синтетичний з домінуванням евристичного методу навчання.
Місце уроку в навчальній темі. Пятий у темі.
Методи і методичні прийоми:
1Інформаційно- рецептивний:
а)словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3.Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4. Візуальний: складання схем.
5. Динамічні рухи
Міжпредметні зв’язки: біологія, географія, фізика.
Матеріали та обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів, таблиця «Класифікація хімічних реакцій», схеми, малюнки, опорні конспекти.
Для демонстрації дослідів: реактиви: порошок заліза, залізні ошурки,порошок магнію, хлорид на кислота, дистильована вода.
Основні поняття та терміни: хімічні реакції, енергетичний ефект хімічних реакцій, внутрішня енергія, реакції: ендотермічні, екзотермічні, термохімічні рівняння, тепловий ефект реакції, швидкість хімічної реакції, умови перебігу хімічної реакції,енергія активації.
|
знати |
вміти |
|
|
- що таке каталізатор; - які умови виникнення й перебігу хімічних реакцій; - що таке температура займання, які умови виникнення й припинення горіння; - що таке енергія активації.
|
називати чинники, які впливають на швидкість хімічних реакцій; наводити приклади хімічних реакцій, які відбуваються з різною швидкістю;
пояснювати суть енергії активації; |
|
ХІД УРОКУ
|
Етап уроку
|
Зміст уроку |
Дія учнів |
||||||||||||||||||||||||||||||||
|
I II
III
IV
V
VI
|
Організаційний момент Актуалізація опорних знань 1.Самостійна робота: Перший варіант Під час спалювання сірки в надлишку кисню виділилося 29,7 кДЖ теплоти. Складіть відповідне термохімічне рівняння. Другий варіант Під час згоряння 1л метану (н. у.) в надлишку повітря виділилося 39,4 кДЖ теплоти. Складіть відповідне термохімічне рівняння.
2.Вправа «Мікрофон»: Незакінчене речення. Закінчи речення: - Хімічні реакції, що відбуваються з виділенням теплоти, називаються…(екзотермічними) - Під час ендотермічних реакцій теплота…(поглинається) - Тепловий ефект реакції – це…(теплота, що вивільняється або поглинається під час хімічних реакцій) - Термохімія займається вивченням …(теплових явищ, що супроводжують хімічні реакції)
3. Гра «Вірю – не вірю» Учні зачитують твердження і дають відповідь - вірне воно чи хибне.
12.Під час протікання ендотермічної реакції температура реакційної суміші Мотивація навчальної діяльності учнів, повідомлення теми та мети уроку
Вивчаючи хімічні властивості різних сполук, ви напевне звернули увагу на те, що для перебігу різних реакцій потрібний різний час:
Отже, реакції перебігають з різною швидкістю. Пригадайте, як на уроках фізики і математики, ви позначали швидкість руху? (U) Швидкість хімічних реакцій вивчає розділ хімії, що називається хімічною кінетикою. За якими критеріями можна судити про швидкість протікання хімічної реакції? За зміною кількості вихідних речовин і продуктів реакції. Тема уроку – «Швидкість хімічних реакцій». Постановка проблеми: чи можна керувати швидкістю хімічних реакцій? Яким чином?
Вивчення нового матеріалу Поняття про швидкість хімічних реакцій має велике значення, бо з ним найчастіше пов’язані уявлення про перетворення речовин й економну ефективність їх промислового виробництва.
Швидкість реакції – зміна концентрації речовини за одиницю часу.
С2 – С1 ∆C ∆υ
τ 2 – τ 1 ∆ τ V ∆ τ C - молярна концентрація, [моль/л] τ1 і τ 2 - початковий і кінцевий час хімічної реакції, [c] U – швидкість хімічної реакції, [моль/л∙с] V - об’єм, [л] υ – кількість речовини, [моль]
В житті часто виникає потреба керувати швидкістю реакції . Наприклад,
1. Розташуйте явища за зростанням швидкості хімічних реакцій:
Для цього потрібно знати від чого залежить швидкість реакції.
Неухильно виконуйте правила техніки безпеки
Група №1 «Вплив хімічної природи реагентів на швидкість реакції» • В одну комірку насипте трохи порошку магнію, а в другу стільки ж за масою порошку заліза. • В обидві комірки налийте по 2-3 краплі розчину хлоридної кислоти. Хімічна реакція між хлоридною кислотою і магнієм відбувається із залізом___________________________ ____________________________________ Швидкість хімічної реакції залежить від…………………………..
Група №2 «Вплив площі поверхні стикання речовин на швидкість реакції» • В одну комірку насипте трохи порошку заліза, а в другу стільки ж за масою залізних ошурок. • В обидві комірки налийте по 2-3 краплі розчину хлоридної кислоти. Зі збільшенням площі поверхні контакту реагентів швидкість реакції ............................................................................... Швидкість хімічної реакції залежить від…………………………..
Група №3 «Вплив концентрації речовин на швидкість реакції» • У дві комірки насипте трохи порошку магнію. • У першу долийте 4 краплі хлоридної кислоти, а в другу-3 краплі дистильованої води і 1 краплю розчину хлоридної кислоти. Зі збільшенням концентрації реагенту швидкість реакції………….. __________________________________........................................... Швидкість хімічної реакції залежить від…………………………..
Якщо реакція відбувається між газами, то її швидкість можна збільшити за допомогою тиску, бо в разі підвищення тиску концентрація газу збільшується.
Закріплення вивченого матеріалу 1.Перетвори інформацію на знання Задачі: 1. Концентрація одного з реагентів через 20 секунд після початку реакції становила 0,1 моль\л, а через 30 секунд – 0,02 моль/л. Обчисліть середню швидкість цієї реакції. 2. Реакція за температури 400 С протікає за 180с. Температурний коефіцієнт реакції дорівнює 3. За скільки секунд завершиться ця реакція за температури 600 С?
Використовуючи свої знання про швидкість реакції в побуті дай відповіді:
Домашнє завдання Вивчити §16 Г.А. Лашевська «Хімія 9 клас», вправа 5,6. ст.119, Задача. У скільки разів зросте швидкість хімічної реакції при підвищенні температури з 20 ˚С до 70˚С, якщо температурний коефіцієнт реакції дорівнює 3. Творче завдання: підготувати повідомлення про ферменти.
|
Самостійна робота учнів Перевірка за зразком
Фронтальна бесіда
Індивідуальна робота
Взаємоперевірка
Відповіді учнів
Індивідуальна робота
Робота з підручником і довідковою літературою
Робота у групах. Звітування та формування висновків.
Заповнення таблиці
Індивідуальна робота Перевірка за зразком
Фронтальна бесіда
|
Урок 6
 Тема. Узагальнення й систематизація знань з теми «Хімічні реакції»
Тема. Узагальнення й систематизація знань з теми «Хімічні реакції»
Мета.
Навчальна:
узагальнити та систематизувати знання з теми «Хімічні реакції»;
закріпити поняття класифікації типів реакцій, уміння складати окисно-відновні рівняння, використовуючи метод електронного балансу;
розвивати вміння характеризувати вплив різних чинників на швидкість хімічних реакцій, а також значення різних типів реакцій у природі;
сформувати поняття про хімічні реакції як прояв дії законів природи;
Розвивальна:
розвивати вміння точно та логічно висловлювати власні думки, узагальнювати їх; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції;
формувати навички розв’язання задач із використанням « швидкість хімічної реакції»
формувати навички працювати в колективі; розвивати вміння працювати парами;
виховувати творче ставлення до практичного використання знань з хімії;
формувати життєві компетенції звивати вміння порівнювати та робити висновки;
розвивати пізнавальну активність учнів, логічне мислення, пам’ять, увагу;
вдосконалювати вміння аналізувати, порівнювати, малювати схеми, виділяти головне;
Виховна:
виховувати науковий світогляд та вміння спілкуватись;
виховувати працездатність, дисциплінованість, сприяти вихованню дотримання правил техніки безпеки при роботі з хімічними реактивами;
виховувати бережливе ставлення до власного здоров’я та оточуючих людей.
Тип уроку: урок систематизації і узагальнення знань.
Форма уроку. Синтетичний з домінуванням евристичного методу навчання.
Місце уроку в навчальній темі. Шостий у темі.
Методи і методичні прийоми:
1Інформаційно- рецептивний:
а)словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3.Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4. Візуальний: складання схем.
5. Динамічні рухи
Міжпредметні зв ́язки: медицина, біологія, географія, фізика.
Матеріали та обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, ряд активності металів, таблиця «Класифікація хімічних реакцій», схеми, малюнки, опорні конспекти.
Для демонстрації дослідів: реактиви: перманганат калію, натрій гідроксид, хлоридна кислота, оцтова кислота, кальцій карбонат, натрій сульфіт.
Основні поняття та терміни: хімічна реакція; типи хімічних реакцій; реакції сполучення, розкладу, заміщення, обміну; окисно-відновні реакції; екзотермічні та ендотермічні реакції; термохімічні рівняння; швидкість хімічних реакцій, каталізатори.
|
знати |
вміти |
|
|
учні мають знати термінологію з вивченої теми.
|
вміти: складати рівняння окисно-відновних реакцій з використанням методу електронного балансу, складати термохімічні рівняння; класифікувати хімічні реакції за різними ознаками; розв’язувати задачі за рівняннями хімічних реакцій. |
|
ХІД УРОКУ
|
Етап уроку |
Зміст уроку |
Дія учнів |
|||||||||||||||
|
I
II
III
IV
V
VI
|
Організаційний момент Міні-інтерв'ю. Після привітання даю чітку інструкцію: «Інтерв’ю за 1 хвилину». Наприклад: — Яким був попередній урок? (Важким, цікавим...) — Якою була перерва? (Веселою, короткою...) — З яким настроєм ви прийшли на урок? (Гарним, сумним, надзвичайно веселим...) — У якому темпі виконували домашнє завдання на сьогоднішній урок? (Нашвидкуруч) Формула уроку. Давайте разом розшифруємо формулу нашого уроку (у * о) • (в *4 с) • р = з, де у — увага, о — організованість, в — взаємодопомога, с — спілкування, р — робота, з — знання.
Мотивація навчальної діяльності, повідомлення цілей і завдань уроку. Дослід «Світлофор» і «Дим без вогню» Що об’єднує ці два процеси? Інтерактивна вправа «Очікування»
Я очікую, що …( Я очікую, що на уроці буде цікаво; дізнаюсь про щось корисне, важливе; будемо працювати в групах, парах) Цей урок навчить мене …(Цей урок навчить мене робити висновки, складати рівняння перетворень, висловлювати своє ставлення до почутого… )
Учитель. У темі «Хімічні реакції» ми ознайомилися з різними типами хімічних реакцій. Цей розділ має важливе практичне значення. Більшість виробництв хімічної, фармацевтичної, металургійної, нафтохімічної, харчової, текстильної та інших галузей промисловості базуються на хімічних реакціях. А також хімічні реакції відбуваються в живих організмах, бо живі організми – велика біолабораторія, де відбувається сотні тисяч хімічних реакцій. Сьогодні на уроці ми узагальнимо знання про хімічні реакції і перевіримо ваше вміння нестандартно мислити і діяти. Актуалізація опорних знань Вправа «Шпаргалка» Відтворіть розмиті частини шпаргалки.
Вправа «Дерево мудрості» На дереві прикріплені запитання до кросворду «Основні закономірності хімічних реакцій». Учасники виходять, відривають листочки із запитаннями і вписують відповіді у кросворд.
Ключове слово – речовина, яка змінює швидкість хімічної реакції, але не входить до складу її продуктів. (каталізатор).
1. Реакції, що відбуваються з виділенням теплоти. 2. Реакції між простою і складною речовинами, в яких атоми простої заміщають атоми в складній. 3. Реакції, що відбуваються з поглинанням теплоти. 4. Реакції, що відбуваються з участю каталізатора. 5. Реакції, під час яких з двох або більше речовин утворюється одна складніша за будовою речовина. 6. Речовина, яка під час окисно – відновної реакції окислюється. 7. Реакції, під час яких з однієї речовини утворюється дві або більше простіших за будовою речовин. 8. Реакції, що відбуваються без каталізатора. 9. Реакції, що відбуваються у двох взаємно протилежних напрямках. 10. Реакції між двома складними речовинами, під час яких вони обмінюються йонами. 11. Реакції, що відбуваються в одному напрямку, протікають до кінця.
Відповіді. 1. Екзотермічна. 2. Заміщення. 3. Ендотермічна. 4. Каталітична. 5. Сполучення. 6. Відновник. 7. Розкладу. 8. Некаталітична. 9. Оборотні. 10. Обміну. 11. Необоротні.
Закінчити рівняння реакцій, скласти електронний баланс. Робота з опорним конспектом Уявімо собі, що…ми потрапили у глибину століть, коли люди зрозуміли, що розпаливши багаття, можна зігрітися… … а тепер опинились в Стародавньому Єгипті. Саме зараз цариця Клеопатра розчиняє в келиху з оцтом безцінну перлину… В ті часи люди ще не знали хімії і не могли написати рівняння цих хімічних реакцій: СаСО3 + 2СН3СООН = Са(СН3СОО)2 + Н2О + СО2 С + О2 = СО2 А тим більше, ніхто і не передбачав, що друга реакція набагато складніша за першу: адже саме тут відбувається переміщення електронів від атомів одного елемента до атомів іншого, отже вона буде ОКИСНО-ВІДНОВНОЮ РЕАКЦІЄЮ Допоможіть алхімікам з окисно-відновними реакціями.
1 група окисно-відновні реакції в природі S + O2 → C + O2 → CO2 + C → 2 група окисно-відновні реакції в металургії 3 група окисно-відновні реакції в живих організмах.
З якого металу виготовляють цистерни для перевезення сульфатної кислоти по залізницях ? Розведені розчини сульфатної кислоти розчиняють метали, розташовані в ряду стандартних електродних потенціалів до водню. Однак на поверхні свинцю утворюється плівка PbSO4, яка захищає його від подальшої взаємодії з кислотою. Метали, розташовані в ряду стандартних електродних потенціалів після водню, з розведеними розчинами H2SO4 не взаємодіють.
Концентрована сульфатна кислота за звичайної температури з багатьма металами не реагує. Тому безводну сульфатну кислоту можна зберігати у залізній тарі й перевозити у стальних цистернах1. Однак при нагріванні концентрована H2SO4 взаємодіє майже з усіма металами (крім Pt, Au та деяких інших). При цьому вона виступає як окисник, сама відновлюється звичайно до SO2. Водень у цьому випадку не виділяється, а утворюється вода. Наприклад:
Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2O. Fe + H2SO4(P) = FeSO4 + H2;(при кімнатній температурі) ᵗ Fe + H2SO4(кон) = Fe2(SO4)3 + H2;( при нагріванні) Суміш яких газів не можна залишати на сонці ? Суміш водню з хлором , бо така суміш вибухає. Відбувається фотохімічна реакція.
Завдання . Напишіть рівняння реакцій: а) магнію, цинку, алюмінію, заліза з розчином сульфатної кислоти однакового об'єму та концентрації. Поясніть, у якому випадку і чому швидкість реакції буде найбільшою і найменшою. а) Mg + H2SO4 = MgSO4 + H2↑ - швидкість реакції найбільша. б) Zn + H2SO4 = ZnSO4 + H2↑ в) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ г) Fe + H2SO4 = FeSO4 + H2↑ - швидкість реакції найменша. У випадку а) швидкість реакції буде найбільшою, а у випадку г) - найменшою. Тому, що метал Mg активніший за запропоновані і розміщений лівіше від них у ряді активності металів, а залізо Fe є менш активніший за запропоновані і розміщений правіше від них.
Вправа «Найкмітливіший» №1. У результаті взаємодії алюмінію масою 9 г з киснем виділилося 274,44 кДж теплоти. Скласти термохімічне рівняння. Розв’язок: Дано: 9 г 274,44 кДж m(Аl) = 9 г 4Аl + 3О2 → 2Al2О3 +Х кДж Q = 274,44 кДж 4∙27 г ∆Н - ? Відповідь: 4Аl + 3О2 → 2Al2О3 +3293,28 кДж
№2 При згоранні фосфору кількістю речовини 1 моль утворюється 746 кДж теплоти. Запишіть термохімічне рівняння реакції. №3 При розкладанні йодоводню кількістю речовини 1 моль утворюється 26 кДж теплоти. Запишіть термохімічне рівняння реакції.
Узагальнення та систематизація знань. Завдання 1 – 8 мають по чотири варіанти відповідей. У кожному завданні лише одна відповідь правильна. Оберіть правильну, на вашу думку, відповідь та позначте її у бланку відповідей.
1.Схема А + В = АВ виражає сутність реакції: А. сполучення; Б. розкладу; В. заміщення; Г. обміну. (0,5 бал.) 2.Речовини, які під час реакції віддають електрони, називаються : А. окисниками; Б. відновниками; В. каталізаторами; Г. інгібіторами. (0,5 бал.) 3. Запис А + В = АВ; ∆Н‹0 означає, що реакція : А. каталітична; Б. окисно – відновна; В. ендотермічна; Г. екзотермічна. (0,5 бал.) 4. Каталізатор впливає на: А. зміщення рівноваги; Б. швидкість реакції; В. підвищення тиску; Г. зниження температури. (0,5 бал.) 5. Зі зростанням концентрації реагентів швидкість хімічних реакцій: А. збільшується; Б. зменшується; В. не змінюється; Г. змінюється періодично. (0,5 бал.) 6. Одиниця вимірювання теплового ефекту реакції є: (0,5 бал.) А. кПа; Б. кДж; В. моль; Г. моль/л. 7.Як називається наступний процес і скільки електронів в ньому беруть участь: .( 1,5 бал.) S+6→ S─2 А. окиснення, 4 е─; Б. відновлення,8 е─; В. окиснення,8 е─; Г. відновлення,4 е─ 8. Реакція сполучення : . (1,5 бал.) А. завжди є окисно – відновним процесом; Б. ніколи не супроводжуються зміною ступенів окиснення; В. може бути окисно – відновним процесом, а може не супроводжуватися зміною ступенів окиснення; Г. практично ніколи не супроводжується зміною ступенів окиснення Відповідь 1 сполучення, 2 3 ендотермічна, 4 швидкість реакції, 5 збільшується, 6 кДж, 7 відновлення 8е, 8 завжди є окисно-відновною.
Рефлексія учнів. Вправа «Мікрофон». Сьогодні на уроці я зрозумів, що … Мені сподобалося на уроці те, що ….. Я дізнався що... Мене здивувало, що... Мені сподобалося, що...
Домашнє завдання. Повторити вивчений матеріал § 13-16 Г.А. Лашевська «Хімія 9 клас». Підготуватися до контрольної роботи. |
Фронтальна бесіда
Визначення формули уроку
Фронтальна робота з
Відповіді учнів формулювання теми та визначення завдань уроку
Індивідуальна письмова робота ( 2 бали)
метод взаємоперевірки з допомогою ключа
Фронтальна робота ( по 0,5 бали)
Робота в групах Перевірка за зразком
(3 бали)
Робота над проблемними питаннями
Завершення опорної схеми Індивідуальна робота (2 бали)
Індивідуальна робота на швидкість ( 3 бали)
Індивідуальна робота Взаємоперевірка
|
 Урок 7 Тематичне контрольне оцінювання з теми «Хімічні реакції»
Урок 7 Тематичне контрольне оцінювання з теми «Хімічні реакції»
ПІБ____________________Дата________Варіант_________Оцінка_________
Завдання 1 – 8 мають по чотири варіанти відповідей. У кожному завданні лише одна відповідь правильна. Оберіть правильну, на вашу думку, відповідь та позначте її у бланку відповідей.
Початковий рівень
- Схема А + В = АВ виражає сутність реакції:
А. сполучення; Б. розкладу; В. заміщення; Г. обміну. (0,5 бал.)
- Речовини, які під час реакції віддають електрони, називаються :
А. окисниками; Б. відновниками; В. каталізаторами; Г. інгібіторами. (0,5 бал.)
3. Запис А + В = АВ; ∆Н‹0 означає, що реакція :
А. каталітична; Б. окисно – відновна; В. ендотермічна; Г. екзотермічна. (0,5 бал.)
4. Каталізатор впливає на:
А. зміщення рівноваги; Б. швидкість реакції;
В. підвищення тиску; Г. зниження температури. (0,5 бал.)
5. Зі зростанням концентрації реагентів швидкість хімічних реакцій:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично. (0,5 бал.)
6. Одиниця вимірювання теплового ефекту реакції є: (0,5 бал.)
А. кПа; Б. кДж; В. моль; Г. моль/л.
Середній рівень
7.Як називається наступний процес і скільки електронів в ньому беруть участь: .( 1,5 бал.)
S+6→ S─2
А. окиснення, 4 е─; Б. відновлення,8 е─;
В. окиснення,8 е─; Г. відновлення,4 е─
8. Реакція сполучення : . (1,5 бал.)
А. завжди є окисно –відновним процесом;
Б. ніколи не супроводжуються зміною ступенів окиснення;
В. може бути окисно –відновним процесом, а може не супроводжуватися зміною ступенів окиснення;
Г. практично ніколи не супроводжується зміною ступенів окиснення
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
А |
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
|
|
|
Г |
|
|
|
|
|
|
|
|
Завдання 9-10 мають на меті встановлення відповідностей. До кожного рядка, позначеного буквою, доберіть відповідник. позначений цифрою, впишіть її в таблицю.
Достатній рівень
|
|
9 |
10 |
|
А |
|
|
|
Б |
|
|
|
В |
|
|
|
Г |
|
|
9.Установіть відповідність між рівнянням реакції і її типом: (1,5 балів.) А. Fe2O3 + 3H2 =2Fe + 3 H2O ; 1.розкладу;
Б. FeSO4 + 2KOH = K2SO4 + Fe(OH)2 ; 2.сполучення;
В. 2Fe(OH)3 = Fe2O3 + 3H2O ; 3.заміщення;
Г. 2Mg + O2 = 2MgO; 4.обміну.
10. .Установіть відповідність між рівнянням реакції і її типом: (1,5 балів)
А.2КNO3 = 2KNO2 +3O2; ∆Н = +255кДж. 1.екзотермічна;
Б. 2Mg + CO2 = 2MgO +C; ∆Н= ─829 кДж. 2.ендотермічна;
![]()
![]() В. N2 +O 2 2NO; 3.каталітична;
В. N2 +O 2 2NO; 3.каталітична;
![]() Г. 2KClO3 MnO2 2 KCl + 3O2; 4.оборотна.
Г. 2KClO3 MnO2 2 KCl + 3O2; 4.оборотна.
Високий рівень
11. Методом електронного балансу розставте коефіцієнти в рівнянні окисно- відновної реакції. Вкажіть окисник і відновник, процеси окиснення та відновлення. Вкажіть загальну суму коефіцієнтів у рівнянні реакції :
NH3 +O2 → N2 + H2O. ( 3бали)
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________


про публікацію авторської розробки
Додати розробку