Діаграми стану тверде тіло - рідина
1
КУРСОВА РОБОТА
Тема роботи: Діаграми стану тверде тіло - рідина
Харків – 2020
РЕФЕРАТ
Курсова робота: 30 с., рис. - 14, 10 літературних джерел.
Об’єкт дослідження – діаграми стану тверде тіло - рідини.
Мета роботи – провести аналіз літературних джерел із вказаної теми.
В даній роботі проведений аналіз теоретичного матеріалу, щодо становлення і досягнення найважливішої області фізичної хімії – хімії фазових станів. Розглянута загальна характеристика і фізико-хімічні параметри діаграми стану тверде тіло - рідини, їх застосування в науці та виробництві.
ДІАГРАМИ СТАНУ З ЕВТЕКТИКОЮ, ЕВТЕКТИЧНА ТОЧКА, ДІАГРАМИ СТАНУ З УТВОРЕННЯМ ХІМІЧНОЇ СПОЛУКИ, ДІАГРАМИ СТАНУ З ПОЛІМОРФНИМИ КОМПОНЕНТАМИ
ЗМІСТ
ВСТУП 3
1 ДІАГРАМИ СТАНУ З ЕВТЕКТИКОЮ 4
1.1 Загальна характеристика евтектичних сумішей 4
1.2 Діаграми евтектичних сумішей 9
2 ДІАГРАМИ СТАНУ З УТВОРЕННЯМ ХІМІЧНОЇ СПОЛУКИ 15
2.1 Діаграми стану систем з хімічними сполуками 15
2.2 Діаграми стану систем з поліморфними компонентами 16
3 ДІАГРАМИ СТАНУ З РІЗНОЮ РОЗЧИННІСТЮ КОМПОНЕНТІВ 18
3.1 Зображення діаграм 18
3.2 Застосування діаграм твердих сплавів 25
ВИСНОВКИ 29
ПЕРЕЛІК ПОСИЛАНЬ 30
ВСТУП
Більшість металевих сплавів, шлаків, вогнетривів являють собою багатокомпонентні системи, але з певними допущення - ми їх можна розглядати як дво- або трикомпонентні системи і використовувати відомі для них закономірності для реальних систем і технологічних процесів. Вивчення цього матеріалу необхідно для розуміння процесів, які відбуваються в металевих та неметалевих розплавах при їхньому охолодженні та нагріванні, а також для визначення температур фазових перетворень сплавів, кількості фаз і ступенів вільності, хімічного складу фаз і масового вмісту в них компонентів за певних умов у сплавах різного складу та відомої загальної маси.
Процеси плавлення металургійної шихти у печах, відновлення її компонентів, розчинення різних додатків, газів, взаємодія металевих розплавів з вогнетривами, шлаками відбуваються у високотемпературних розчинах. Тому вивчення основних законів, які дозволяють розрахувати властивості металевих і неметалевих високотемпературних розчинів залежно від їхнього складу, є дуже важливим для інженерів-металургів.
Фізико-хімічні та хімічні процеси, що відбуваються у процесі виробництва чавуну, сталі, кольорових металів та сплавів – це реакції у високотемпературних розчинах. Розплавлені чавун, сталь є рідкими розчинами різних елементів у залізі. Розплавлені шлаки доменних, сталеплавильних печей являються розчинами оксидів.
Метою даної курсової роботи є літературний огляд діаграми стану тверде тіло - рідини, описання її фізико-хімічних параметрів та застосування в науці та виробництві.
1 ДІАГРАМИ СТАНУ З ЕВТЕКТИКОЮ
- Загальна характеристика евтектичних сумішей
Будь-який сплав складається з однієї або декількох фаз. Ними можуть бути:
1) чисті компоненти;
2) тверді розчини;
3) хімічні сполуки.
Знання фазового складу є дуже важливим при дослідженні сплавів, але недостатнім для визначення їх властивостей. Більше інформації містить у собі структурний склад сплаву, тобто наявність у ньому певних структурних складових – окремих елементів мікроструктури, які відрізняються від інших. Кількість структурних складових металевої системи часто переважає кількість фаз, оскільки містить усі фази цієї системи, а також їхні суміші, що кристалізуються водночас і разом (евтектика, евтектоїд). Тому на діаграмах стану наводять не тільки фазовий, а й структурний склад для кожної їх області.
Діаграми стану або діаграми фазової рівноваги у зручній графічній формі показують фазовий і структурний склад сплавів залежно від температури та концентрації. Діаграми стану будують для умов рівноваги, які досягаються тільки при дуже малих швидкостях охолодження або тривалому нагріванні. Справжній рівноважний стан в практичних умовах досягається рідко. В більшості випадків сплави знаходяться в метастабільному стані, тобто такому, коли вони мають обмежену стійкість і під впливом зовнішніх факторів набувають інших більш стійких станів. В багатьох випадках метастабільні стани надають сплавам високих механічних або інших властивостей. Вихідним положенням при вирішуванні таких питань є знання діаграм стану. Саме діаграми стану дозволяють розробити раціональні режими різних видів обробки матеріалів і реалізувати їх на практиці.
Вивчення будь-якої діаграми стану подвійної системи складається з двох етапів:
1) її загального опису;
2) аналізу процесу кристалізації типових сплавів.
Доцільно поруч з діаграмою стану зображати криві охолодження сплавів, які аналізуються.
Діаграми стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів є однією з найпростіших. Вона містить у собі всього дві лінії (рис. 1.1, а). Верхня з них є лінією початку кристалізації будь-якого сплаву цієї системи і називається лінією ліквідусу (liquidus line). Нижня лінія є лінією кінця кристалізації усіх сплавів і є лінією солідусу (solidus). Вище від лінії ліквідусу розташована однофазна область рідкого розчину (Р). Нижче від лінії солідусу лежить також однофазна область a - твердого розчину. Між цими лініями знаходиться двофазна область, де співіснують обидва розчини (Р+a).
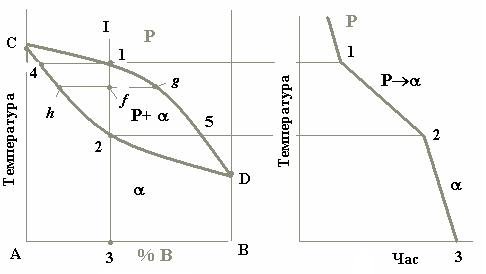
а б
Рис. 1.1 – Діаграма стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів (а) та крива охолодження типового сплаву (б)
На діаграмі стану точки С і D є температурами кристалізації відповідно компонентів А і В. Сплав же будь-якої концентрації, наприклад сплав I, кристалізуватиметься в інтервалі температур між точками 1 і 2 і після повного охолодження (точка 3) буде мати остаточну структуру з зерен a-твердого розчину (рис. 1.2) [2].
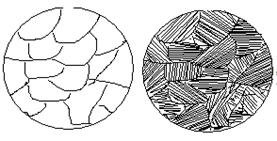
Рис. 1.2 – Зображення мікроструктури твердого розчину (сплаву I)
Для більш детального аналізу процесу кристалізації цього сплаву потрібно скористатися правилом відрізків (правилом важеля):
Для визначення хімічного складу фаз, що перебувають у рівновазі одна з одною, через фігуративну точку сплаву проводять горизонтальну лінію до перетину з лініями діаграми, які обмежують дану область; проекції точок перетину на вісь концентрацій показують склади фаз. (Фігуративною точкою (figurative point) називається кожна точка в межах креслення діаграми стану. Вона зображає стан сплаву певного хімічного складу при певній температурі).
В нашому випадку фігуративною точкою є точка f, а точками перетину, про які йде мова, є точки h і g. Пряма hg, що з’єднує ці точки, називається конодою.
Правило відрізків (важеля) дозволяє визначити не лише хімічний склад фаз, але й їхню відносну й абсолютну кількість.
Для визначення кількості кожної фази через фігуративну точку проводять коноду; її відрізки обернено пропорційні кількості кожної з фаз.
Наприклад, у точці f у рівновазі знаходяться рідина складу точки g і a-фаза концентрації точки h. При цьому:
![]() , (1.1)
, (1.1)
![]() . (1.2)
. (1.2)
Якщо скористатися цим правилом при аналізі процесу кристалізації сплаву I, то виявляється, що з рідини концентрації точки 1 виділяються кристали a-фази концентрації точки 4, тобто зовсім іншого складу.
Твердий розчин відносно рідини завжди збагачений тим компонентом, який підвищує температуру кристалізації сплавів.
У нашому випадку таким компонентом є А, отже, при будь-якій температурі a-фаза щодо рідкого розчину збагачена саме ним. При зниженні температури склад рідини змінюється вздовж лінії ліквідусу від точки 1 до точки 5, а склад a-фази – по лінії солідусу від точки 4 до точки 2 (рис. 1.1) [1].
Діаграми стану систем з відсутністю взаємної розчинності компонентів у твердому стані, в яких додавання як компонента В до компонента А, так і навпаки компонента А до компонента В, спричинює зниження температур кристалізації сплавів. З цієї причини лінія ліквідусу такої системи (рис. 1.3) опускається донизу з точок С і D. Обидві гілки лінії ліквідусу (СЕ і DE) перетинаються в точці Е. Кожна з цих гілок є як лінією початку кристалізації того або іншого компонента (СЕ – компонента А, DE – компонента В), так і лінією граничного насичення рідкого розчину відповідними компонентом: на лінії СЕ рідина гранично насичена компонентом А і при подальшому зниженні температури відбувається його кристалізація; на лінії ED – компонентом В, який теж буде кристалізуватися при подальшому охолодженні. Точка Е є спільною для обох кривих, отже, рідина такого складу гранично насичена обома компонентами, вони й будуть кристалізуватися одночасно і разом: РЕ→(А+В) (читається: рідина складу точки Е перетворюється в суміш двох фаз, тобто компонентів А і В) [2].
- Діаграми евтектичних сумішей
Суміш двох твердих фаз, які кристалізуються одночасно і разом з рідини певного складу, називається евтектикою (eutectic).
У кристалізації евтектики беруть участь три фази і згідно з правилом фаз система є нонваріантною, тобто кристалізація евтектики проходить при постійній температурі, що й видно на кривих охолодження.
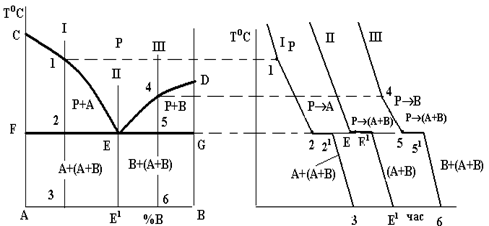
а б
Рис. 1.3 – Діаграма стану (а) і криві охолодження (б) системи з відсутністю взаємної розчинності компонентів у твердому стані
При кристалізації будь-якого сплаву цієї системи склад рідини буде змінюватися вздовж лінії ліквідусу до евтектичної точки Е, тобто кристалізація усіх сплавів закінчується утворенням евтектики. Оскільки це відбувається при постійній і однаковій для всіх сплавів температурі, то лінія солідусу даної системи є горизонтальною прямою FEG, яка називається лінією евтектичного перетворення.
Евтектична точка Е поділяє усі сплави на доевтектичні (ліворуч від точки Е) та заевтектичні (праворуч від точки Е). В окрему групу виділяється евтектичний сплав (на рис. 1.3, а) сплав II).
Розглянемо процеси кристалізації типових сплавів цієї системи. Доевтектичний сплав I кристалізується у два етапи. На першому в інтервалі температур 1-2 з рідини кристалізуються первинні кристали компонента (фази) А; потім в точці 2 рідина, що залишилася, закристалізується у вигляді евтектики. Отже, нижче точки 2 до точки 3, тобто до повного охолодження, сплав I буде мати структуру з двох складових: первинних кристалів компонента А та евтектики (суміші двох компонентів А і В) (рис. 1.4, а). Кількісний склад цих складових може бути визначений за правилом важеля. Так, кількість евтектики дорівнює відношенню довжини відрізка А-3 до довжини коноди А-Е1, а кількість фази А (компонента А) - відношенню довжини відрізка 3-Е1 до довжини А-Е1, тобто [1]:
![]() , (1.3)
, (1.3)
![]() . (1.4)
. (1.4)
Евтектичний сплав II має всього один етап кристалізації – утворення евтектики, і, таким чином, одну структурну складову – евтектику (рис. 1.4, б).
Заевтектичний сплав III кристалізується подібно до доевтектичного, але на першому етапі кристалізації з рідини виділяються кристали компонента В. Таким чином, кінцева структура заевтектичного сплаву складається з цих первинних кристалів і ділянок евтектики (рис. 1.4, в).
![]()
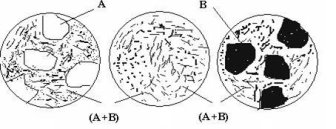
а б в
Рис. 1.4 – Схеми мікроструктур доевтектичного (а), евтектичного (б) та заевтектичного (в) сплавів
Діаграми стану систем з обмеженою розчинністю компонентів у твердому стані мають місце в металевих сплавах. При утворенні обмежених твердих розчинів зустрічаються два типи діаграм стану: з евтектичним і з перитектичним перетворенням.
Діаграма стану систем з утворенням обмежених твердих розчинів і евтектичним перетворенням (рис. 1.5).
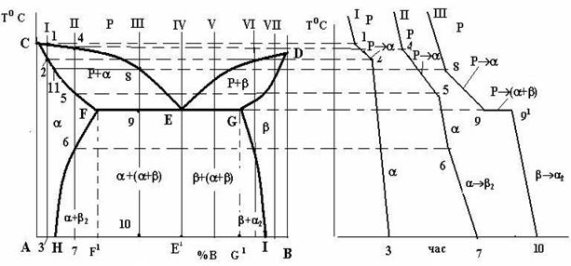
а б
Рис. 1.5 – Діаграма стану (а) і криві охолодження (б) системи з обмеженою розчинністю компонентів у твердому стані з евтектичним перетворенням
Лінією ліквідусу на цій діаграмі є лінія СЕD, а лінією солідусу – лінія CFEGD. На горизонтальній частині цієї лінії FEG відбувається евтектичне перетворення: РЕ ( F + G) (читається: рідина складу точки Е перетворюється в суміш двох фаз - a-твердого розчину складу точки F і b-твердого розчину складу точки G), де a і b - обмежені тверді розчини компонента В у компоненті А (a) і компонента А в компоненті В (b) [3].
Крім цих ліній на діаграмі є і дві нові – лінії так званого сольвусу, тобто обмеженої розчинності у твердому стані – FH і GI. Перша з них показує границю розчинності компонента В у компоненті А, тобто граничний вміст компонента В в a-твердому розчині. Відповідно, лінія GI є граничним вмістом компонента А в b-твердому розчині. З положення цих ліній видно, що взаємна розчинність компонентів із зниженням температури зменшується.
Вказані лінії діаграми ділять її площу на 3 однофазні та 3 двофазні області. До однофазних належать область рідкого розчину (вище лінії ліквідусу CED), область CFHA a-фази і область DGIB b-фази. Двофазними є області CEF і DEG, в яких відбувається кристалізація первинних кристалів відповідно a- і b-твердих розчинів, а також область існування двох твердих розчинів a і b - HFGI. В цій області відбувається вторинна кристалізація, в якій, на відміну від первинної, не бере участі рідка фаза. Вторинна кристалізація полягає в тому, що після первинної кристалізації будь-якого сплаву, що лежить між точками H і I, і в складі структури якого є a- чи b-тверді розчини, ці тверді розчини при подальшому охолодженні до температур ліній сольвусів FH чи GI стають насиченими, а нижче цих ліній – перенасиченими. Оскільки стан перенасиченого твердого розчину є незрівноваженим, починається його розпад із виділенням надлишкового компонента.
Діаграми стану з перитектичним перетворенням (рис. 1.6).
Цей варіант діаграми реалізується тоді, коли температури кристалізації компонентів дуже відрізняються.
Лінія ліквідусу – CPD, солідусу – CNPD, сольвусу – NR I MQ.
Діаграма має три однофазні області: рідкого розчину (вище від лінії ліквідусу), a-фази (ACNRA), b-фази (QMDBQ) та три двофазні – рідини та кристалів a (CNPC), рідини та кристалів b (MPDM), кристалів a- і b-твердих розчинів (RNMQR). В останній області можна виділити окремо області RNN1R з a-фазою та вторинними кристалами bII – (a+bII) і MQM1M (b+aII) [5].
На лінії NMP відбувається перитектичне перетворення: рідина та кристали, що раніше виділилися з неї, у взаємодії між собою утворюють нову тверду фазу: РР+αN→βM (читається: рідина складу точки Р і кристали a-фази складу точки N перетворюються на кристали b-фази складу точки М). Остання реакція перитектичного перетворення відбувається з повним використанням двох вихідних фаз лише для одного сплаву – складу точки МI. Для будь-якого іншого сплаву одна з вихідних фаз буде надлишковою і частина її залишиться після перитектичного перетворення. Так, для будь-якого сплаву, що лежить між точками N і M (наприклад, сплаву III), надлишковою фазою буде a-фаза, а для сплавів між точками M і P (наприклад, сплавів IV i V) надлишковою фазою буде рідина.
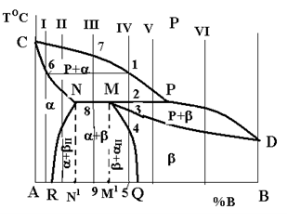
Рис. 1.6 – Діаграма стану системи з обмеженою розчинністю компонентів у твердому стані і перитектичним перетворенням
Структура сплаву III після повного охолодження складатиметься з кристалів b-фази, що утворилися при перитектичному перетворенні, та кристалів a-фази, що вціліли при перитектичному перетворенні (рис. 1.7, а). При охолодженні цього сплаву від точки 8 до точки 9 з цих фаз виділяються вторинні кристали (відбувається вторинна кристалізація: α→βII; β→αII), але нові структурні складові, як це було зазначено раніше, не утворюються.
В сплаві IV при охолодженні від точки 1 до точки 2 з рідини виділяються первинні кристали a-твердого розчину, склад яких змінюється по лінії солідусу від точки 6 до точки N. Водночас склад рідини змінюється вздовж лінії ліквідусу від точки 1 до точки Р. На лінії NM фази такого складу взаємодіють між собою за перитектичною реакцією з утворенням b-фази. Після перитектичного перетворення в точці 2 залишиться в надлишку рідка фаза і при охолодженні від точки 2 до точки 3 з неї виділяються вже первинні кристали b-твердого розчину. При охолодженні сплаву IV від точки 3 до точки 4 матимемо однофазний b-твердий розчин, в якому ніяких змін не буде. В точці 4 b-твердий розчин стає гранично насиченим компонентом А і при подальшому його охолодженні в інтервалі температур 4-5 відбувається вторинна кристалізація з виділенням кристалів bII (рис. 1.7, б) [4].
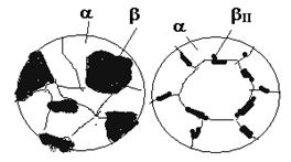
а б
Рис. 1.7 – Схеми мікроструктур сплавів III (а) і IV (б)
- ДІАГРАМИ СТАНУ З УТВОРЕННЯМ ХІМІЧНОЇ СПОЛУКИ
- Діаграми стану систем з хімічними сполуками
У подвійних системах можуть утворюватись хімічні сполуки між компонентами із загальною формулою АmBn. Найчастіше ці хімічні сполуки утворюються безпосередньо з рідини: РАm Bn.
Конкретний вигляд діаграми визначається взаємодією її компонентів, передусім розчинністю їх у твердому стані, а також наявністю певних перетворень. При цьому хімічна сполука розглядається як окремий компонент. На рис. 1.8 показані два можливих варіанти: а – з відсутністю розчинності компонентів у твердому стані і б – з утворенням обмежених твердих розчинів на основі як чистих компонентів, так і хімічної сполуки — a-, b- і g-фаз.
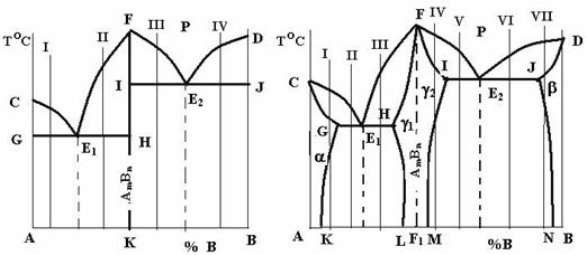
а б
Рис. 1.8 – Діаграми стану систем з хімічними сполуками
Систему, діаграма стану якої зображена на рис. 1.8, а, можна розглядати як сукупність двох систем з компонентами А і АmBn та B і AmBn.. Ці дві системи розділені вертикаллю FK. У кожній з підсистем утворюється власна евтектика – Е1 як суміш двох фаз – (А + АmBn) і Е2 (В+ АmBn). Кристалізація і формування структур, наприклад, сплавів I, II, III, IV відбувається аналогічно тим, що були розглянуті нами на рис. 1.3 цієї лабораторної роботи [8].
Для систем, діаграма стану яких показана на рис. 1.8, б, характерним є утворення обмежених твердих розчинів: твердого розчину хімічної сполуки AmBn в компоненті А – a-фази; твердого розчину хімічної сполуки в компоненті В – b-фази та твердих розчинів компонентів А і В в хімічній сполуці – відповідно g1-фази і g2-фази. Зазвичай ці тверді розчини g1 і g2 розглядаються як один твердий розчин — g-фаза. Тому на діаграмі (рис. 1.8, б) область FIMLHF розглядається як однофазна з твердим розчином g. Пунктирна лінія FF1 ділить цю область на дві частини: ліворуч від неї g-фазу можна вважати твердим розчином компонента А в хімічній сполуці AmBn, праворуч – твердим розчином компонента В в цій же сполуці.
Евтектики в цій системі складаються з суміші кристалів твердих розчинів:
Е1∙(a+g), (1.5)
Е2∙(g+b). (1.6)
Кристалізація сплавів і формування остаточних структур в цій системі відбувається аналогічно розглянутих на рис. 1.5.
2.2 Діаграми стану систем з поліморфними компонентами
Поліморфні перетворення одного або обох компонентів сплаву суттєво змінюють його структуру і властивості. Такі перетворення є в багатьох промислових сплавах, наприклад, сплавах заліза, титану та ін.
Конкретний вигляд діаграми стану визначається не тільки взаємодією компонентів, а і їх поліморфних модифікацій. Крім того, важливу роль відіграє наявність або відсутність взаємної розчинності компонентів та їх поліморфних модифікацій у твердому стані. Тому діаграми стану з поліморфними компонентами надзвичайно численні. Розглянемо тільки одну систему, в якій обидва компоненти є поліморфними і їх високотемпературні модифікації (Аb і Вb) утворюють неперервний ряд b-твердих розчинів (рис. 1.9), а низькотемпературні Аa і Вa - обмежені a- і a1- тверді розчини [6].
Лінії KE і EL, на яких починається перетворення b-твердого розчину, перетинаються в одній точці Е, яка називається евтектоїдною, а лінія GEH — лінією евтектоїдного перетворення:Е(G+1H) (читається: твердий розчин b – складу точки Е розкладається на суміш двох фаз — твердого розчину a – складу точки G і твердого розчину a1 – складу точки Н.
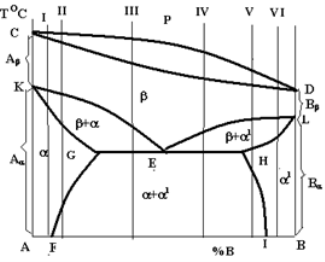
Рис. 1.9 – Діаграма стану системи, компоненти якої мають поліморфні перетворення
Лінії GF i HI на діаграмі стану є лініями сольвусу. Сплави в інтервалі між точками G і E називаються доевтектоїдними, а сплави в інтервалі між точками E і H – заевтектоїдними. Схеми структур цих сплавів зображаються аналогічно тим, які зображені на рис. 1.4.
- ДІАГРАМИ СТАНУ З РІЗНОЮ РОЗЧИННІСТЮ КОМПОНЕНТІВ
3.1 Зображення діаграм
Фазові діаграми з необмеженою розчинністю компонентів один в одному зустрічається відносно рідко Набагато частіше доводиться мати справу з фазовими діаграмами з обмеженою розчинністю компонентів один в одному Термодинамічний аналіз дозволяє якісно пояснити перехід від діаграм стану з необмеженою розчинністю до діаграм стану з обмеженою розчинністю компонентів один в одному
Як відомо з термодинаміки, термодинамічно рівноважного стану системи за даних умов (T=сonst і P=сonst) відповідає мінімум термодинамічного потенціалу Гіббса:
G=H−T∙S=U+P∙V −T∙S, (1.7)
де H - ентальпія,
T – температура;
S – ентропія;
U - внутрішня енергія;
P - тиск;
V – об`єм термодинамічної системи.
Ентропія завжди позитивна і збільшується з підвищенням температури, тому з ростом температури потенціал Гіббса G завжди зменшується Крім того, при фіксованій температурі для рідкої фази ентропія більше, ніж для твердої фази того ж складу, і тому крива G(T ) Для рідкої фази знижується з ростом температури різкіше, ніж для твердої фази.
Діаграма стану для випадку повної взаємної розчинності компонентів А і В у рідкому і твердому станах представлена на рис. 1.10. Лінія KmL є лінією ликвидус, лінія KnL - лінією солидус. Вище лінії ликвидус існує тільки рідка фаза, а нижче лінії солидус - тільки тверда, що представляє собою твердий розчин а. Між лініями ликвидус і солидус в рівновазі знаходяться дві фази - рідина і α-твердий розчин. Розглянемо процес кристалізації одного зі сплавів даної системи. До точки 1 (тут і далі під точкою мається на увазі відповідна температура) сплав знаходиться в рідкому стані [8].
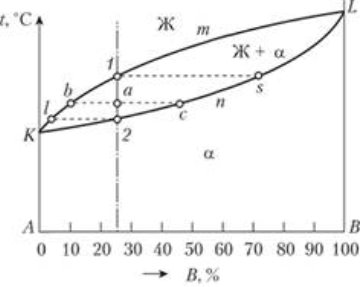
Рис. 1.10 - Діаграма стану сплавів, компоненти яких утворюють тверді розчини необмеженої розчинності
При досягненні температури, відповідної точці 1, з рідини починає кристалізуватися α-твердий розчин. Процес кристалізації протікає при зниженні температури, оскільки відповідно до правила фаз в двухкомпонентной системі при наявності двох фаз число ступенів свободи дорівнює 1(С=2-2+1).
У процесі кристалізації сплаву (інтервал 1-2) відбувається зміна концентрації компонентів в фазах і кількісного співвідношення фаз: хімічний склад рідкої фази змінюється по лінії 11; хімічний склад α-твердого розчину - по лінії s2; кількість рідкої фази зменшується (відрізок ас - в точці 2 його величина дорівнює нулю - відбулося повне затвердіння), а твердої (відрізок ab) зростає. При досягненні точки 2 кристалізація сплаву закінчується, а нижче точки 2 відбувається охолодження сплаву в твердому стані.
Внутрішньокристалічна сегрегація проявляється в неоднорідності складу всередині окремих кристалітів. Кристали твердого розчину, що утворюються в початковий момент кристалізації, містять більшу кількість тугоплавкого компонента В, ніж шари, що приєднуються до виділився кристалу при зниженні температури. У них концентрація тугоплавкого компонента поступово знижується. Це легко простежити по діаграмі стану, визначаючи зміну складу α-твердого розчину в інтервалі температур між лініями ликвидус і солидус (в момент початку кристалізації склад а відповідає проекції точки s, в кінці - точці 2). Такий вид ликвации проявляється тим сильніше, чим більше відстань між лініями ликвидус і солидус сплаву. Внутрішньокристалічна ізоляція може бути зменшена в результаті тривалої витримки сплаву, що знаходиться в твердому стані, при температурах, близьких до температури солідусу (гомогенізований отжиг), що забезпечує досить високу швидкість дифузії і призводить до вирівнювання хімічного складу зерен.
Очевидно, що необмежена розчинність спостерігається в системах, для яких ΔH <0 як у рідкому L, так і твердому S станах у всьому інтервалі концентрацій Проте залежно від співвідношення між абсолютними значеннями ΔH(L) І ΔH(S) Діаграми з необмеженою розчинністю компонентів один в одному мають свої особливості.
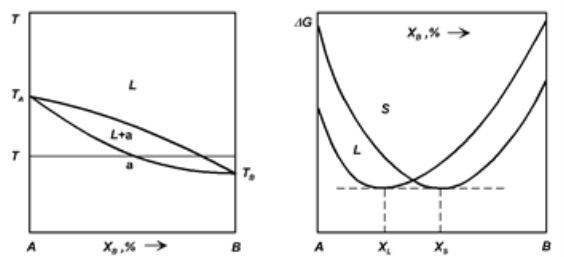
а б
Рис 1.11 - Діаграма
а – стану бінарної системи з необмеженою розчинністю компонентів один в одному;
б – залежності термодинамічної потенціалу твердих і рідких розчинів від складу при деякій температурі T.
Концентрації співіснують при даній температурі T рідкої і твердої фаз, певні за координатами точок дотику загальної дотичної до кривих ΔG(L) І ΔG(S) Для бінарних систем умови рівноваги двох фаз виражаються умовою спільності дотичній до кривих ΔG(L) і ΔG(S) Двох фаз, що у рівновазі [8].
Криві залежності термодинамічної потенціалу рідкої і твердої фаз від складу в усьому інтервалі концентрацій переміщаються при зміні температури один щодо одного. Їх взаємне розташування визначається тим, яка з фаз при даній температурі має найменшим термодинамічним потенціалом Гіббса, тобто є рівноважною складовою (рис. 1.12 а).
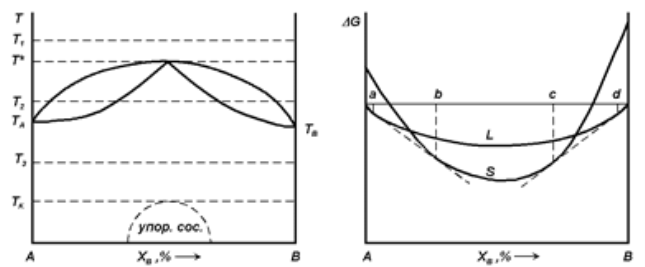
а б
Рис. 1.12 - Діаграма
а – стану бінарної системи з необмеженою розчинністю компонентів один в одному і максимумом температури плавлення;
б – залежності термодинамічної потенціалу твердих і рідких розчинів від складу при деякій температурі T2 такий, що T∗>T2>Tпл (A).
З ростом абсолютної величини негативною по знаку ΔH (S) буде посилюватися тенденція до впорядкування твердого розчину. При високих температурах цієї тенденції перешкоджатиме ентропійний внесок у
∆G(S). Отже, впорядкування буде проявлятися, як правило, тільки при відносно низьких температурах.
Впорядкування супроводжується різкою зміною властивостей твердого розчину, наприклад, значною зміною електротеплопровідності, пластичності і так далі. Процес упорядкування є дифузійним процесом (перетворення супроводжується переміщенням атомів), тому повільне охолодження сприяє упорядкуванню температури.
Ступінь упорядкування твердого розчину визначається відхиленням числа найближчих сусідів від передбаченого теорією ймовірності. Наприклад, якщо твердий розчин B в A містить 25 атомів % B, то перша (і будь-яка інша) координаційна сфера за відсутності впорядкування повинна містити в середньому 75% атомів A і 25% атомів B. Якщо ж атоми A виявляться оточеними в першій координаційній сфері атомами B більш ніж на 25%, то твердий розчин буде упорядковуватись, якщо ж більш ніж 75% сусідів будуть атомами A, то буде існувати тенденція до розшарування (або воно настане) твердого розчину на дві фази [6].
Таким чином, у твердих розчинах можливе різне впорядкування в розташуванні атомів. У невпорядкованих твердих розчинах заміщені атоми різного гатунку довільно розподілені у вузлах кристалічної решітки, то тобто відсутній дальній і ближній порядок. У твердих розчинах впровадження атомів одного компонента утворюють регулярну кристалічну решітку, атоми іншого сорту безладно розподілені в міжвузлах цієї решітки. У впорядкованому твердому розчині атоми компонентів утворюють кілька вставлених один в одну кристалічних надрешіток.
Якщо сили хімічного звязку різнорідних атомів слабкі і велика різниця в розмірах атомів взаємодіючих компонентів, тобто велика енергія пружної деформації при утворенні твердого розчину, то в цьому випадку ΔH – величина позитивна. Нехай ΔH(L)>0 і ΔH(S)>0, тоді, якщо при температурі T1>Tпл (A). Крива ΔG(L) розташована нижче, ніж ΔG(S). У всьому інтервалі концентрацій при Tпл(B)<T <Tпл(A). Криві ΔG для рідкого і твердого розчинів перетинаються тільки в одній точці у всьому інтервалі концентрацій але в інтервалі температур T ∗<T2<Tпл (B). Криві ΔG для рідкого і твердого розчинів так само, як у попередньому випадку, перетинаються в двох точках (рис 1.13,б). І в інтервалі концентрацій між точками перетину утруднено утворення твердого розчину ΔH(S)>∆H (L) і при T3<T * крива ΔG(S) розташована нижче, ніж ΔG(L). У всьому інтервалі концентрацій, то лінії ліквідусу і солідусу будуть мати загальний мінімум (рис 1.13,а) [8].
Із збільшенням величини позитивного ΔH(S) утворення звязків A-A і B-B буде більш вигідним у порівнянні з утворенням звязків A-B, тобто буде проявлятися тенденція до розпаду твердого розчину і утворення механічної суміші. При високих температурах, близьких до температури, при якій лінії ліквідусу і солідусу мають загальний мінімум. Сплави будуть кристалізуватися у вигляді твердих розчинів, але при більш низьких температурах твердий розчин може почати розпадатися, перетворюючись на механічну суміш твердих розчинів менший концентрації (α1 + α2). Якщо ΔH(S) невелика, то ця температура низька і розпад твердого розчину не відбувається. Однак зі зростанням ΔH (S) ця температура збільшується, а температура загального мінімуму ліній ліквідусу і солідусу одночасно знижується до тих пір, поки їх значення не співпадуть. Така тенденція призведе до перетворення діаграми стану з діаграми стану з необмеженою розчинністю компонентів один в одному в діаграму стану з евтектичним перетворенням, на якій вже при температурі кристалізації рідкої фази утворюватиметься двофазна суміш.
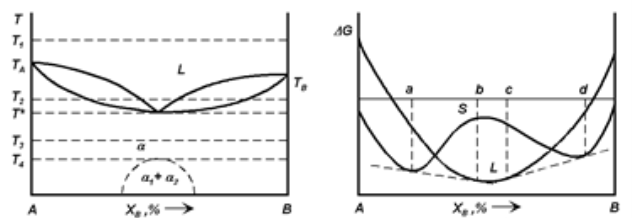
а б
Рис 1.13 - Діаграма
а – стану бінарної системи з необмеженою розчинністю компонентів один в одному і мінімумом температури плавлення;
б – залежності термодинамічної потенціалу твердих і рідких розчинів від складу при деякій температурі T2 такий, що T∗<T2<Tпл (B).
3.2 Застосування діаграм твердих сплавів
Діаграми стану твердих сплавів знайшли свою широке застосування в чорній металургії (виробництво чавуну та сталей), кольоровій металургії, при виробництві інтерметалічних сполук та очистці сплавів від домішок.
Діаграма стану (діаграма фазової рівноваги) сплавів «залізо-вуглець» - графічне відображення фазового стану сплавів заліза з вуглецем в залежності від їх хімічного складу і температури. Фазова діаграма стану «залізо-вуглець» є фундаментом науки про сталь і чавун, як сплави заліза з вуглецем.
Вуглець із залізом утворює хімічну сполуку Fe3C (цементит) або може перебувати у сплаві у вільному стані у вигляді графіту. Відповідно є дві діаграми сплавів «залізо-вуглець»: цементитна і графітна. Оскільки на практиці застосовують сплави заліза із вмістом вуглецю до 6,67% (що відповідає вмісту вуглецю у цементиті), то зазвичай розглядається частина діаграми стану від чистого заліза до вмісту вуглецю 6,67%, що відповідає цементиту і вона носить назву «цементитна». Оскільки цементит фаза метастабільна, то і відповідна діаграма називається метастабільною (суцільні лінії на рис. 1.14) [10].
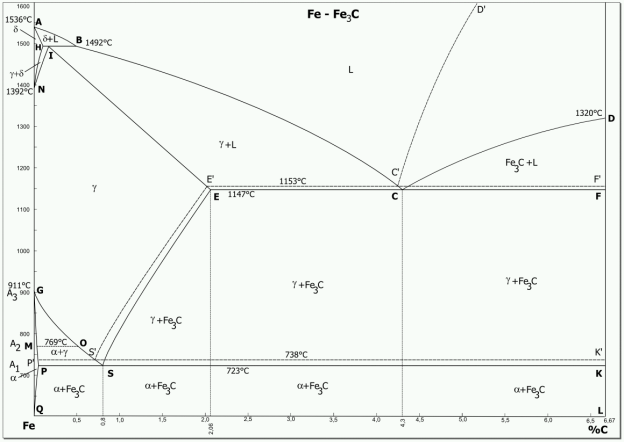
Рис. 1.14 - Головна частина діаграми стану сплавів «залізо-вуглець»
Для сірих чавунів і графітизованих сталей слід розглядати стабільну діаграму «залізо-графіт» (Fe-Гр) оскільки саме графіт є стабільною фазою. Цементит утворюється набагато швидше графіту і в багатьох сталях і білих чавунах може існувати досить довго. У сірих чавунах графіт існує обов'язково. На рис. 1.14 тонкими пунктирними лініями показані лінії стабільної рівноваги (тобто за участю графіту), там де вони відрізняються від ліній метастабільної рівноваги (за участю цементиту), а відповідні точки позначені штрихом.
ACD — ліквідус; AECF — солідус. Вище лінії ACD сплави системи перебувають у рідкому стані. По лінії AC з рідкого розчину починають випадати кристали твердого розчину вуглецю в γ—залізі, який називається аустенітом, отже, в області ACE буде суміш двох фаз — рідкого розчину і аустеніту; по лінії CD з рідкого розчину починають випадати кристали цементиту; в області DCF міститься суміш двох фаз — рідкого розчину і цементиту.
Перетворення у твердому стані (вторинна кристалізація) відбувається по лініях GSE, PSK і GPQ. Перетворення у твердому стані відбуваються внаслідок переходу заліза з однієї модифікації в іншу, а також у зв'язку із зміною розчинності вуглецю в залізі.
В області діаграми AGSE існує аустеніт. При охолодженні сплавів аустеніт розпадається з виділенням по лінії GS фериту (твердий розчин вуглецю в α-залізі), а по лінії SE — вторинного цементиту (хімічна сполука Fe3C). В області діаграми GSP міститься суміш двох фаз — фериту і аустеніту, а в області SEE1 — суміш вторинного цементиту і аустеніту. По лінії PSK відбувається розпад аустеніту з утворенням перліту; тому ця лінія називається лінією остаточного перетворення аустеніту в перліт або перлітною [9].
У точці С при вмісті 4,3 % вуглецю і температурі 1147 °C відбувається одночасно кристалізація аустеніту і цементиту і утворюється їх тонка механічна суміш евтектика, яка називається ледебуритом. Точку С називають евтектичною точкою. Ледебурит є у всіх сплавах, які містять 2,14...6,67 % вуглецю. Ці сплави є чавунами. Точка Е відповідає граничному насиченню заліза вуглецем (2,14 %). Сплави, які лежать ліворуч від цієї точки, належать до сталей.
У точці S при вмісті 0,8 % вуглецю і температурі 727 °C аустеніт розпадається і кристалізується тонка механічна суміш фериту та цементиту вторинного — евтектоїд, який називається перлітом. Провівши аналіз перетворень на діаграмі стану «залізо-цементит», можна зробити висновок про структуру сталей та чавунів у нормальних умовах. Сталі із вмістом вуглецю до 0,8 % мають структуру ферит + перліт; із вмістом 0,8 % вуглецю — чистий перліт; із вмістом від 0,8 до 2,14 % вуглецю — перліт + цементит вторинний. Чавуни із вмістом від 2,14 до 4,3 % вуглецю мають структуру перліт + цементит вторинний + ледебурит; із вмістом 4,3 % вуглецю — чистий ледебурит; із вмістом вуглецю від 4,3 до 6,67 % — цементит первинний і ледебурит [10].
Координати характерних точок:
- A:(0 %/1536 °C) B:(0,53 %/1492 °C) C:(4,3 %/1147 °C) D:(6,67 %/1320 °C) E:(2,06 %/1147 °C);
- F: (6,67 %/1147 °C) G: (0 %/911 °C) H: (0,1 %/1493 °C) I: (0,16 %/1493 °C) K: (6,67 %/723 °C);
- N: (0 %/1392 °C) P: (0,022 %/723 °C) S: (0,8 %/723 °C) Q: (0,002 %/20 °C) M: (0 %/769 °C);
- S': (0,69 %/738 °C) E': (2,03 %/1153 °C) C': (4,25 %/1153 °C).
ВИСНОВКИ
1 Розглянута загальна характеристика і фізико-хімічні параметри діаграми стану тверде тіло - рідина, їх застосування в науці та виробництві.
2 Знайдено, що діаграми стану або діаграми фазової рівноваги у зручній графічній формі показують фазовий і структурний склад сплавів залежно від температури та концентрації.
3 Показано, що діаграми стану будують для умов рівноваги, які досягаються тільки при дуже малих швидкостях охолодження або тривалому нагріванні.
4 Відзначено, що у кристалізації евтектики беруть участь три фази і згідно з правилом фаз система є нонваріантною, тобто кристалізація евтектики проходить при постійній температурі, що й видно на кривих охолодження.
ПЕРЕЛІК ПОСИЛАНЬ
1 Стромберг А.Г., Семченко Д.П. Фізична хімія. - М.: 67 В.Ш., 1988.- 496 с.
2 Голіков Г.А. Фізична хімія.- М.: Хімія, 1988.- 382 с.
3 Гомонай В.І., Гомонай О.В. Фізична хімія. Ч.2.- Ужгород: Мистецька лінія, 2000. -290 с.
4 Практикум з фізичної хімії ( ред. Кудряшов І.В.). - М.: В.Ш., 1986. – 496 с.
5 Ковальчук Є. П., Решетняк О. В. Фізична хімія: Підручник. – Львів: Видавничий центр ЛНУ імені Івана Франка, 2007. – 800 с.
6 Кірєєв В. А. Курс фізичної хімії. — М. : Хімія, 1975. — 776 с.
7 Фізична та колоїдна хімія / В. І. Кабачний, Л. К. Осипенко, Л. Д. Грицан і ін. – 2-е вид., перероб. і доп. – Х. : В-во НФаУ, 2010. – 432 с.
8 Кабачний, В. І. Лекції з фізичної хімії : навч. посіб. для студ. вищ. фармац. навч. закл. / В. І. Кабачний, Л. Д. Грицан, Т. О. Томаровська, Л. 9 К. Осіпенко; за ред. В. І. Кабачного. — Х. : НФаУ: Золоті сторінки, 2012. – 280 с.
10 ДревінгВ.П., Калашніков Я.А. Правило фаз. - М.: МГУ, 1964. – 455 с.
Хільчевський В. В. Матеріалознавство і технологія конструкційних матеріалів: Навчальний посібник. К.: Либідь, 2002. — 328с.


про публікацію авторської розробки
Додати розробку
