Фізичні властивості оксидів. Фізичні властивості основ.
Класс: 8
Тема: Фізичні властивості оксидів. Фізичні властивості основ.
Мета: формулювати визначення основних, кислотних, амфотерних оксидів; характеризувати фізичні властивості оксидів та основ;
Тип уроку: вивчення нового матеріалу
Обладнення: підручник, презентація.
Хід уроку
1. Організаційний момент
Привітання з класом. Перевірка готовності до уроку
2. Повідомлення учням теми, мети уроку.
3. Мотивація і актуалізація.
Що вам відомо про найпоширеніший на Землі оксид — воду?
Пригадайте та сформулюйте визначення поняття «основа».
4. Вивчення нового матеріалу
Фізичні властивості оксидів. Оксиди як сполуки елементів з Оксигеном досить поширені в природі.
За нормальних умов вони перебувають у різних агрегатних станах: газоподібному, рідкому та твердому.
Наприклад: Поширені в природі й утворені внаслідок господарської діяльності людини карбон(IV) оксид, сульфур(IV) оксид, нітроген(IV) оксид є газами. Як вам відомо, великі концентрації цих газів в атмосфері спричиняють утворення кислотних дощів.
Багатьом оксидам притаманний характерний запах. Наприклад, сульфур(IV) оксид, нітроген(IV) оксид — задушливі гази; карбон(II) оксид, карбон(IV) оксид — без запаху, отруйні.
Силіцій(IV) оксид, фосфор(V) оксид, магній оксид та інші тверді речовини — безбарвні або мають характерне забарвлення. Зокрема, хром(III) оксид — зелений, магній оксид — білий, ферум(III) оксид і нітроген(IV) оксид — бурого кольору, а силіцій(IV) оксид — безбарвний.
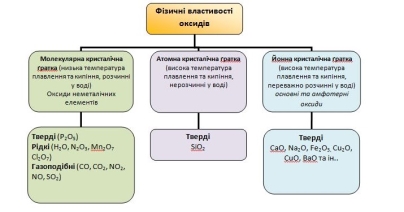
У твердому стані оксиди утворюють атомні, йонні або молекулярні структури (кристалічні ґратки). До оксидів з молекулярними кристалічними ґратками належать карбон(IV) оксид, вода. Атомну кристалічну ґратку має силіцій(IV) оксид, йонну — алюміній оксид.
Для оксидів з атомними структурами характерна висока твердість, з молекулярними — леткість. Температури плавлення та кипіння змінюються в широкому діапазоні.
Фізичні властивості основ. За нормальних умов розчинні основи (луги) — тверді кристалічні, білого кольору речовини. Переважно всі вони розчиняються у воді в будь-яких співвідношеннях, утворюючи прозорі розчини, мильні на дотик. Їм властиве явище гігроскопічності (вбирання водяної пари з повітря), тому луги зберігають у закритих ємностях. Кальцій гідроксид — малорозчинний.
Під час розчинення лугів у воді виділяється тепло. Основи, утворені лужними й лужноземельними металами, роз’їдають органічні речовини (целюлозу, білок). Звідси пішли назви натрій і калій гідроксидів, відповідно їдкий натр і їдке калі. Через це під час роботи з лугами необхідно дотримуватися правил безпеки.
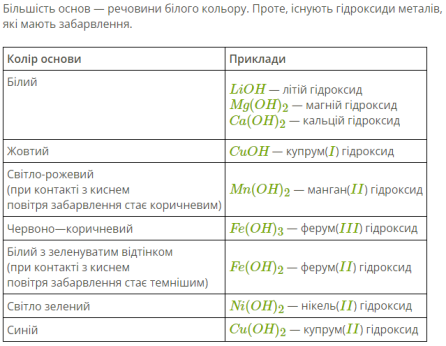
Забарвлення основ.
5. Узагальнення та систематизація знань.
Завдання 1. Поділіть речовини на відповідні групи(Тверді, рідкі, газоподібні оксиди)
H2O, N2O3, CO, P2O5, SO2, NO, Cl2O7
Завдання 2. Поділіть Речовини на розчинні та малорозчинні, дайте їм назви.
LiOH ,NaOH ,KOH , Ca(OH)2,RbOH ,CsOH , Sr(OH)2,FrOH ,Ba(OH)2 ,Ra(OH)2
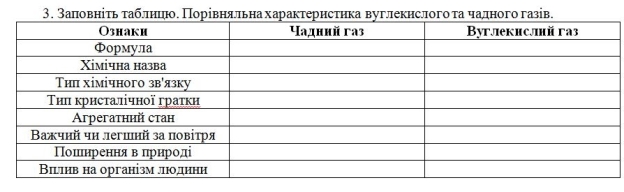
Завдання 3. Заповніть таблицю
6. Підбиття підсумків уроку.
Фронтальне опитування.
- Чи цікаво було на уроці?
- Чи важливо було вивчати дану тему?
7. Повідомлення домашнього завдання.
Виконання інтерактивних вправ онлайн:
Вправа 1 https://learningapps.org/watch?v=pbac3fys322
Вправа 2 https://learningapps.org/watch?v=piefjdm1t22
Презентація до уроку: https://www.canva.com/design/DAE7txLNVzc/2lBwAMvh4MBLOJqc6gfy8Q/edit?utm_content=DAE7txLNVzc&utm_campaign=designshare&utm_medium=link2&utm_source=sharebutton


про публікацію авторської розробки
Додати розробку
