Склад і номенклатура основ
Класс: 8
Тема: Склад і номенклатура основ
Мета: формувати знання про склад основних класів складних неорганічних сполук та їх номенклатуру на прикладі основ; формувати вміння складати формули основ та давати їм назви.
Тип уроку: вивчення нового матеріалу
Обладнення: підручник, презентація, зразки основ, періодична система хімічних елементів.
Хід уроку
1. Організаційний момент
Привітання з класом. Перевірка готовності до уроку
2. Актуалізація опорних знань.
Пригадайте з курсу хімії 7 класу, що ви знаєте про взаємодію оксидів металічних і неметалічних елементів із водою.
3. Мотивація навчальної діяльності.
Оксиди найактивніших металічних елементів легко сполучаються з водою. Результатом таких реакцій є гідроксиди. Якщо до складу гідроксиду входять 1-3 гідроксильні групи, то вони утворюють новий клас неорганічних сполук — основи.
4. Вивчення нового матеріалу
Наведемо приклади реакцій утворення основ:
![]()
З формул КОН і Са(ОН)2 видно, що до складу основ входять катіони металічних елементів і гідроксильні групи ОН. Отже, можемо скласти схему утворення назв основ
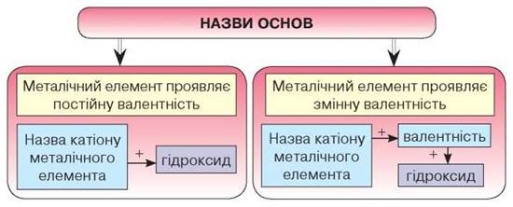
Основи класифікують за двома ознаками:
- 1) розчинністю у воді;
- 2) числом гідроксильних груп
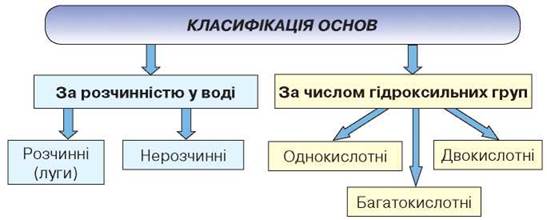
Наведіть приклади основ за поданою класифікацією
Загальна формула основ:
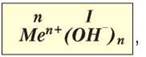
де n — число гідроксид-іонів; n+ — заряд катіона металічного елемента; Men+ — катіон металічного елемента; ОН- — гідроксид-іон.
Число гідроксильних груп залежить від валентності металу.
Розчинні у воді основи називають лугами. За таблицею розчинності можна визначити розчинні й нерозчинні у воді основи.
Приклади основ:
NaOH — натрій гідроксид
це неорганічна сполука, яка має надзвичайно широку сферу застосування. Речовина більш відома як каустична сода, яка широко застосовується в паперовій, харчовій, хімічній, косметичній та інших галузях промисловості. Сполука має вигляд твердих білих непрозорих кристалів. Натрій гідроксид відмінно розчиняється у воді, при цьому виділяючи тепло у значних кількостях. Також речовина проявляє сильні лужні властивості. Сполука є дуже токсичною – вона може спричинити корозію металів, тому при роботі з нею необхідно дотримуватися усіх норм та правил безпеки.
Fe ( OH ) 2 — ферум(II) гідроксид
порошок темно-червоного або коричневого кольору, практично не розчинний у воді. Він зустрічається в природі у вигляді мінералу гематиту. Цей оксид має амфотерні властивості.
Fe ( OH ) 3 — ферум(III) гідроксид
є нерозчинною речовиною бурого кольору. Його можна добути реакцією обміну між солями трьохвалентного Феруму і лугами у розчині.
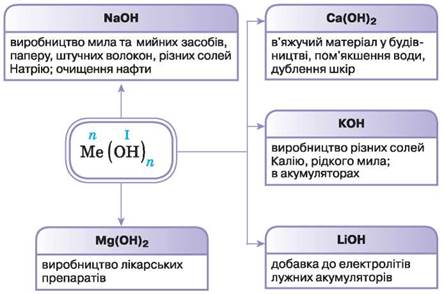
Використання основ
5. Узагальнення та систематизація знань.
Завдання 1
В наведеному переліку хімічних формул укажіть формули основ:
KOH, CaCl2, Al2O3, Ba(OH)2, MgCO3, Mn(OH)2, Ca(OH)2, H2 SO4, Na2O, LiOH. Дайте їм назву
Завдання 2
Складіть формули гідроксидів та назвіть їх за міжнародною номенклатурою
Al, Fe(III), K, Pb(II), Mg
Завдання 3
Знайти відповідність між основним оксидом та основою
https://learningapps.org/watch?v=p9f6spnkc22
6. Підбиття підсумків уроку.
Фронтальне опитування.
- Мені сподобалось сьогодні….
- Мені запамяталось…..
7. Повідомлення домашнього завдання.
Параграф 24, завдання після параграфу №179-182
Презентація до уроку: https://www.canva.com/design/DAE7nGugDnI/pV2yK-PJPWcmm6vamuaPPg/edit?utm_content=DAE7nGugDnI&utm_campaign=designshare&utm_medium=link2&utm_source=sharebutton


про публікацію авторської розробки
Додати розробку
