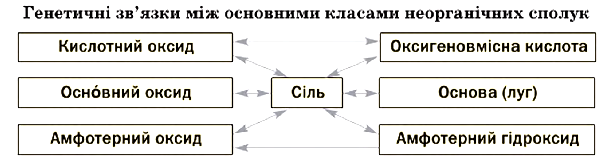
Генетичні зв’язки між основними класами неорганічних сполук
1
Конспект уроку
Урок № 2 Клас 9 Дата 7 вересня Вчитель ГАВРИЛЯК М.В
Тема: Генетичні зв’язки між основними класами неорганічних сполук
Навчальна мета: формувати поняття про генетичний зв'язок між класами неорганічних сполук; формувати вміння складати генетичні ланцюги між класами неорганічних сполук та відповідні рівняння хімічних реакцій.
Розвивальна мета: розвивати хімічну мову.
Виховна мета: виховувати інтерес до вивчення хімії.
Базові поняття і терміни: метали, неметали, неорганічні речовини, кислоти, основи, солі, оксиди, генетичний зв'язок.
Тип уроку: комбінований.
Методи форми та прийоми роботи: словесні (фронтальна бесіда), індивідуальні, практичні (виконання вправ), інтерактивні, методи контролю.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, ряд активності металів, таблиця розчинності.
Структура уроку з хронометражем:
- Організаційний етап (1 хв)
- Актуалізація опорних знань, перевірка домашнього завдання (10 хв)
- Мотивація навчальної діяльності (3 хв)
- Вивчення нового матеріалу (16 хв)
- Закріплення нового матеріалу (12 хв)
- Підбиття підсумків уроку (2 хв)
- Домашнє завдання (диференційоване) (1 хв)
Хід уроку
- Організаційний етап
Привітання, перевірка присутніх.
-
Актуалізація опорних знань, перевірка домашнього завдання
1. Хімічний диктант
Варіант І
- Ферум (ІІІ) оксид
- Сульфітна кислота
- Хром (ІІІ) гідроксид
- Барій ортофосфат
- Літій оксид
- Силікатна кислота
- Натрій сульфід
- Ферум (ІІ) гідроксид
- Йодидна кислота
- Алюміній бромід
- Карбонатна кислота
- Барій силікат
Варіант ІІ
- Бромідна кислота
- Магній оксид
- Калій сульфат
- Цинк гідроксид
- Арґентум нітрат
- Хром (ІІІ) оксид
- Метафосфатна кислота
- Манган (VII) оксид
- Кальцій хлорид
- Купрум (ІІ) гідроксид
- Калій силікат
- Ферум (ІІІ) сульфат
Класифікуйте записані сполуки.
- Мотивація навчальної діяльності
Усі класи речовин складаються з тих самих хімічних елементів: металів і неметалів.
- Чим вони відрізняються? (Кількісним і якісним складом)
Проблемне питання:
- Як пов’язані між собою основні класи неорганічних сполук?
- А чи існує зв’язок між окремими класами неорганічних сполук? У чому цей зв’язок виявляється?
Речовини одного класу взаємодіють з іншими речовинами. При цьому утворюються сполуки інших класів. Тобто шляхом хімічних перетворень сполуки одного класу можна перетворювати на інші. Ми говоримо,що між класами неорганічних сполук існує генетичний зв’язок, тобто вони взаємоперетворюються під час хімічних реакцій.
- Вивчення нового матеріалу
Взаємозв’язки між речовинами, які ґрунтуються на їх походженні та хімічних властивостях, називають генетичними зв’язками.
Вам відомо, що більшість простих речовин – металів, неметалів – вступає в реакції з киснем, перетворюючись на оксиди:
![]()
![]()
Майже всі метали взаємодіють з кислотами і солями; серед продуктів кожної такої реакції є сіль:
![]()
![]()
Найактивніші метали реагують з водою з утворенням лугів:
![]()
Із лугами взаємодіють метали, утворені елементами, оксиди і гідроксиди яких є амфотерними:
![]()
- Перетворіть схему реакції на хімічне рівняння.
![]()
Неметали, які утворені елементами VI та VII груп, вступають у реакції з воднем. Розчини продуктів таких реакцій (H2S, HF та ін.) є безоксигеновими кислотами. Ці неметали також взаємодіють з металами з утворенням солей:
![]()
![]()
Складемо схему, яка ілюструє здатність простих речовин до хімічних перетворень на сполуки різних класів.
![]()
![]()
![]()
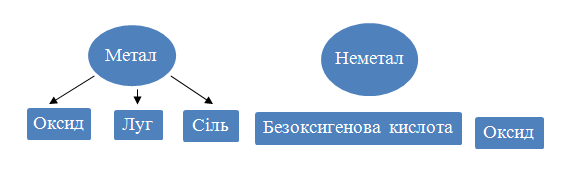
Неорганічні сполуки здатні до різноманітних взаємоперетворень.
Майже всі кислотні і деякі основні оксиди взаємодіють з водою. Продуктом реакції в першому випадку є оксигеновмісна кислота, а в другому – луг.
Кожна сполука – оксид, основа, амфотерний гідроксид, кислота – під час певних реакцій перетворюється на відповідну сіль. Нагріванням нерозчинних основ, амфотерних гідроксидів, оксигеновмісних кислот або солей можна добути оксиди.
Слід запам’ятати такі закономірності:
- якщо дві сполуки мають аналогічні властивості (наприклад, два основні оксиди, основний оксид і основа), то вони не взаємодіють одна з одною (солі є винятками);
- реакції між сполуками із протилежними властивостями майже завжди відбуваються;
- амфотерні сполуки взаємодіють зі сполуками основного і кислотного характеру, але не реагують одна з одною.
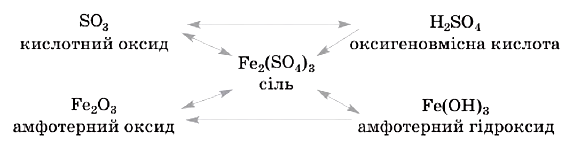
Розглянемо схему для сполук металічного і неметалічного елементів (Феруму і Сульфуру), запишемо відповідні рівняння реакцій:
Використовуючи такі схеми, можна планувати і здійснювати послідовні хімічні перетворення неорганічних сполук.
Демонстрація. Взаємодія кальцій оксиду з водою, дослідження добутого розчину індикатором, пропускання вуглекислого газу крізь розчин
Насипаємо у пробірку кальцій оксид СаО додаємо 1-2 мл води:
СаО + Н2О → Са(ОН)2
Перевіряємо універсальним індикаторним папірцем – забарвлення змінилося на синє, отже отриманий розчин – має лужне середовище.
Добування вуглекислого газу та його виявлення
- Зберіть прилад для добування вуглекислого газу, як на мал. 1.
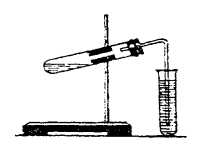
Мал. 1. Прилад для добування вуглекислого газу
- Перевірте прилад на герметичність. Опишіть спостереження, зробіть висновок.
- Покладіть у пробірку кілька шматочків крейди і долийте 2-3 мл хлоридної кислоти. Швидко закрийте пробірку пробкою з газовідвідною трубкою і на хвилину занурте її кінець у порожню пробірку. Опишіть спостереження.
Спостерігаємо виділення бульбашок газу
- За допомогою запаленої скіпки визначте наявність у пробірці вуглекислого газу. Опишіть спостереження. Зазначте фізичні властивості вуглекислого газу.
- Складіть рівняння реакцій. Укажіть назви речовин.
![]()
CaCl2 – кальцій хлорид
CO2 – карбон (IV) оксид
Взаємодія вуглекислого газу з кальцій гідроксидом. Взаємоперетворення карбонатів і гідроген карбонатів
- Пропустіть порцію вуглекислого газу у пробірку з 2 мл вапняної води до утворення осаду. Опишіть спостереження.
Поява каламуті внаслідок утворення нерозчинного кальцій карбонату.
- Продовжуйте пропускати вуглекислий газ до утворення прозорого розчину. Опишіть спостереження змін.
Каламуть зникає, тому що нерозчинний кальцій карбонат взаємодіє з карбон (IV) оксидом, і внаслідок реакції утворюється розчинний кальцій гідроген карбонат.
- Складіть схему перетворень і запишіть рівняння відповідних реакцій. Зробіть висновок про умови утворення карбонатів і гідроген карбонатів.
![]()
![]()
-
Закріплення вивченого матеріалу
- Здійсніть перетворення:
S→SO2→H2SO3→ Na2SO3
- S +O2→SO2
- SO2+ H2O →H2SO3
- H2SO3 +2NaOH→ Na2SO3+ 2H2O
Запишемо цю схему в загальному вигляді: неметал → кислотний оксид → кислота → сіль (схема 1)
- Na→Na2O→NaOH→Na2SO3
- 2Na +O2 →Na2O
- Na2O +H2O →NaOH
- H2SO3 +2NaOH→ Na2SO3+ 2H2O
Запишемо її в загальному вигляді: метал → основний оксид → основа → сіль (схема 2)
Подібних ланцюжків можна запропонувати багато.
- Напишіть рівняння реакцій, щоб здійснити перетворення.
Варіант І
а) P → P2O5 → H3PO4 → Na3PO4
б) Zn → ZnO → ZnCl2 → Zn(OH)2 → ZnSO4
Варіант ІІ
а) Ca → CaO → Ca(OH)2 → CaCO3
б) Al → Al2O3 → Al2(SO4)3 → Al(OH)3 → AlCl3
- Із чотирьох елементів – Натрій, Сульфур, Оксиген і Гідроген – складіть формули: однієї основи; однієї кислоти; трьох середніх солей. Як ви вважаєте, які з цих речовин реагуватимуть між собою? Складіть рівняння хімічних реакцій, укажіть їх тип.
- Підбиття підсумків уроку
Підбиваємо підсумки уроку, оцінювання.
- Домашнє завдання
Опрацювати §
- Із чотирьох елементів – Алюміній, Хлор, Оксиген і Гідроген – складіть формули: однієї основи; однієї кислоти; однієї середньої солі. Які з цих речовин, на вашу думку, реагуватимуть між собою? Складіть рівняння хімічних реакцій, укажіть їх тип.

про публікацію авторської розробки
Додати розробку
