Урок "Хімічні властивості амфотерних гідроксидів"
У конспекті подані різні форми роботи на уроці. Містить ігрові інтерактивні прийоми "Коло ідей", "Навчаючи вчусь" та інше. Подано проблемні завдання.
Тема. Хімічні властивості амфотерних гідроксидів.
Мета: знаннєвий компонент: називати амфотерні сполуки за сучасною номенклатурою та наводити приклади;
діяльнісний компонент: розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ; розширити знання учнів про властивості основ і кислот на прикладі амфотерних сполук; формувати вміння та навички складання хімічних реакцій на прикладі амфотерних основ;
ціннісний компонент: обґрунтовувати залежність між складом і властивостями та застосуванням речовин.
розвивати вміння спостерігати, творчо мислити, формувати пізнавальних
інтерес; виховувати прагнення до знань, толерантність.
Тип уроку: формування знань, умінь, навичок.
Форми і методи: індивідуальна робота, групова робота, проблемне запитання,
гра «Ланцюжок відповідей на запитання», ігровий
інтерактивний прийом «Коло ідей», гра «Навчаючи вчусь»,
гра «Хто більше розв’яже?»
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, таблиця
розчинності неорганічних речовин у воді, картки, розчини
хлоридної кислоти, натрій гідроксиду, ферум (ІІ) хлориду, цинк
сульфату, купрум (ІІ ) хлориду; пробірки, штативи.
Хід уроку
І. Організаційний етап.
Привітання, побажання хорошого настрою на уроці.
ІІ. Перевірка домашнього завдання (письмовий хімічний диктант на 2
варіанти) (6-8 хв)
Варіант 1
Завдання. У таблиці під кожним номером твердження поставте «+», якщо ви погоджуєтеся, «-» - не погоджуєтеся.
1. Продуктом реакції нейтралізації є сіль і вода.
2. Калій гідроксид і натрій гідроксид можуть розкладатися при нагріванні.
3. Cu(OH)2 + 2 HCl = CuCl2 + H2O. Це приклад реакції нейтралізації.
4. Fe(OH)2 . Дана реакція можлива.
5. У розчині купрум ( ІІ ) гідроксиду фенолфталеїн стає малинового кольору.
6. У рівнянні реакції NaOH + SO2 = ? + H2O пропущеною речовиною є Na2SO4
7. Ni(OH)2 . Загальна сума коефіцієнтів у закінченому рівнянні реакції
дорівнює 4.
8. У водному розчині дана реакція відбувається: Fe(OH)2 + BaCl2 .
|
Номер запитання |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Відповідь |
|
|
|
|
|
|
|
|
Варіант 2
Завдання. У таблиці під кожним номером твердження поставте «+», якщо ви погоджуєтеся, «-» - не погоджуєтеся.
1. Реакція нейтралізації – це реакція між основою і кислотним оксидом.
2. Основи розкладаються під час нагрівання на відповідний оксид та воду.
3. Са(OH)2 + SO3 = CaSO4 + H2O. Це приклад реакції нейтралізації.
4. NaOH . Дана реакція не можлива.
5. У розчині ферум ( ІІ ) гідроксиду фенолфталеїн не змінює своє забарвлення.
6. У рівнянні реакції ? + HCl = FeCl2 + H2O пропущеною речовиною є Fe.
7. Pb(OH)2 . Загальна сума коефіцієнтів у закінченому рівнянні реакції
дорівнює 3.
8. У водному розчині дана реакція відбувається: КОН + FeCl2 .
|
Номер запитання |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Відповідь |
|
|
|
|
|
|
|
|
ІІІ. Актуалізація опорних знань. («Ланцюжок відповідей на запитання»)
Учні по черзі відповідають на запитання:
- На які групи поділяються основи щодо води?
- В яких групах періодичної системи знаходяться металічні елементи, що утворюють луги?
- З допомогою яких індикаторів практично визначають луги?
- Із якими з перелічених речовин реагують луги?
- Які хімічні властивості мають нерозчинні основи?
- З допомогою яких індикаторів практично визначають кислоти?
- Із яким речовинами можуть взаємодіяти кислоти?
- Яка відмінність у властивостях лугів та нерозчинних основ?
ІV. Мотивація діяльності. (проблемне запитання, демонстрація 8, ігровий методичний прийом «Коло ідей»)
Вчитель. Запитання. Чи можуть основи взаємодіяти між собою?
(Учні думають і дають відповідь. Звичайно, вони мають відповісти «ні».)
Вчитель. Зараз ми проведемо невеличкий дослід. (демонстрація 8)
(Учні спостерігають за діями вчителя та слухають коментарі)
- Для досліду ми візьмемо розчини солей ферум (ІІ) хлориду, цинк сульфату, та купрум (ІІ) хлориду додамо до них розчин натрій гідроксиду. Утворяться основи – ферум (ІІ) гідроксид, цинк гідроксид, купрум (ІІ) гідроксид.
- Розливаємо розчин кожної основи у дві пробірки. В одну додаємо розчин хлоридної кислоти, в іншу – натрій гідроксиду.
Під час проведення досліду учні зустрічаються із, на перший погляд, парадоксальним явищем: цинк гідроксид розчиняється у розчині лугу.
Ігровий методичний прийом «Коло ідей» (3хв)
Тепер ви об'єднаєтеся в групи по 4 учні. Кожна група обговорить дослід та висуне пояснення цього явища. (обговорення у групах, висування припущень, обговорення)
V. Оголошення теми і мети уроку.
Тема уроку: Поняття про амфотерні основи.
А яка мета нашого уроку?
VІ. Формування знань, умінь, навичок. (робота в групах, «навчаючи вчусь»)
Вчитель. Деякі гідроксиди залежно від того, з якими речовинами вони реагують, виявляють основні або кислотні властивості. Такі сполуки називають амфотерними.
Здатність сполуки виявляти основні та кислотні властивості називають амфотерністю.
1. Гра «Навчаючи вчусь» (3-4 хв)
Поділ учнів на 4 групи.
Складіть формули амфотерних сполук.
|
Амфотерні елементи |
|
|
|
|
|
|
Амфотерний оксид цього елемента |
ZnO |
|
|
|
|
|
Амфотерний гідроксид цього елемента |
Zn(OH)2 H2ZnO2 |
|
|
|
|
(запис отриманих результатів на дошці)
2. Хімічні властивості.
Учні залишаються у своїх групах. (8 хв)
Завдання для 1 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості цинк гідроксиду як основи.
Завдання для 2 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості цинк гідроксиду як кислоти.
Завдання для 3 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості алюміній гідроксиду як основи.
Завдання для 4 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості алюміній гідроксиду як кислоти.
(Один представник із кожної групи записує на дошці рівняння реакцій, пояснює їх).
VІ. Закріплення вмінь та навичок. (групова робота, гра «Хто швидше розв’яже?»)
Зараз ви поділитися на три групи. Перша група – учні які хочуть виконувати завдання на 4-6 балів; друга – на 7-9 балів; третя – на 10-12 балів.
Гра «Хто швидше розв’яже?» ( 13-15 хв)
Завдання для першої групи.
1. Запишіть усі можливі рівняння реакцій між станум (ІІ)гідроксидом та запропонованими речовинами.
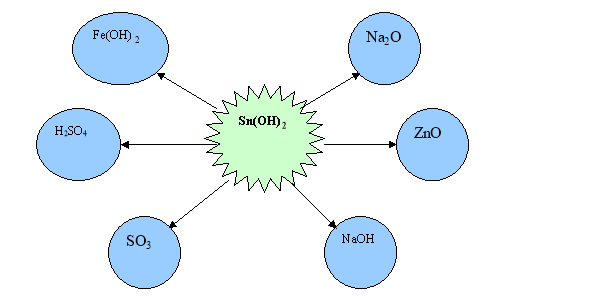
2. Задача. На цинк гідроксид масою 5,6 г подіяли натрій гідроксидом. Яка маса солі випала в осад?
Завдання для другої групи.
Складіть рівняння хімічних реакцій за допомогою яких можна здійснити такі перетворення:
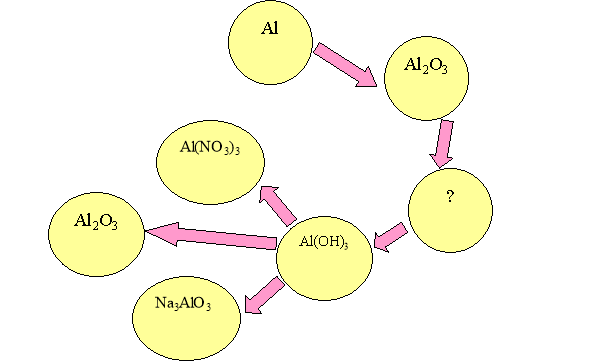
2. Задача. Яка маса калій оксиду про взаємодіє із алюміній гідроксидом масою 5,8 г? Яка кількість речовини і маса солі утвориться у результаті реакції?
Завдання для третьої групи.
1. Складіть рівняння хімічних реакцій за допомогою яких можна здійснити такі перетворення:
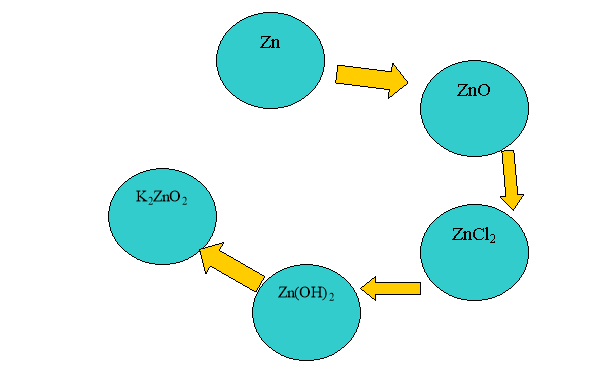
2. Задача. До розчину цинк хлориду додали розчин натрій гідроксиду. маса речовини, що випала в осад, - 4,95 г. Яку додаткову порцію лугу треба взяти, щоб повністю розчинити утворений осад?
(відзначення групи, яка швидше виконала завдання)
VІІ. Рефлексія.
«На уроці я дізнався….»
«На уроці я змінив своє ставлення до….»
«На уроці найбільший мій успіх – це…»
VІІІ. Підведення підсумків, оцінювання.
ІХ. Домашнє завдання. Вивчити параграф 31.
Завдання 246, 251
*Творче завдання.
Десь-не-десь, у тридесятому царстві жив собі король, і була в нього дочка-красуня. Дочці-красуні заманулося пофарбувати замок у білий колір. Вона сказала про це королю. Король покликав до себе майстра і наказав, щоб замок був пофарбований. А де ж я візьму фарбу? Король розлютився і велів майстру думати дві доби. Пішов майстер у свою лабораторію і почав проводити досліди. Він узяв металічну пластинку, розчинив її в шлунковій мікстурі (3%-вий розчин хлоридної кислоти). Почав виділятися газ, і утворилася рідина. Майстер додав їдкого лугу — випав білосніжний осад і швидко зник. Майстер подумав, що він щось не врахував. Тоді він повторив дослід. Добув осад і відокремив його, а потім прожарив. Так він одержав фарбу і пофарбував замок. Король був задоволений.
Завдання: поясніть дії майстра, складіть рівняння реакцій.
(Zn ZnCl2 Zn(OH)2 ZnO)
ДИДАКТИЧНЕ ЗАБЕЗПЕЧЕННЯ УРОКУ
Додаток 1.
Варіант 1
Завдання. У таблиці під кожним номером твердження поставте «+», якщо ви погоджуєтеся, «-» - не погоджуєтеся.
1. Продуктом реакції нейтралізації є сіль і вода.
2. Калій гідроксид і натрій гідроксид можуть розкладатися при нагріванні.
3. Cu(OH)2 + 2 HCl = CuCl2 + H2O. Це приклад реакції нейтралізації.
4. Fe(OH)2 . Дана реакція можлива.
5. У розчині купрум ( ІІ ) гідроксиду фенолфталеїн стає малинового кольору.
6. У рівнянні реакції NaOH + SO2 = ? + H2O пропущеною речовиною є Na2SO4
7. Ni(OH)2 . Загальна сума коефіцієнтів у закінченому рівнянні реакції
дорівнює 4.
8. У водному розчині дана реакція відбувається: Fe(OH)2 + BaCl2 .
|
Номер запитання |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Відповідь |
|
|
|
|
|
|
|
|
Варіант 2
Завдання. У таблиці під кожним номером твердження поставте «+», якщо ви погоджуєтеся, «-» - не погоджуєтеся.
1. Реакція нейтралізації – це реакція між основою і кислотним оксидом.
2. Основи розкладаються під час нагрівання на відповідний оксид та воду.
3. Са(OH)2 + SO3 = CaSO4 + H2O. Це приклад реакції нейтралізації.
4. NaOH . Дана реакція не можлива.
5. У розчині ферум ( ІІ ) гідроксиду фенолфталеїн не змінює своє забарвлення.
6. У рівнянні реакції ? + HCl = FeCl2 + H2O пропущеною речовиною є Fe.
7. Pb(OH)2 . Загальна сума коефіцієнтів у закінченому рівнянні реакції
дорівнює 3.
8. У водному розчині дана реакція відбувається: КОН + FeCl2 .
|
Номер запитання |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Відповідь |
|
|
|
|
|
|
|
|
Додаток 2.
Складіть формули амфотерних сполук.
|
Амфотерні елементи |
|
|
|
|
|
|
Амфотерний оксид цього елемента |
ZnO |
|
|
|
|
|
Амфотерний гідроксид цього елемента |
Zn(OH)2 H2ZnO2 |
|
|
|
|
Додаток 3.
Завдання для 1 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості цинк гідроксиду як основи.
Завдання для 2 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості цинк гідроксиду як кислоти.
Завдання для 3 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості алюміній гідроксиду як основи.
Завдання для 4 групи.
Напишіть рівняння хімічних реакцій що характеризують хімічні властивості алюміній гідроксиду як кислоти.
Додаток 5.
Гра «Хто швидше розв’яже»
Завдання для першої групи?
1. Запишіть усі можливі рівняння реакцій між станум (ІІ)гідроксидом та запропонованими речовинами.
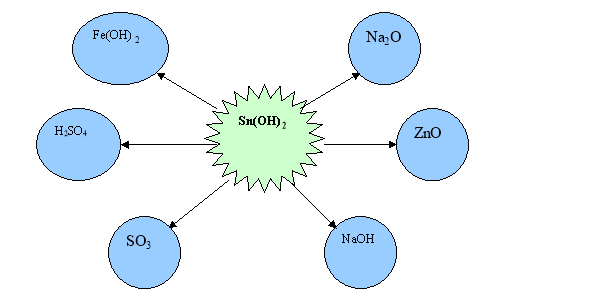
2. Задача. На цинк гідроксид масою 5,6 г подіяли натрій гідроксидом. Яка маса солі випала в осад?
Завдання для другої групи.
Складіть рівняння хімічних реакцій за допомогою яких можна здійснити такі перетворення:
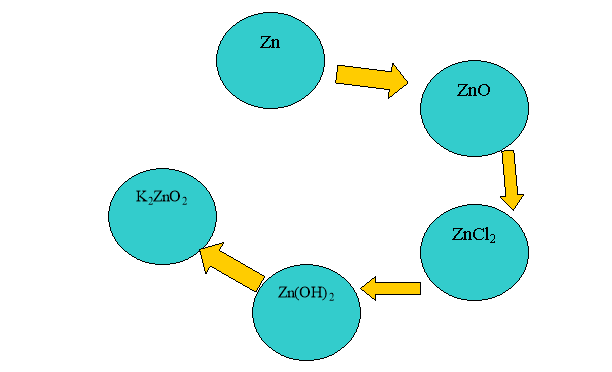
2. Задача. Яка маса калій оксиду про взаємодіє із алюміній гідроксидом масою 5,8 г? Яка кількість речовини і маса солі утвориться у результаті реакції?
Завдання для третьої групи.
1. Складіть рівняння хімічних реакцій за допомогою яких можна здійснити такі перетворення:
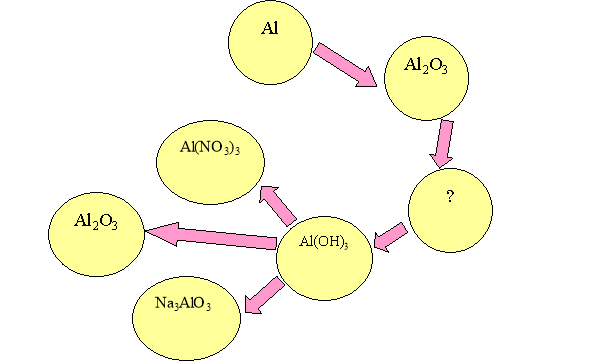
2. Задача. До розчину цинк хлориду додали розчин натрій гідроксиду. маса речовини, що випала в осад, - 4,95 г. Яку додаткову порцію лугу треба взяти, щоб повністю розчинити утворений осад?
Додаток 6.
*Творче завдання.
Десь-не-десь, у тридесятому царстві жив собі король, і була в нього дочка-красуня. Дочці-красуні заманулося пофарбувати замок у білий колір. Вона сказала про це королю. Король покликав до себе майстра і наказав, щоб замок був пофарбований. А де ж я візьму фарбу? Король розлютився і велів майстру думати дві доби. Пішов майстер у свою лабораторію і почав проводити досліди. Він узяв металічну пластинку, розчинив її в шлунковій мікстурі (3%-вий розчин хлоридної кислоти). Почав виділятися газ, і утворилася рідина. Майстер додав їдкого лугу — випав білосніжний осад і швидко зник. Майстер подумав, що він щось не врахував. Тоді він повторив дослід. Добув осад і відокремив його, а потім прожарив. Так він одержав фарбу і пофарбував замок. Король був задоволений.
Завдання: поясніть дії майстра, складіть рівняння реакцій.
-
Гарна розробка. Хочу скористатися .


про публікацію авторської розробки
Додати розробку
