Презентація: «Кількість речовини. Розрахунки за хімічними формулами».
Про матеріал
Презентація на тему:
«Кількість речовини. Розрахунки за хімічними формулами».
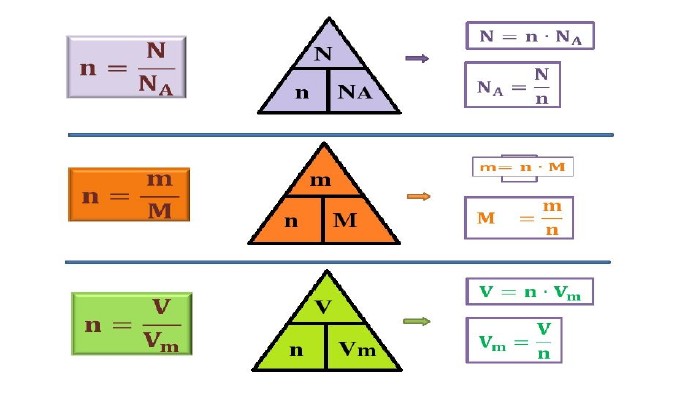
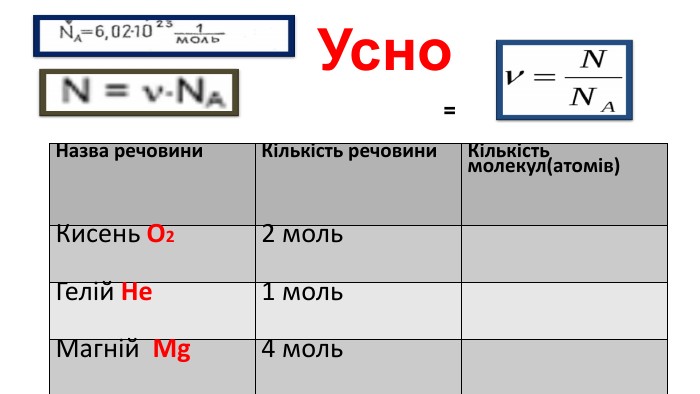
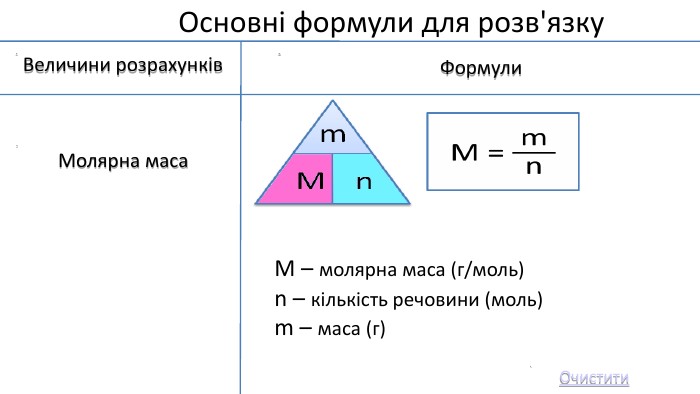
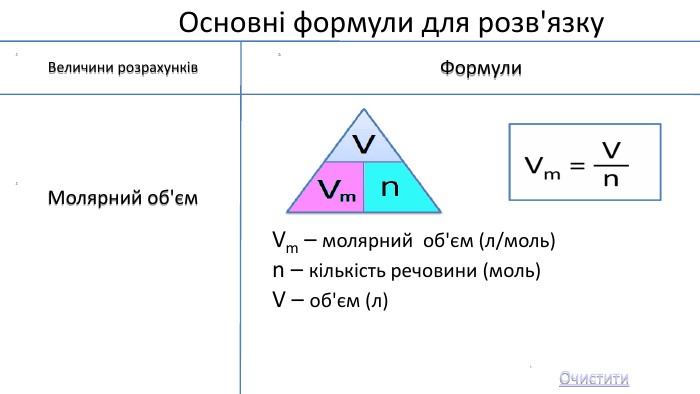
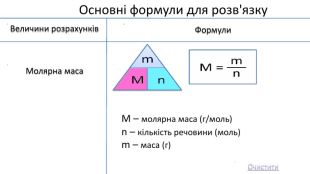
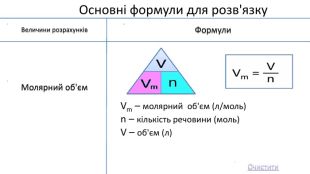
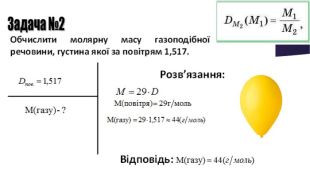
Мета: Узагальнити та систематизувати знання про кількість речовини, молярну масу, молярний об’єм, відносну густину газів.
Закріпити вміння та навички обчислень за хімічними формулами; розв’язування задач.
Виховувати відчуття взаємоповаги і єдності, творчій підхід до навчання, культуру колективної праці.
Тип уроку: узагальнення і систематизація знань, умінь та навичок. Урок-подорож. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку