Хімічні властивості кислот.
Систематизувати і поглибити знання учнів про кислоти як окремий клас сполук. Сформувати знання про хімічні властивості кислот. Дати поняття про індикатори і витискувальний ряд металів. З'ясувати суть реакції обміну.
Тема: Хімічні властивості кислот.
Мета:
- Формування предметних компетентностей: систематизувати і поглибити знання учнів про кислоти як окремий клас сполук. Сформувати знання про хімічні властивості кислот. Дати поняття про індикатори і витискувальний ряд металів. З'ясувати суть реакції обміну.
- Діяльнісна: Розвивати навички написання рівнянь хімічних реакцій. Формувати вміння прогнозувати можливості перебігу хімічних реакцій, розвивати навички складання хімічних формул та хімічних рівнянь, вчити використовувати методи наукового пізнання та науково-пошукову діяльність. Закріпити вміння спостерігати і фіксувати результати дослідів.
- Ціннісна: Виховувати охайність, любов до предмета. Розвивати активну позицію в житті і навчанні, доброзичливість у спілкуванні, відповідальність за свої дії у навколишньому середовищі.
Тип уроку: урок застосування знань та формування вмінь.
Форми роботи: бесіда, робота біля дошки, демонстрація, самостійна робота.
Обладнання та реактиви: набір реактивів, ряд активності металів, картки з завданнями, мультимедійна презентація.
Епіграф: «Якщо вчений не може пояснити прибиральниці, яка забирається у нього в лабораторії, сенс своєї роботи, то він сам не розуміє, що він робить».
Ернест Резерфорд
Хід уроку
- Організація класу.
 Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій.
Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій.
II. Перевірка домашнього завдання. Актуалізація опорних знань.
Фронтальна бесіда:
1. Які речовини називають складними?
2. Які складні речовини ви знаєте?
3. Які речовини називають кислотами?
4. Атом якого елемента входить до всіх кислот?
5. Які класифікації кислот ви знаєте? На яких ознаках вони ґрунтуються?
6. «Хімічний годинник» скласти формули кислот, дати їм назви, вказати основність, наявність Оксигену.
ІІІ. Мотивація навчальної діяльності

На цьому уроці ми продовжимо вивчення основних класів неорганічних речовин і знову завітаємо до країни Неорганічних речовин.
З якими жителями цієї країни ми вже познайомились?
Сьогодні ми познайомимося з іншими жителями цієї країни, які проживають у місті Кислоти. Ми з вами зробимо екскурсію по місту, відвідаємо найвидатніші місця цього міста. Метою нашої поїздки буде дізнатися про склад, назви і класифікацію кислот, навчитися писати їх формули. Я буду вашим екскурсоводом. Але екскурсія платна , вартість її оцінюється вашими знаннями.
Повідомлення теми, цілей уроку.
IV. Вивчення нового матеріалу.
На минулому уроці ми почали вивчати кислоти, знаємо вже їх склад, назви, класифікацію, фізичні властивості. Сьогодні на уроці ми за допомогою дослідів разом визначимо, які хімічні властивості характерні для кислот. Вивчення хімічних властивостей кислот ми проведемо за планом:
1. Дія кислот на індикатори.
2. Взаємодія кислот з металами.
3. Взаємодія кислот з основними оксидами. Після вивчення цієї теми ви будете:
знати:
1. що таке індикатор;
2. хімічні властивості кислот;
3. які реакції називають реакціями обміну та заміщення;
уміти:
1. складати рівняння реакцій, що підтверджують хімічні властивості кислот;
2. аналізувати, порівнювати й використовувати знання про кислоти на практиці.
1. Дія кислот на індикатори.
У природі снують такі речовини, що поводяться, як хамелеони: змінюють своє забарвлення залежно від середовища, в яке вони потрапляють. У дивній країні Хімії такі "хамелеони" називають індикаторами. Перед вами такі індикатори: лакмус, метилоранж, фенолфталеїн.
Не забувайте, що під час роботи з кислотами слід дотримуватися запобіжних заходів. Яких? Що робити, якщо небезпечна кислота випадково потрапила на шкіру або в очі? У три пробірки з розчином H2SO4 (HCl) додамо кілька крапель індикаторів: у І - лакмусу, II - метилового оранжевого, у III -фенолфталеїну.
На підставі спостережень заповнюємо таблицю.
|
Середовище |
Метиловий оранжевий |
Лакмус |
Фенолфталеїн |
|
Нейтральне |
оранжевий |
фіолетовий |
безбарвний |
|
HCl |
червоний |
рожевий |
безбарвний |
Висновок. У розчинах кислот метилоранж набуває червоного забарвлення, лакмус - рожевого.
За допомогою яких індикаторів можна виявити кислоти? (Розчини кислот можна визначити з допомогою індикатора метилоранжу або лакмусу.)
2. Демонстрація 1.
Розглянемо, як взаємодіють кислоти з металами.
Для експерименту в три пробірки наливаємо хлоридну кислоту; у першу додаємо шматочки мідного дроту, у другу - гранули цинку; у третю - магнієву стружку.
- Чому метали не однаково реагують з кислотою?
Це пов'язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших. Цей ряд так і називається - ряд активності металів (Розглядаємо таблицю, знаходимо ряд активності металів у підручнику). Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот, і ті, що не взаємодіють із розчинами кислот і водень не витісняють.
Запишемо рівняння реакцій:
Си + НСІ →
Zn + 2НСІ → ZnCl2 + H2;
Mg + 2HCl → MgCl2+H2.
Вкажіть тип реакції. (Реакція заміщення.)
3. Із попередніх уроків ми знаємо, що кислоти можуть реагувати тільки з якими оксидами? (З основними.)
Демонстрація 2.
Насиплемо в пробірку кальцій оксиду, додамо розчин хлоридної кислоти. Що спостерігаємо? (Оксид розчинився) Запишемо рівняння реакції:
СаО + НСІ → CaCl2 + Н20. Укажіть тип реакції.
Хімічні властивості кислот узагальнюю у вигляді таблиці-схеми:
|
Кислоти |
+ індикатор → зміна кольору |
|
+ метал (до водню) → сіль + Н2 + (крім HNO3) |
|
|
+ основний оксид → сіль + Н20 |
V. Практичне застосування набутих знань.
Учні відповідають на тестові запитання за варіантами. На виконання завдань відводиться 10 хв. Після цього учні обмінюються виконаними варіантами і з допомогою листка-відповіді перевіряють виконані завдання, виставляють отримані бали.
Варіант І
1. Позначте формулу нітратної кислоти:
A. HNО2; Б. H2SО4; B. HNО3; Г. НВг.
2. Установіть відповідність між формулою кислоти та її назвою.
A. H2S 1. Сульфатна
Б. Н3Р04 2. Сульфідна
B, H2S04 3. Ортофосфатна
Г. Н2С03 4. Хлоридна
5. Карбонатна
3. Установіть відповідність між назвою кислоти і групою, до якої вона належить.
A. Сульфітна 1. Одноосновна, безоксигенова
Б. Бромідна 2. Одноосновна, оксигеновмісна
B. Сульфідна 3. Двохосновна, оксигеновмісна
Г. Нітратна 4. Двохосновна, безоксигенова
4. Установіть відповідність між вихідними речовинами та продуктами реакцій.
A. Алюміній і сульфатна кислота 1. СаС12+Н2
Б. Натрій і ортофосфатна кислота 2. Na3P04+H2
B. Кальцій і хлоридна кислота 3. A12(S04)3 + H2
5. Складіть рівняння реакції між калієм і ортофосфатною кислотою і розрахуйте загальну суму коефіцієнтів.
Варіант II
1. Позначте формулу ортофосфатної кислоти:
A. Н3РО4 ; Б. НРО3; B. Н3Р; Г. HNО3.
2. Установіть відповідність між формулою кислоти та її назвою.
A. H2Si03 1. Метафосфатна
Б. НС1 2. Сульфідна
B. H2S 3. Хлоридна
Г. НР03 4. Силікатна
5. Сульфітна
3. Установіть відповідність між назвою кислоти і групою, до якої вона належить.
A. Нітратна 1. Двохосновна, оксигеновмісна
Б. Хлоридна 2. Двохосновна, безоксигенова
B. Карбонатна 3. Одноосновна, безоксигенова
Г. Сульфідна 4. Одноосновна, оксигеновмісна
4. Установіть відповідність між вихідними речовинами та продуктами реакцій.
A. Барій і хлоридна кислота 1. АlСl2 + Н2
Б. Магній і метафосфатна кислота 2. Mg(P03)2 + H2
B. Алюміній і хлоридна кислота 3. ВаСl2+Н2
5. Складіть рівняння реакції між алюмінієм і сульфатною кислотою і розрахуйте загальну суму коефіцієнтів.
|
Варіант І |
Варіант II |
||
|
1.(1 бал) В |
1-А |
||
|
2. (2 бали) |
|||
|
А |
3 |
А |
4 |
|
Б |
2 |
Б |
3 |
|
В |
1 |
В |
2 |
|
Г |
5 |
Г |
1 |
|
3.(2 бали) |
|||
|
А |
2 |
А |
4 |
|
Б |
1 |
Б |
3 |
|
В |
4 |
В |
1 |
|
г |
3 |
Г |
2 |
|
4. (3 бали) |
|||
|
А |
3 |
А |
3 |
|
Б |
2 |
Б |
2 |
|
В |
1 |
В |
4 |
|
5. (3 бали) 13 |
5.9 |
||
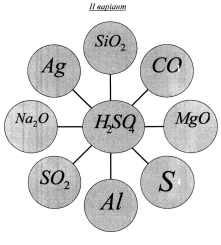
Виконати вправу. З'єднати рисками формулу кислоти та формули тих речовин, з якими вона може вступати в хімічну реакцію. Написати рівняння реакцій, вказати типи реакцій.

VІ. Рефлексія. Підбиття підсумків уроку.
Відкритий мікрофон
На уроці мені сподобалось …
На уроці мені не сподобалось …
Найсильніше мене вразило …
Найбільше мене здивувало …
Я навчився …
Тепер я вмію …
VІІ. Домашнє завдання
Опрацювати § , № , , .


про публікацію авторської розробки
Додати розробку
