Хімічні властивості кислот: взаємодія з основами, солями. Реакція обміну.
Мета: поглиблювати знання про склад та хімічні властивості кислот, ознайомити учнів з реакцією обміну;
розвивати уміння визначати валентність кислотних залишків, поводитись з реактивами та хімічним посудом, навички записувати рівняння реакцій; розвивати уміння аналізувати навчальну інформацію та робити висновки
виховувати вміння використовувати знання в життєвих ситуаціях.
Компетентності, які формуються в учнів: комунікативна, уміння вчитися, спілкуватися державною мовою, соціальна, загальнокультурна, здоров'язбережувальна, науково-природнича.
Урок 54
Тема : Хімічні властивості кислот: взаємодія з основними оксидами, основами, солями. Реакції обміну.
Мета: поглиблювати знання про склад та хімічні властивості кислот, ознайомити учнів з реакцією обміну;
розвивати уміння визначати валентність кислотних залишків, поводитись з реактивами та хімічним посудом, навички записувати рівняння реакцій; розвивати уміння аналізувати навчальну інформацію та робити висновки
виховувати вміння використовувати знання в життєвих ситуаціях.
Обладнання та реактиви: комп’ютер, програмні засоби навчання; ряд активності металів,штатив з пробірками, розчин кислоти – хлоридної, розчин основи (кальцій гідроксид), фенолфталеїн.
Тип уроку: засвоєння нових знань
Місце уроку в навчальній темі: поточний
Міжпредметні зв'язки: хімія, фізика, математика.
Компетентності, які формуються в учнів: комунікативна, уміння вчитися, спілкуватися державною мовою, соціальна, загальнокультурна, здоров’язбережувальна, науково-природнича.
Девіз уроку: « Знання необхідні для того, щоб застосовувати їх з найбільшою користю для себе і навколишніх»
Хід уроку
І.Організаційний етап
ІІ. Актуалізація та мотивація навчальної діяльності
- Інтелектуальна розминка
Сьогодні ми продовжуємо мандрувати по загадковій хімічній країні неорганічних речовин. Я прочитаю хімічну казку , після чого вам потрібно буде відповісти на запитання.
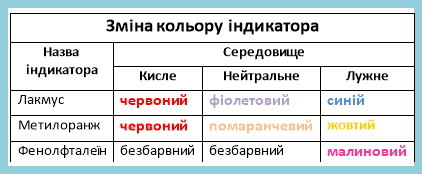
« Жив-був парубок Сульфур (ІV)оксид. Набридло йому жити самому і вирішив він одружитися. Заслав сватів до гарної дівчини їхнього містечка, яку всі поважали і шанували за чуйне серце та добрі справи. Між собою жителі її називали найкоштовнішим мінералом. Дівчині хлопець подобався і вона пов’язала старостів рушниками. Незабаром і весілля справили. Народилася у них дитинка, гарна та прозора, як мама. Коли капнули на неї лакмус, то він змінив своє забарвлення і всі зрозуміли, що народилася дівчинка.
Росла вона, на радість своїм батькам, товариською, мала багато друзів, через спільне захоплення – виготовляти нові речовини. Коли вона вступала в реакцію з хлопцями з їхньої вулиці, то завжди утворювалась сіль і газ, який вони ніколи не могли впіймати.
Часто дівчинка намагалася потоваришувати з хлопцями з іншої вулиці, які були гарними на вроду, добре вдягненими, але ті навіть не хотіли виходити зі своїх будиночків.
Коли до дівчинки приходили в гості Основи з братами, Основними оксидами, тоді кімната наповнювалася різноманітними солями, а підлога чомусь завжди ставала мокрою.
Пройшов час , і маленька дівчинка виросла.
Вона хотіла стати поетесою, але, як тільки торкалася паперу, одразу з’являлася дірка.
Тоді вона спробувала опанувати професію кравчині. Але , кімната ,де вона працювала, наповнювалася запахом горілого, а на тканині з’являлися маленькі дірочки. Клієнти були дуже невдоволеними.
Тоді вона пішла на хімічне підприємство, яке було у їхньому містечку. Там, завдяки своїй працьовитості та завзяттю, вона здобула великий авторитет і шану. До неї надходило багато пропозицій з інших підприємств. Усі говорили , що вона - «хліб» хімічної промисловості. Так дівчинка знайшла свою справу в житті. Нині живе щасливо».
Запитання:
- Як звали наречену;
- Як змінився колір лакмусу.
- Як звали дівчинку.
- Як звали хлопців з вулиці , де жила дівчинка
- Який газ не могли спіймати? Чому?
- Як звати хлопців із сусідньої вулиці.
- Чому підлога в кімнаті ставала вологою
- Чому дівчинка не могла стати поетесою і кравчинею
2.1 Робота з комп’ютером: Троє учнів розв’язують тестові завдання за програмою Test-w2.exe Додаток 1.
Решта учнів класу виконують вправу « Незакінчене речення»
2.2 Вправа «Незакінчене речення»(вчитель зачитує речення, речення висвітлюються на компютері)
- Кислотами називають складні речовини, які містять…
- Кислоти класифікують за вмістом атомів Оксигену на …
- Агрегатний стан кислот у більшості випадків…
- Валентність кислотного залишку ортофосфатної кислоти …
- Формула сульфатної кислоти…
- За основністю кислоти поділяються на …
- У природі кислоти зустрічаються …
- Кислотний залишок силікатної кислоти…
- Кислота, що міститься в шлунковому соці…
- Готуючи розчин кислоти, треба лити…
- Кислоти мають властивості…
- Кислоти взаємодіють з металами…
За виконання завдань учні виставляють собі оцінки у реєстраційну картку(1 - відповіді на запитання до казки – 2б, 2 - завдання виставить програма, 3 -максимальна кількість балів – 6) Додаток 2.
Ми повторили основні характеристики кислот, які вивчили на попередніх уроках. Тож сьогодні ми продовжимо вивчати хімічні властивості неорганічних кислот. Темою уроку буде « Хімічні властивості кислот : взаємодія з основними оксидами, основами, солями. Реакції обміну» .(слайд 13)
Цілепокладання: після цього уроку ви навчитесь розпізнавати реакцію обміну;
опануєте знаннями про основні хімічні властивості неорганічних кислот;
набудете вміння складати і записувати рівняння хімічних реакцій, аналізувати навчальну інформацію та робити висновок;
отримаєте навички безпечного користування лабораторним посудом та реактивами;
отримаєте навички використання джерел інформації, навички раціонально використовувати комп’ютер для пошуку інформації. (слайд 15)
Тож будьте уважними на уроці. Бажаю вам успіху.
ІІІ. Вивчення нового матеріалу
Робота з використанням опорної схеми . (Додаток 3)
1.Взаємодія з основними оксидами, (м/м демонстрація досліду: взаємодія купрум оксиду з хлоридною кислотою)(слайд16)
Один учень записує на дошці рівняння реакції СuО+2НСІ= CuСl2 +H2O
Для порівняння - рівняння висвітлюється на комп’ютері (слайд 17)
2.Взаємодія з основами (демонстрація досліду(1 учень): взаємодія основи (з добавлянням фенолфталеїну) з кислотою). Реакція нейтралізації – інший учень біля дошки записує рівняння реакції:
Ca(OH)2+ H2SO4 =CaSO4+ 2H2O
Для порівняння висвітлюється на комп’ютері (слайд 18)
3.Взаємодія з солями.
Умови протікання реакції:( висвітлюється на комп’ютері)
-продукт реакції – сіль , кислота - випадають в осад:
ВаCl2 + H2SO4 = ВаSO4 ↓ + 2HCl
Рівняння висвітлюється на комп’ютері (слайд 19)
-кислота – продукт є леткою чи походить від газуватої сполуки або розкладається з утворенням газу
Рівняння висвітлюється на комп’ютері (слайд 20)
![]() СО2
СО2
СaCO3 + 2HNO3= Сa(NO3)2 + Н2СО3
![]() Н2О
Н2О
Показ дослідів –м/м (слайд 21)
- кислота , що вступає в реакцію, є сильною, а кислота, яка утворюється ,
- слабкою.
Рівняння висвітлюється на комп’ютері (слайд 22)
K2S + 2HCl = 2KCl+H2S↑
- Реакції обміну.
Зверніть увагу на переміщення атомів (опорна схема). В реакції заміщення атоми простої речовини заміщують інші атоми в складній речовині , а вреакціях обміну відбувається обмін атомами між двома складними речовинами.
ІV. Узагальнення та систематизація знань
- Виконати вправу 239 с.112 (підручник Хімія 8кл. П.П. Попель) – взаємокорекція.
- Вправа 5,7 с.78 (навчальний посібник Хімія 8кл. ПОІППО)
V. Рефлексія ( карточки)
Учні отримують карточки з питаннями, на яких записують відповідь, що дає можливість учителю спланувати свою роботу на наступний урок.
- Що нового дізналися на уроці?
- Чи можете використовувати сьогоднішні знання у побуті? Що саме?
- Що викликало певні труднощі?
VІ. Домашнє завдання( слайд 23)
- Опрацювати §30 стор. 164-167 (підручник Хімія 8кл. П.П. Попель)
- Для учнів І-ІІ рівнів навченості - впр. 237 с.168(підручник Хімія 8кл. П.П. Попель)
- Для учнів ІІІ і ІV рівня навченості виконати вправу 244, с.81(підручник Хімія 8кл. П.П. Попель)
- Для тих хто цікавиться хімією підготувати повідомлення про використання кислот. Слайд 24.
Список використаної літератури
- Попель П. П. Хімія : підручник / П. П. Попель, Л. С. Крикля. – К. : Академія, 2008. – 77-80 с.
- Взаємодія хлоридної кислоти з оксидом металу. – Режим доступу http://www.youtube.com
- Навчальний посібник Хімія / Буйдіна О. О. [та ін.]. – П. : Головне управління освіти і науки Полтавської обласної Державної адміністрації, 2008. – 78 с.
- Савіна Л. О. Я пізнаю світ. Хімія. / Л. О. Савіна. – К. : Школа, 2002. – 365 с.
- Стеблина А. М. Розвиток творчого мислення на уроках хімії / А. М. Стеблина. – Х. : Основа, 2005. – 95 с.
- Пометун О.В. Сучасний урок / О. В. Пометун. – К. : А.С.К., 2004. – 16 с.
- Навчальна програма для загальноосвітніх навчальних закладів ХІМІЯ 7–9 класи Програма затверджена Наказом Міністерства освіти і науки України від 07.06.2017 № 804
Додаток1
- Кислоти - це речовини, що ...
містять атоми Гідрогену й кислотний залишок
складаються з атомів металічних елементів і кислотних залишків
2.Спільна ознака кислот – це наявність атомів...
металу
неметалу
гідрогену
оксигену
- За вмістом Оксигену кислоти поділяються на
Оксигеновмісні
Безоксигенові
Одноосновні
Двохосновні
4.За основністю кислоти розділяють на
одноосновні, двохосновні, трьохосновні
одноосновні, двохосновні, трьохосновні, чотирьохосновні
одноосновні, двохосновні
двохосновні, трьохосновні
5. Оксигеновмісні кислотим є продуктами приєднання води до
Металу
Неметалу
кислотного оксиду
основного оксиду
6.Основність кислот обумовлюється
числом атомів оксигену
числом атомівгідрогену
числом атомівнеметалу
загальним числом атомів
7. Для виявлення кислот у розчинахвикористовують
Індикатори
Метали
Неметали
Оксиди
8.Якщо метали розташувати за зменшеннямактивності, то такий ряд називають...
Витискувальним
Металевим
Розчинним
Хімічним
9. У витискувальномурядіметалівзліва направо їхактивність
Зменшується
Збільшується
залишаєтьсянезмінною
10. Продуктами реакціїметалів ,що стоять до водню в ряду активностей з кислотами є
Вода
Кисень
Водень
оксид металу
11. Реакціїзаміщення - цереакції, в яких...
атом одного елементапростоїречовинивитискує атом іншогоелементазіскладноїречовини
декількаатомівміняютьсямістами
кислотивзаємодіють з основами
двіречовиниобмінюютьсясвоїмичастинами
12. Середтрьох кислот - карбонатна, сульфатна, силікатна - оберітьсильну кислоту
H2SO4
H2CO3
H2SiO3
Додаток 2
Таблиця самооцінки
|
Прізвище,ім’я учня |
Бали за відповіді на питання до казки |
Бали за роботу біля комп’ютера |
Бали за відповіді на питання вправи « Незакінчене речення» |
Бали за відповіді біля дошки |
|
|
|
|
|
|
|
Всього |
|
|||
 Додаток 3
Додаток 3

![]()





про публікацію авторської розробки
Додати розробку
