Інтегрований урок (хімія, біологія, географія) "Оксиди в природі та житті людини"
Интегрированный урок (химия + биология + география)
"Оксиды в природе и жизни человека"
Цель:
- знакомство с оксидами, их составом и классификацией
- рассмотреть названия оксидов их нахождение в природе
- роль оксидов в природе и жизни человека.
Задачи:
- закрепить на оксидах знания химической номенклатуры бинарных соединений;
- расширить представление о важнейших оксидах, их свойствах, роли в природе и жизни человека.
- способствовать пониманию необходимости бережного отношения к природным богатствам.
Тип урока: урок изучения и первичного закрепления знаний.
Оборудование: физическая карта мира, шкатулки, коллекция «Горные породы и минералы», ноутбук.
Ход урока
I. Организация класса.
Добрый день! Я рада видеть вас на сегодняшнем уроке. Надеюсь, что наша совместная работа будет полезной и интересной. Давайте улыбнемся друг другу, настроимся на поиск и начнем урок.
II. Мотивация учебной деятельности
– Сегодня у нас c вами не совсем обычный урок. Это урок, объединяющий знания по химии, биологии и географии. Такие уроки называются интегрированными, так как позволяют объединить знания всех наук для создания целостного представления об изучаемом объекте.
Необычным урок является еще и потому, что работать с вами будут учителя химии, географии и биологии. (Представление учителей).
На данном уроке мы будем говорить о необыкновенных по значимости и распространению на Земле веществах.
Тема урока: Оксиды в природе и жизни человека.
III. Актуализация опорных знаний.
Речевая разминка
1 этап:
Учитель: А сейчас мы повторим названия химических элементов (показываются карточки с химическими знаками)
Mg, Na, P, S, Ca, Cu, Fe, Cr, Mn, C, Si, N, H, Al, Cl, Zn, O
Индивидуальный опрос каждого учащегося (2-3 ответа для каждого)
- А для чего нам необходимо знать названия химических элементов? (Для того, чтобы уметь называть формулы веществ)
2 этап:
Интерактивная технология «Микрофон»:
-Какая классификация веществ вам известна? (Простые и сложные)
-Какие вещества называют простыми? (Образованы атомами одного химического элемента)
- Какие вещества называют сложными? (состоят из атомов нескольких химических элементов)
- Какая классификация простых веществ вам известна? (металлы и неметаллы)
-Приведите примеры простых веществ. (сера, железо, медь)
- Приведите примеры сложных веществ. (вода)
-Какие соединения называют бинарными? ( Соединения, состоящие из двух элементов.)
IV.Изучение нового материала.
– На доске задания для учащихся.
- Подчеркните формулы бинарных соединений, назовите их: NaCl, Fe, CuSO4, CaO, ZnS, FeO, HNO3, SO2, O2, K2O. (Учащиеся подчеркивают бинарные соединения, а учитель просит проговорить их названия – работа по цепочке.)
- Из подчеркнутых формул выберите формулы оксидов и определите степени окисления элементов. (Учащиеся подчеркивают формулы оксидов, указывая степень окисления их элементов.)
- Укажите основные признаки оксидов.
Основные признаки оксидов:
- _______________________(Сложные вещества)
- _______________________(Состоят из двух элементов)
- _______________________(Один из элементов – кислород)
- _______________________(Кислород имеет степень окисления – 2)
– На основании вышесказанного дайте определение оксидам. (Запись в тетрадь).
Учитель: Систематические названия сложных веществ строятся по формуле справа налево и состоят из двух слов: оксид и название элемента. В номенклатуре оксидов придерживаются следующих правил (на доске)
Основные правила современной международной номенклатуры
Название оксида = Название элемента в именительном падеже + (с.о. римскими цифрами) + «Оксид»
Учитель химии
Упражнение «Не прерви цепочку».
(Для каждого ученика приготовлена карточка с формулой оксида. Ученик поднимает карточку, показывает всем, и дает название оксиду. Работа по цепочке.)
|
CaO |
P2O5 |
SO3 |
||||
|
BaO |
MnO2 |
SiO2 |
||||
|
K2O |
Al2O3 |
FeO |
||||
|
Na2O |
CuO |
Fe2O3 |
||||
|
CO |
Cu2O |
ZnO |
||||
|
CO2 |
N2O |
Li2O |
||||
|
N2O3 |
NO2 |
MgO |
||||
|
N2O5 |
SO2 |
NO |
||||

Существует еще бытовая или тривиальная номенклатура.
Для знакомства с различными видами номенклатур будем работать с таблицей «Оксиды в природе» (ноутбуки )
– Дадим название некоторым оксидам. (тривиальные названия произносит и записывает на экран учитель, учащиеся в свой конспект)
Таблица «Оксиды в природе»
|
Химическая формула |
Тривиальные название |
Возможное научное название |
Нахождение в природе |
Значение в природе и жизни человека |
||
|
H2O CO2 CO Al2O3 Fe2O3 CaO SiO2 |
|
Вода Углекислый газ Угарный газ Глинозем Гематит (крокус) Негашеная известь Кварц, песок, кремнезем |
|
|
||
Учитель: Ребята, на столе у нас стоят шкатулки. Что же в них?
Перед вами шкатулка №1.
Она и дождь, и град, и снег,
Туман и гололед,
Носитель благ, предвестник бед –
И радуга и лед.
Что это за вещество? (Ответ: вода или Гидроген оксид)
Представляем вам презентацию №1 «Гидроген оксид в природе и жизни человека»
1. Вода в природе существует в трех состояниях: жидкость, лед и пар. Она есть в литосфере, атмосфере и биосфере и составляет так называемую водную оболочку Земли – гидросферу. Вода занимает 70 % всей поверхности Земли. Сосредоточена вода в основном Мировом океане.
Учитель просит ребят по ходу беседы заполнять в таблице графу «нахождение в природе» и производить краткую запись основного в тетрадь.
2. Биологическое значение воды для живых организмов.
– Вода входит в состав клеток живых организмов и является участницей всех процессов их жизнедеятельности.
(На экране схема «Содержание воды в организме человека»)
3. Каково же биологическое значение воды для материального мира?
– Когда вещество переходит в раствор его молекулы или ионы получают возможность двигаться более свободно и их реактивная способность возрастает. По этой причине в клетке большая часть химических реакций протекает в водной среде.
(На экране «Универсальный растворитель»)
Вывод: вода превосходный растворитель.
4. -Для многих клеток и организмов, для которых характерно значительное постоянство условий. Вода является…
(На экране «Среда обитания», слайд водоем с живыми организмами)
Вывод: средой обитания.
5.– Присущие воде свойства растворителя означает также, что вода служит средой для перемещения различных веществ. Эту роль она выполняет: в крови, в лимфатической системе, пищеварительной системе животных, проводящей системе растений (сосуды и ситовидные трубочки).
(На экране кровеносная система человека и передвижение веществ по стеблю растения)
Вывод: среда для транспорта различных веществ.
6.– Вода способствует …
(На экране распространение семян, гамет, личинок)
Вывод: миграции и распространению семян, плодов некоторых наземных растений – кокосовая пальма и личиночных стадий животных.
7.– Все живое на Земле зависит от растений – либо непосредственно, либо, как в случае с животными, косвенно. Растения делают энергию и углерод доступными для живых организмов. Это происходит благодаря процессу фотосинтеза.
Учитель предлагает вспомнить определение фотосинтеза.
Для создания крахмала растениям нужна вода.
(Слайд «Образование органических веществ»)
Вывод: растения являются автотрофами. Органическое вещество – крахмал образуется в процессе фотосинтеза.

Биологическое значение воды для материального мира (итоговая диаграмма)
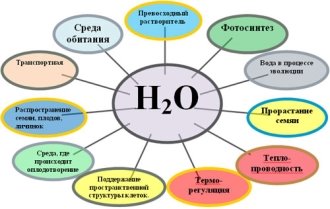
– Без воды жизнь невозможна. Стихотворение «Ода воде»
Учитель географии
Сосредоточена вода в основном в Мировом океане. Значит большая часть воды соленая. Используем же мы лишь пресную воду, а ее очень мало. Непосредственно доступные пресные воды составляют лишь 0,007 % всей воды Земли или 0,26 % общего запаса пресной воды. Мировые запасы пресной воды не увеличиваются, а ее потребление постоянно растет.
Возникают экологические проблемы водных ресурсов.
Работа в группах.
Задание для 1 группы: назвать основные источники загрязнения воды.
1. Загрязнение бытовыми сточными водами.
2. загрязнение промышленными стоками
3. бытовой мусор
4. загрязнение от водного транспорта
5. загрязнение при аварии нефтеналивных танкеров
6. браконьерство
7. неразумная добыча полезных ископаемых (гравий, песок - обмеление)
8. отвод воды для нужд городов, сельского хозяйства (каналы)
Задание для 2 группы: разработать рекомендации по охране и экономии воды.
1. на предприятиях, заводах, фабриках ставить водоочистные сооружения
2.закрывать кран, когда вода не нужна
3.поддерживать в надлежащем состоянии и проводить своевременный ремонт водопровода
4.ставить фильтры на кран
5.закрывать воду пока чистите зубы
6.чтобы вымыть грязную обувь, воду нужно налить в какую-нибудь ёмкость
7.для мытья автомобиля использовать ведро с водою, а не шланг.
Учитель химии:
– А что в шкатулке №2?
Это газ, необходимый растениям для фотосинтеза. Это газ, выделяемый нами при выдохе.
Ответ готов? (Углекислый газ или карбон (IV) оксид) Демонстрируется бутылочка с минеральной водой.
Представляем вам презентацию №2 «Карбон оксид в природе и жизни человека»
Углекислый газ, поглощаемый растениями в процессе фотосинтеза, с точки зрения химии является оксидом.
В незначительных количествах, около 0,003% СО2 содержится в воздухе. В природе, он образуется при гниении растений и животных остатков, дыхании всех живых организмов (таблица «состав воздуха»).
Работа в группах:
Положительная и отрицательная роль СО2 в природе и жизни человека.
«Отрицательная роль СО2 » - 2 минуты
Углекислый газ атмосферы свободно пропускает на Землю излучение Солнца, но сильно задерживает излучение Земли. Это создаёт так называемый парниковый эффект – слой углекислого газа играет такую же роль, как стекло в теплице. Поэтому наличие углекислого газа в атмосфере в большей степени определяет температуру на Земле. Уменьшение первоначального содержания углекислого газа в атмосфере, происходившее на протяжении многих миллионов лет, привело к постепенному похолоданию климата на Земле. Парниковым эффектом объясняют высокую температуру (450С) на поверхности планеты Венера, которая окружена толстым слоем атмосферы, состоящей, в основном, из углекислого газа.
Ещё в 1896 году учёный Сванте Аррениус рассчитал, что увеличение содержания углекислого в атмосфере в 2 – 3 раза повысит температуру воздуха вблизи поверхности Земли на 8 – 9С. Если учесть, что обычная средняя температура в Антарктиде летним днём -8С, то при потеплении она станет +1С. Начнётся таяние ледников и вечной мерзлоты. На Земле ледники составляют 27 млн. км куб. И если они растают, то уровень Мирового океана поднимется на 50 м и почти вся поверхность суши окажется под водой. Сейчас ежегодный подъём уровня Мирового океана составляет 0,8 мм
7. « Положительная роль СО2» - 2 минуты
Огромную роль в природе играет процесс фотосинтеза – процесс образования органических веществ и кислорода из углекислого газа и воды под действием солнечного света в хлоропластах зелёных растений. Этот процесс идёт по уравнению:
6СО2 + 6Н 2О → С6 Н 12О 6 + 6О2
Берем шкатулку №3.
В его прозрачной глубине –
незыблемая вечность,
в нем есть и радость, и покой,
и мира бесконечность.
Что это? (Горный хрусталь или оксид кремния IV)
Представляем вам презентацию №3 «Силиций оксид в природе и жизни человека»
Учитель географии
– Оксиды очень распространенный в природе класс неорганических соединений.
Перед вами коллекция горных пород и минералов. Найдите и рассмотрите в ней оксиды, назовите их. (Учащиеся приводят примеры оксидов в коллекции)

Более 50% земной коры состоит из кремнезема или кварцевого песка.
Очень чистый кремнезем известен также в виде минералов горного хрусталя, который встречается в Бразилии, на Мадагаскаре, Цейлоне, а в нашей стране – на Урале и в Восточной Сибири. (Учитель показывает регионы на карте мира)
(На экране слайды с аметистами и агатами)
А окрашенный различными примесями он образует драгоценные и полудрагоценные камни яшма, аметист, агат.
Аметистами всегда славились Бразилия, Уругвай, Шри-Ланка, Мадагаскар. У нас в стране аметисты, например, есть на Кольском полуострове, а агаты на Урале. (Карта.)
V. Обобщение и систематизация знаний
1. Дидактическая игра «Химическая эстафета»
1. «Третий лишний»
Учитель записывает на доске группы формул. Учащиеся должны определить и вычеркнуть «лишнюю» формулу, назвать оксиды.
1-я группа: K2O, HCl, MgO.
2-я группа: Аl2O3, SO3, СaH2.
3-я группа: HNO3, SO2, Fe2O3.
4-я группа: FeO, N2O5, CaCO3.
2. «Пирамида»
Ученики должны составить формулы всех возможных оксидов, комбинируя приведённые составные по горизонтали (слева направо) и по вертикали (сверху вниз) при условии, что элементы должны располагаться «по соседству».
Подсказка. Общее количество всех оксидов, которые можна составить таким образом, равняется относительной атомной массой Карбона.
|
|
|
|
|
Ca |
|
|
|
|
|
|
|
|
Cu |
O |
S |
|
|
|
|
|
|
Na2 |
O |
Zn |
O2 |
Al2 |
|
|
|
|
P |
O2 |
Mg |
O |
Fe2 |
O3 |
Li |
|
|
K2 |
O |
Ba |
O |
Ag2 |
O |
C |
O |
O2 |
|
|
|
|
|
|
|
|
|
|
Ответ: K2O, BaO, Ag2O, CO, MgO, Fe2O3, Na2O, CuO, ZnO, CuO, CaO, SO2.
3.«Найди соответствие».
Найдите соответствие между формулой оксида и его названием. В своих тетрадях запишите к цифре соответствующую букву.
- SО3 а. нитроген (IV) оксид
- ZnО b. натрий оксид
- NО2 с. сульфур (VI) оксид
- SО2 d. цинк оксид
- Nа2О е. сульфур (IV) оксид
4. «Восстановите уравнения реакций».
1. .. + О2 = 2ВаО
2. Si + .. = SiО2
3. К + О2 = ..
5. Вычислить количество вещества, которое содержится в оксиде кальция массой 16,8 г. (Ответ: 0,3 моль.)
VI. Домашнее задание.
- Заполнить таблицу, используя учебник и дополнительные источники информации.
- &7 учебник, задание 1-4 стр.39
VII. Подведение итогов урока.(Рефлексия)
Інтерактивная технология «Одним словом».
Учитель предлагает ученикам охарактеризовать одним словом то, что им наиболее понравилось на уроке (при изложении материала, методах работы, собственной деятельности, общему настроению и т.д.).
Урок окончен. До свидания.

про публікацію авторської розробки
Додати розробку
