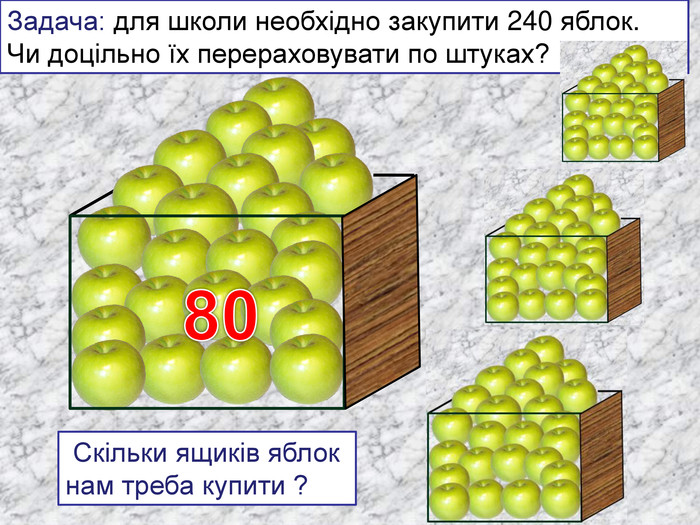
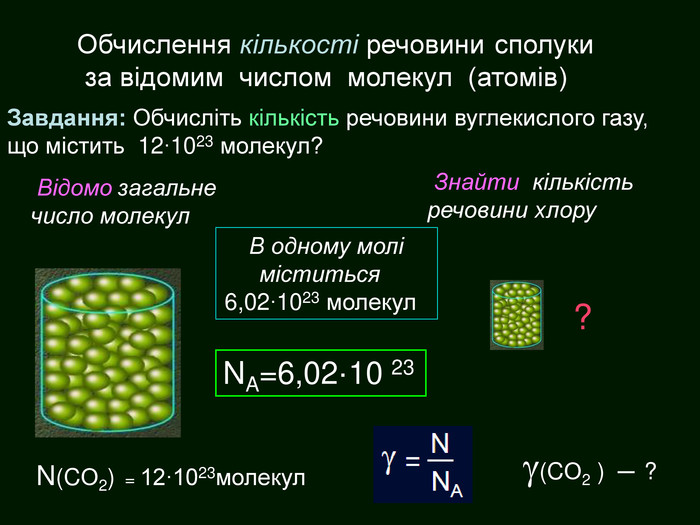
кількість речовини -презентація
Про матеріал
Розробка уроку презентації з оригінальним поясненням :кількість речовини, моль , Стала АВогадро , розв'язування задач Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку