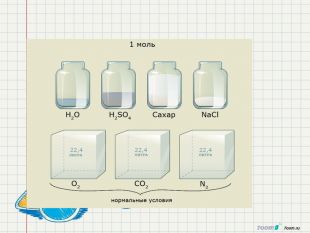
Кількість речовини. Молярна маса. Молярний об'єм.
Про матеріал
Мета :
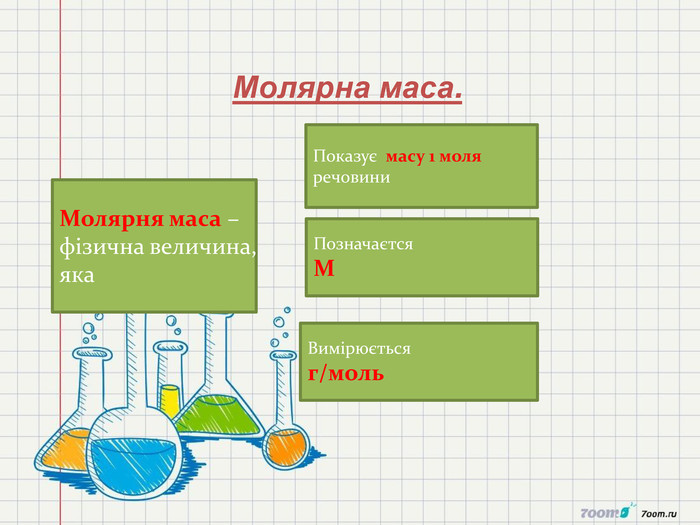
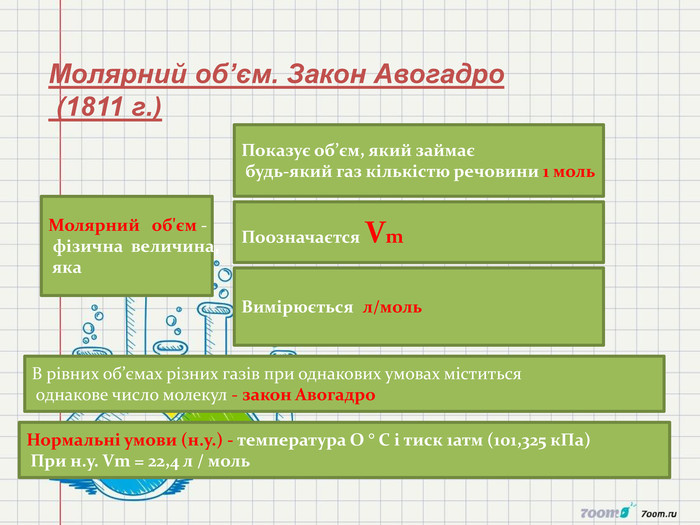
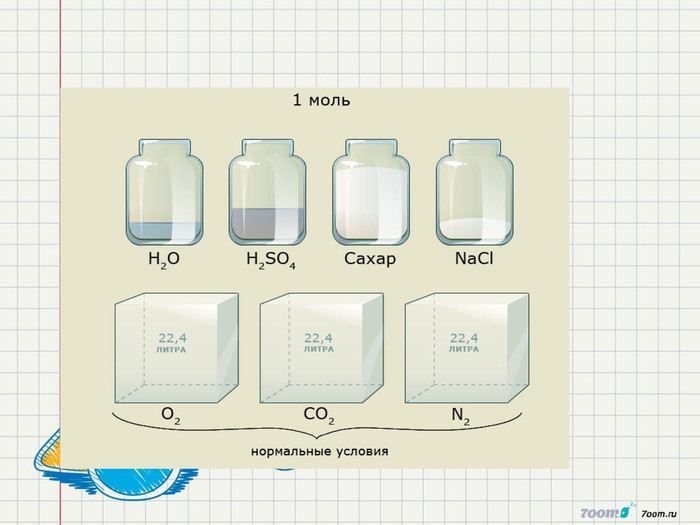
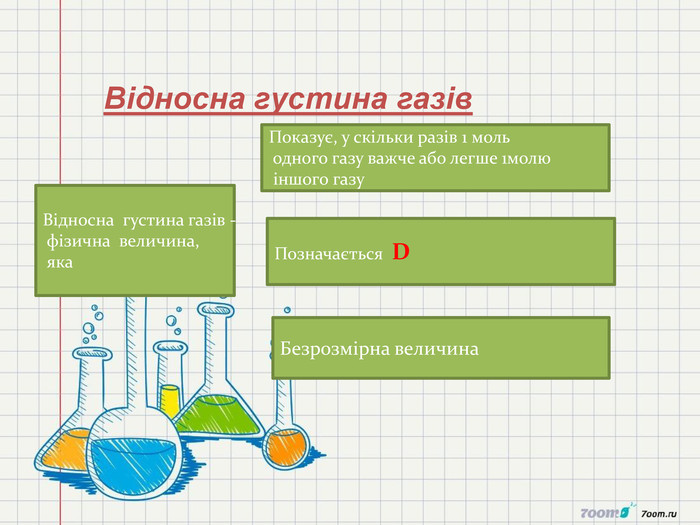
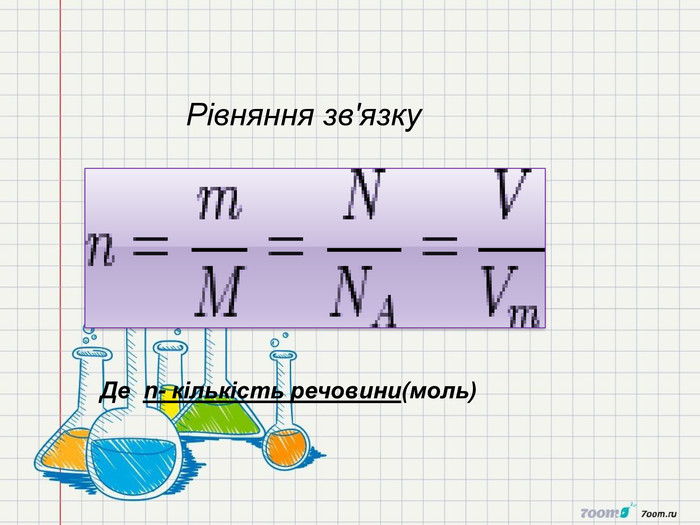
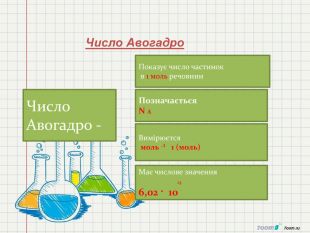
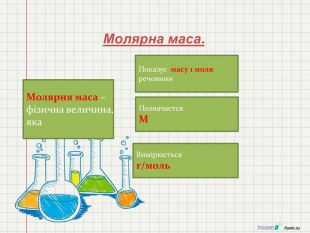
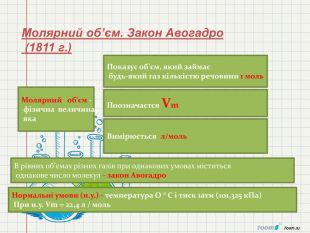
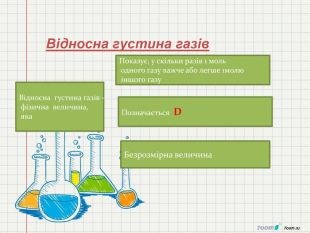
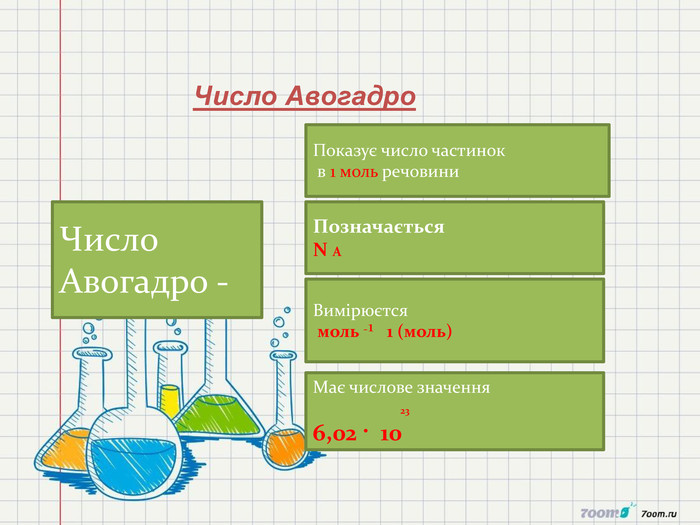
1. Сформувати в ході уроку поняття «кількість речовини», «число Авогадро»,Молярна маса,молярний об'єм,відносна густина газів.
2. Сформувати вміння розв'язувати задачі з використанням понять «кількість речовини», «число Авогадро».
3. Продовжити розвивати експериментальні навички роботи з речовинами, вміння спостерігати, аналізувати, робити висновки, виділяти потрібну інформацію.
4. Продовжити формувати комунікативні навички, вміння працювати в групі.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую Вам! Допомогли:)
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку







![Молярна маса-це маса одного моль речовини. М = [г / моль] (Молярна маса чисельно дорівнює молекулярній масі) звідки Молярна маса-це маса одного моль речовини. М = [г / моль] (Молярна маса чисельно дорівнює молекулярній масі) звідки](/uploads/files/52220/19163/19430_images/8.jpg)