Кислоти- фізичні та хімічні властивості.
Завдання з теми «Кислоти- фізичні та хімічні властивості, поширеність та використання»
Опрацюйте & 27,28,29 (підручник «Хімія 8 клас» автор Лашевська Г.А.) та виконайте завдання.
https://www.youtube.com/watch?v=JI8s-BszmiM
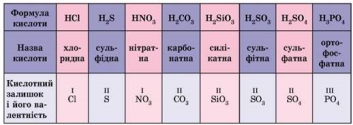
Кислоти — складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок. Кислотний залишок може бути різним:
 Завдання 1.
Завдання 1.
Виберіть хімічні формули кислот з наведеного переліку: H2SiO3, НСl, H2SO4, NaOH, HI, HNO3, NO2, H2SO3, H2S, CO2, NH3. Визначте валентність кислотних залишків.
ХІМІЧНІ ВЛАСТИВОСТІ КИСЛОТ
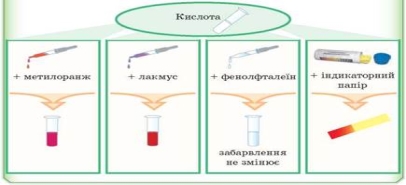
1.Дія водних розчинів кислот на індикатори
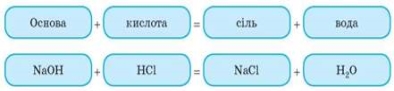
2. Взаємодія кислот з основами
Завдання 2. Спробуйте самі закінчити рівняння реакцій.
H2SO4 + Ca(OH)2 →
H3PO4 + Fe(OH)3 →
H3PO4 + Ca(OH)2 →
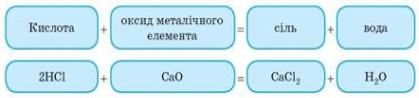
3. Взаємодія кислот з оксидами металічних елементів
Завдання 3. Спробуйте самі закінчити рівняння реакцій. .
H2SO4 + MgO → ...
HNO3 + CuO → ...
H3PO4 + Fe2O3 → ...
4. Взаємодія кислот із металами
Ряд активності металів
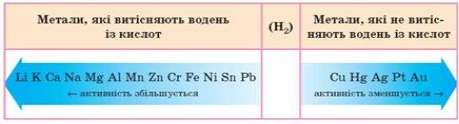 Щоби визначити активність металу, треба звернутися до таблиці «Ряд активності металів»
Щоби визначити активність металу, треба звернутися до таблиці «Ряд активності металів»
• Чим лівіше розташований метал у ряді активності металів, тим він активніший.
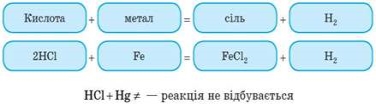 Завдання 4. Спробуйте самі закінчити рівняння реакцій.
Завдання 4. Спробуйте самі закінчити рівняння реакцій.
H3PO4 + Mg → ...
HBr + Ni → ...
H2SO4 + Zn → ...
 Реакції, між простими і складними речовинами, в результаті яких атоми простої речовини заміщують атоми одного з елементів складної речовини, називають реакціями заміщення. У результаті цих реакцій утворюються проста і складна речовини.
Реакції, між простими і складними речовинами, в результаті яких атоми простої речовини заміщують атоми одного з елементів складної речовини, називають реакціями заміщення. У результаті цих реакцій утворюються проста і складна речовини.
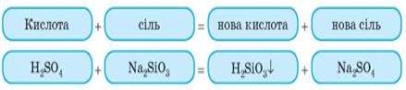
5. Взаємодія кислот із солями
Завдання 5. Спробуйте самі закінчити рівняння реакцій.
H2S + CuCl2 → ...
H2SO4 + Ba(NO3)2 → ...
HNO3 + CaSO3 → ...
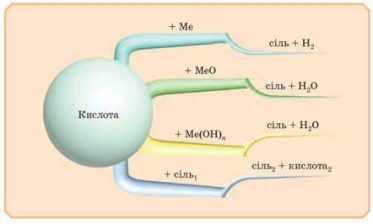 Щоби краще запам'ятати властивості кислот, запишемо схему: —
Щоби краще запам'ятати властивості кислот, запишемо схему: —
Дуже легко запам'ятати: спочатку реагент — просто металічний елемент, потім металічний елемент із О, потім металічний елемент із ОН, а потім металічний елемент із кислотним залишком (сіль).
— Виявляється, оксид металічного елемента + кислота — вивчали, кислота + основа (будь-яка) — вивчали, тож треба лише запам'ятати забарвлення індикаторів і взаємодію з металічними елементами й солями.

про публікацію авторської розробки
Додати розробку
