Класифікація вуглеводнів. Алкани. Загальна формула алканів, структурна ізомерія, систематична номенклатура
Тема уроку: «Класифікація вуглеводнів.
Алкани. Загальна формула алканів, структурна ізомерія, систематична номенклатура»
Мета:
освітня – створити умови для формування в учнів знання про гомологію, гомологічні ряди на прикладі алканів; ознайомити учнів з номенклатурою алканів за міжнародною номенклатурою IUPAC; розвивати навички й уміння складати структурні формули й називати органічні сполуки на прикладі алканів, називати насичені вуглеводні за структурною формулою та складати структурні формули за назвами; ознайомити учнів з фізичними властивостями гомологів метану.
розвиваюча - допомогти розвивати логічне мислення, вміння порівнювати, аналізувати, робити висновки.
виховна – сприяти вихованню інтересу до предмету.
Формування ключових компетентностей: спілкування державною мовою, основні компетентності у природничих науках і технологіях, уміння вчитися впродовж життя, соціальна та громадянська компетентності, обізнаність та самовираження у сфері культури, екологічна грамотність і здорове життя.
Наскрізні лінії: «Екологічна безпека і сталий розвиток».
Обладнання: м/м дошка, проектор, ПК, пластилін, сірники, парафін.
Основні поняття і терміни: алкани, ізомерія, номенклатура, радикали, конформація.
Методи та прийоми: бесіда, демонстрація, пояснення, розповідь.
Тип уроку: вивчення нового матеріалу.
Дата проведення: ___________
Клас: 10
Структура уроку
І.Етап орієнтації, мотивації діяльності.
ІІ. Етап цілевизначення та планування.
ІІІ.Етап цілереалізації.
ІV. Рефлексивно-оцінювальний етап.
V. Етап повідомлення домашнього завдання.
Хід уроку.
І.Етап орієнтації, мотивації діяльності.
Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій та робочий лад.
Оголошення теми, мети уроку.
 Бліц-опитування.
Бліц-опитування.
- Що вам відомо про алкани?
- Загальна формула.
- Назвіть відомі вам представники.
ІІ. Етап цілевизначення та планування.

 Учням пропонується ознайомитися з табличками : "Знати" і "Вміти".
Учням пропонується ознайомитися з табличками : "Знати" і "Вміти".
ІІІ.Етап цілереалізації.
Насичені вугдеводні – органічні сполуки, в молекулах яких всі атоми карбону сполучені одинарними зв’язками (σ-) і мають загальну формулу:
CnH2n+2 (Слайд 4).
Гомологи – речовини, які мають подібну будову і властивості
і відрізняються на одну і більше груп СH2 (гомологічна різниця). (Слайд 5).
Ізомери - Сполуки, що мають однакові молекулярні формули, але різну будову, а тому й різні властивості. Зі зростанням кількості атомів Карбону в молекулі зростає число можливих ізомерів. Якщо для бутану С4Н10 існують два ізомери, для пентану С5 Н 12 — три, то для декану С10 Н 22 їх 75, а для ейкозану С20 Н42 — 366 319 ізомерів. (Слайд 6)
Структурна ізомерія:
CH3 - CH2 - CH2 - CH2 - CH3
або CH3 – CH - CH2 - CH3
│
CH3 (Слайд 7)
Номенклатура насичених вуглеводнів.
Алгоритм
- Вибір найдовшого ланцюга:
CH3 – CH - CH2 - CH3
│
CH3 (Слайд 8)
- Нумерація атомів найдовшого ланцюга:
1 2 3 4
CH3 – CH - CH2 - CH3
│
CH3 (Слайд 9).
- Утворення назви :
1 2 3 4
CH3 – CH - CH2 - CH3
│
CH3
2 - метилбутан (Слайд 10).
Радикал –це частинка, що має неспарені лектрони. (Слайд 11)
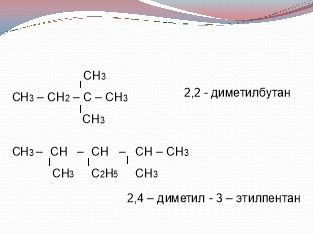 (Слайд 12)
(Слайд 12)
Молекули насичених вуглеводнів мають зигзагоподібну просторову будову з параметрами, властивими молекулі метану:
- довжина зв’язку 0,154 нм
- величина кута між атомами 109 0,21 I
- тип гібридизації. SP 3 (Слайд 13)
Для подальшого вивчення будови алканів скористаємося моделями їх молекул.
Д о с л і д А. Моделі ізомерів пентану.
Моделі молекул можна зібрати з деталей стандартного набору або виготовити власноруч із пластиліну й сірників.
Для складання моделі молекули пентану С5 Н 12 знадобиться пластилін двох кольорів. Виготовте п’ять кульок одного кольору більшого діаметра (атоми Карбону) і дванадцять кульок іншого кольору і меншого діаметра (атоми Гідрогену). З’єднайте між собою за допомогою сірників (хімічні зв’язки) кульки більшого діаметра, потім приєднайте до них кульки меншого діаметра, пам’ятаючи про чотиривалентність атомів Карбону.
Д о с л і д Б. Модель молекули етану.
Для складання моделі молекули етану С2 Н 6 також знадобиться пластилін двох кольорів. Виготовте дві кульки одного кольору більшого діаметра (атоми Карбону) і шість кульок іншого кольору і меншого діаметра (атоми Гідрогену). З’єднайте між собою за допомогою сірників (хімічні зв’язки) кульки більшого діаметра, потім приєднайте до них кульки меншого діаметра, пам’ятаючи про чотиривалентність атомів Карбону.
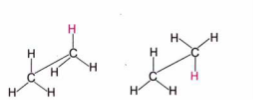 Зверніть увагу, що групи атомів СН3 можна вільно обертати навколо зв’язку С—С, при цьому можлива безліч взаємних положень атомів Гідрогену, зокрема такі:
Зверніть увагу, що групи атомів СН3 можна вільно обертати навколо зв’язку С—С, при цьому можлива безліч взаємних положень атомів Гідрогену, зокрема такі:
Серед цих форм молекул є енергетично вигідні й невигідні, між якими існує певний енергетичний бар’єр. Якщо за нормальних умов відмінність у значеннях енергії форм є незначною, як, наприклад, у етану (усього 12 кДж/моль), то обертання груп навколо о-зв’язку вважають практично вільним.
Енергетично вигідні просторові форми молекул, що утворюютьсявнаслідок обертання атомів або груп атомів навколо а-зв’язків, називають конформаціями. За низьких температур молекули перебувають в енергетично найвигіднішому стані, або, інакше кажучи, в найстабільнішій конформації.
Для етану найстабільнішою (з мінімумом енергії) вважають ту форму, в якій атоми Гідрогену найвіддаленіші один від одного, відштовхування між ними є найменшим, а взаємодія — мінімальною. Цю форму називають загальмованою. Найменш імовірну (з максимумом енергії) форму молекули етану називають затіненою.
Ви, напевне, вже звикли, що вивченню хімічних властивостей речовин передує вивчення їхніх фізичних властивостей. Чому вони цікавлять хіміків не менш ніж хімічні реакції? З’ясуємо, з якою метою вивчають фізичні властивості речовин. Агрегатний стан та зовнішні фізичні ознаки речовини, колір, запах — насамперед із цим стикається дослідник. Подальше вивчення речовини пов’язане з такими її фізичними властивостями, як температури плавлення (для речовини в твердому стані), кипіння (для рідини).
За фізичними властивостями можна розпізнавати речовини, оскільки кожна з них має власні фізичні константи. Вони відбивають і ступінь чистоти речовини, бо наявність домішок впливає на густину, температури плавлення, кипіння.
На використанні фізичних властивостей речовин ґрунтується багато промислових процесів, зокрема перегонка нафти, тобто розділення її на компоненти за температурами кипіння. Розділення або очищення речовин перекристалізацією з розчину залежить від їх розчинності в різних розчинниках, у тім числі у воді.
У шкільному курсі хімії розглядають такі характеристики речовин, як температури плавлення і кипіння, густина, розчинність, згодом ви ознайомитеся зі спектральними характеристиками. Останні широко використовують для ідентифікації (від лат.
речовин. Фізичні властивості речовин залежать від їхньої будови. Розглянемо, як вона позначається на температурах плавлення і кипіння.
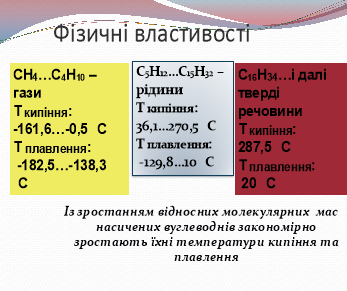 (Слайд 14)
(Слайд 14)
Алкани — неполярні або слабкополярні сполуки, практично нерозчинні у воді, яка є полярною сполукою.
Газуваті й тверді алкани не мають запаху, а рідкі (складу С5—С17) мають характерний запах бензину.
Природний газ, що надходить у газові магістралі, має, як ви знаєте, неприємний запах. Він спричинений навмисним добавлянням спеціальних речовин — меркаптанів,
ІV. Рефлексивно-оцінювальний етап.
 Вправа «Ти - мені, я - тобі». Учні задають один одному питання з вивченої теми.
Вправа «Ти - мені, я - тобі». Учні задають один одному питання з вивченої теми.
Вправа « Незакінчене речення»
V. Етап повідомлення домашнього завдання.
Опрацювати § 4, виконати завдання № 30-31(ст. 33), скласти ребуси «Алкани»


про публікацію авторської розробки
Додати розробку
