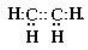Конспект "Алкени і алкіни . Загальна та молекулярні формули алкенів і алкінів, структурна ізомерія, систематична номенклатура"
Тема уроку: «Алкени і алкіни . Загальна та молекулярні формули алкенів і алкінів, структурна ізомерія, систематична номенклатура»
Мета:
освітня – створити умови для формування знань учнів про гомологічні ряди алкенів і алкінів на прикладі етилену, ацетилену ; ознайомити учнів з природою кратного зв’язку, ізомерією за місцем положення кратного зв’язку і між класовою ізомерією; удосконалювати навички і вміння складати структурні формули і давати їм назви. Ознайомити з фізичними властивостями алкенів.
розвиваюча - допомогти розвивати здатність учнів до самовизначення в діяльності та спілкуванні; мислити, діяти, самореалізуватись.
виховна – сприяти формуванню відповідальності, сприяти трудовому вихованню.
Формування ключових компетентностей: спілкування державною мовою, основні компетентності у природничих науках і технологіях, уміння вчитися впродовж життя, соціальна та громадянська компетентності, обізнаність та самовираження у сфері культури, екологічна грамотність і здорове життя.
Обладнання: шаростержневі моделі, мультимедійна презентація до уроку, зошит, підручник.
Основні поняття та терміни: алкени, алкіни, етилен, ацетилен, ізомерія, ізомери, цис-, транс-ізомерія.
Методи та прийоми: графічний диктант, бесіда, пояснення, розповідь, ілюстрація, демонстрація.
Тип уроку: засвоєння нових знань.
Дата проведення: ___________
Клас: 10
Структура уроку
І.Етап орієнтації, мотивації діяльності.
ІІ. Етап контролю домашнього завдання.
ІІІ. Етап цілевизначення та планування.
ІV.Етап цілереалізації.
V. Рефлексивно-оцінювальний етап.
VІ. Етап повідомлення домашнього завдання.
Хід уроку.
І.Етап орієнтації, мотивації діяльності.
Привітання з класом, налаштування на робочий настрій.
 Привітання з класом, налаштування на робочий настрій.
Привітання з класом, налаштування на робочий настрій.
Нумо, діти, підведіться!
Всі приємно посміхніться.
Продзвенів уже дзвінок,
Починаємо урок!
ІІ. Етап контролю домашнього завдання.
![]()
![]()
![]() Графічний диктант.
Графічний диктант.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]() 1 2 3 4 5 6 7 8 9 10
1 2 3 4 5 6 7 8 9 10
![]() Позначте значком « » вірну відповідь, значком « » невірну.
Позначте значком « » вірну відповідь, значком « » невірну.
1. Алкани відносяться до хімічно активних речовин.
2. Наявність в молекулах алканів лише одинарних (простих) зв’язків обумовлює особливості хімічних властивостей алканів.
3. Під дією метану фіолетовий розчин калій перманганату знебарвлюється.
4. Всі алкани горять, вивільняючи значну кількість теплоти, реакції горіння – це екзотермічні реакції.
5. Реакція С2Н6 + Cl2 → С2Н5Cl + НCl називається реакцією хлорування.
6. Метан та його гомологи розкладаються при сильному нагріванні без доступу кисню на водень і сажу.
7. Алкани можуть вступати в реакції приєднання галогенів.
8. Алкани застосовуються як паливо завдяки здатності вступати в реакції термічного розкладу.
9. Якщо через розчин брому, що має бурий колір, пропустити метан, то розчин знебарвиться.
10. Гомологи метану С5 ─ С11 є основою пального для автомобільних двигунів.
ІІІ. Етап цілевизначення та планування.
Вуглеводні містять Гідроген і Карбон. Якщо речовина має склад СnH2n+2, то це алкан (СН4, С2Н6…)
А чи можна віднести до алкенів речовину С2Н4 і С2Н2 ? Чому? Ці речовини належать до інших гомологічних рядів – алкенів і алкінів.
Мета уроку: познайомимося з алкенами та алканами. Навчитися складати їх формули, називати, описувати особливості будови. Розглянути типи ізомерії характерні для ненасичених вуглеводнів.
Учні з допомогою вчителя формулюють план дій.
ІV.Етап цілереалізації.
1)Алкени.
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен.
Заповнити таблицю « Гомологічні ряди вуглеводнів»
(учні під керівництвом вчителя заповнюють таблицю та дають назву вуглеводням.
|
Алкани СnН2n +2 |
Алкени СnН2n |
|
СН4 метан С2Н6 етан С3 С4 С5 і т.д. |
─ С2Н4 етен (етилен) |
Чому немає алкенів з одним атомом Карбону?
Будова молекул етилену і ацетилену.
|
Ознака |
Етилен (алкен) |
|
Особливості будови |
Має 1 подвійний зв’язок С=С |
|
Молекулярна формула |
С2Н4 |
|
Електронна формула |
|
|
Структурна формула |
Н Н |
Види ізомерії
- Ізомерія карбонового ланцюга
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 1-бутен
1 2 3
СН2 = С– СН3 2-метилпропен
|
СН3
- Ізомерія положення кратного зв’зку
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 1-бутен
1 2 3 4
СН3 - СН = СН – СН3 2-бутен
Міжкласова ізомерія
Алкени ізомерні циклоалканам.
С3Н6
СН2 = СН – СН3 пропен
![]() СН2
СН2
Н 2С СН2 циклопропан (циклоалкан)
- Просторова ізомерія (цис – і транс - )
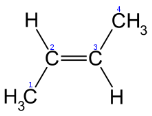
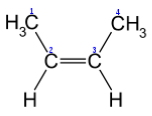
транс-2-бутен цис-2-бутен
Фізичні властивості етилену.
- Гази – прозорі. Безбарвні
- Майже без запаху (С2Н4 слабкий солодкуватий запах)
- Малорозчинні у воді
- Легші за повітря : М(С2Н4) = 28 г/моль
М(повітря) = 29 г/моль
2) Алкіни.
Алкіни – вуглеводні, що містять в молекулі один або кілька потрійних зв’язків і відповідають загальній формулі.
СnН2n - 2, где n ≥ 2.
Алкіни відносяться до ненасичених вуглеводнів, так як їх молекули містять меншу кількість атомів гідрогену, ніж насичені вуглеводні.
Характеристика подвійного зв’язку:
- Вид гібридизації – sp
- Валентний кут – 180°
- Довжина зв’язку С = С – 0,12 нм
- Будова ─ лінійна
- Вид зв’язку – ковалентний полярний
- За типом перекриття хмар – δ і 2 π
До вашої уваги схема утворення sp -гібридних орбіталей. в молекулі ацетилену sр- гібридизація. Два р – електрони у кожного атома Карбону не гібридизовані, зберігають свою форму об’ємних вісімок. Молекула ацетилену лінійна і негібридні хмари перекриваються в двох взаємоперпендикулярних площинах, утворюючи два π – зв’язки: у молекулі ацетилену між атомами Карбону існує потрійний зв’язок, він теж належить до ненасичених вуглеводнів, до гомологічного ряду алкінів, або ацетиленових вуглеводнів.
Гомологічний ряд алкінів.
Так само, як у випадку алканів і алкенів, у ряду алкінів кожен наступний представник відрізняється від свого попередника фрагментом—СН2 — , що носить назву гомологічної різниці, а утворений ряд – гомологічний.
 Ізомерія алкінів. Через те, що атом Карбону з потрійним зв’язком може мати тільки два замісники, геометрічна ізомерія, характерна для алкенів, втрачає сенс. Отже, для алкінів залишаються характерними ізомерія вуглецевого скелета та ізомерія положення потрійного зв’язку.
Ізомерія алкінів. Через те, що атом Карбону з потрійним зв’язком може мати тільки два замісники, геометрічна ізомерія, характерна для алкенів, втрачає сенс. Отже, для алкінів залишаються характерними ізомерія вуглецевого скелета та ізомерія положення потрійного зв’язку.
Структурна ізомерія
1. Ізомерія положення потрійного зв’язку (починаючи з С4Н6):
СН ССН2СН3 СН3СССН3
бутин-1 бутин-2
2. Ізомерія карбонового скелету (починаючи з С5Н8):
СН ССН2СН2СН3 СН ССНСН3
СН3
пентин-1 3-метилбутин-1
3. Міжкласова ізомерія з алкадієнами і циклоалкенами, (починаючи з С4Н8):
СН = СН
СН С–СН2–СН3 СН2=СН–СН=СН2
СН2 –СН2
бутин-1 бутадієн-1,3 циклобутен
Фізичні властивості.
Температура кипіння і плавлення алкінів, так як і алкенів, закономірно підвищується із зростанням молекулярної маси сполук.
Алкіни мають специфічний запах. Вони краще, ніж алкани і алкени розчиняються у воді.
V. Рефлексивно-оцінювальний етап.
Доповнюємо порівняльну таблицю під керівництвом учителя(Алкіни)
|
Характеристика |
Алкани |
Алкени |
Алкіни |
|
Загальна формула |
СnН2n - 2 |
СnН2n |
СnН2n - 2 |
|
Фізичні властивості |
C2H6 — етан |
C2H4 — етилен |
C2H2 — ацетилен |
|
|
Газ без запаху |
Газ зі слабким запахом |
Газ без запаху |
|
Тпл = -182,8 °С
|
Тпл = -169,5 °С |
Тпл = -80,8 °С (за тиску 170 кПа) |
|
|
Ткип = -88,6 °С
|
Ткип = -103,8 °С
|
Ткип = -83,8 °С (сублімація) |
|
|
Незначною мірою розчиняється у воді, краще — в органічних розчинниках |
Незначною мірою розчиняється у воді, краще — в органічних розчинниках |
Слабко розчиняється у воді, добре — в ацетоні під тиском |
Підбиття підсумків уроку. Оцінювання учнів.
VІ. Етап повідомлення домашнього завдання.
Опрацювати § 8,10
Для речовини СН2=СН-СН2-СН2-СН3 написати 2 гомолога і 2 ізомера (для бажаючих)
-
-
Дякую!


про публікацію авторської розробки
Додати розробку