Конспект "Хімічні властивості лугів та основ"
Тема. Хімічні властивості лугів та основ
Мета та цілі уроку: закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ; показати дію лугів на індикатори, увести поняття «реакція обміну» та «реакція нейтралізації»; навести правила безпеки під час користування лугами.
Тип уроку: формування вмінь і навичок, урок-дослідження.
Форми роботи: розповідь учителя, демонстраційний експеримент, лабораторні досліди, керована практика, «мозковий штурм», самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, хімічні реактиви, картки із завданнями, мультимедіа, комп’ютер.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань
«Мозковий штурм»
- Як відрізнити основи від інших класів неорганічних сполук?
- Які фізичні властивості основ?
- Назвіть луги.
- Де застосовують основи.
III. Мотивація навчальної діяльності
Інтерактивна вправа «Незакінчене речення»
- Основи – це складані речовини, які складаються з ……
- Основи поділяються на дві групи……
- Дайте назви основам… NaOH, Ca(OH)2, Al(OH)3, KOH, Cu(OH)2, Ba(OH)2, Fe(OH)3
- Луги це - …… барій гідроксид, купрум(II)гідроксид, калій гідроксид, алюміній гідроксид, цинк гідроксид, натрій гідроксид, магній гідроксид
- Нерозчинні основи це - …… купрум(II)гідроксид, літій гідроксид, алюміній гідроксид, цинк гідроксид, натрій гідроксид
IV. Вивчення нового матеріалу
1. Лабораторний дослід № 2. Дія лугів на індикатори (робота в лабораторному зошиті)
Для проведення цієї лабораторної роботи ми використаємо індикатори (складні органічні речовини, що змінюють своє забарвлення в залежності від середовища)
Наливаємо у три посудини натрій гідроксид, а у другу кальцій гідроксид, а в третю – дистильовану воду. Далі в перше заглиблення з кислотами додаємо одну краплю метилового оранжевого, у друге — одну краплю лакмусу, у третє — одну краплю фенолфталеїну. Записуємо спостереження в лабораторному зошиті, ст. 8-9.
Висновок. У розчинах лугів метиловий оранжевий набуває жовтого забарвлення, лакмус — синього, фенолфталеїн — малинового. Отже, розчини лугів можна визначити з допомогою індикатора.
2. Демонстрація. Хімічні властивості основ
Подивимося практично, які властивості повинні мати основи.
Дослід 1. Безпека під час роботи з лугами (папір, тканина, деревина)
Луги – їдкі речовини, вони роз’їдають шкіру, деревину, папір. Треба оберігати очі захисними окулярами, а при потраплянні на шкіру, промити великою кількістю проточної води та змастити розчином оцтової кислоти.
Дослід 2. Взаємодія лугів з кислотами
• Такі реакції називаються реакціями нейтралізації
Реакції між кислотою та основою, у результаті якої утворюється сіль та вода, називають реакціями нейтралізації.
• Що реакція відбулася, нам допоможе побачити індикатор. У дві пробірки наливаємо NaOH і Са(ОН)2, додаємо фенолфталеїн.
А потім по краплях знебарвлюємо розчин хлоридною кислотою. Пропонуємо учням записати рівняння реакцій:
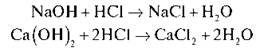
Укажіть тип реакції. (Реакція обміну)
Реакція обміну – це реакція у яких дві речовини обмінюються своїми частинами.
Запишіть самостійно: Ca(OH)2 + HCl =
Дослід 3. Взаємодія лугів з кислотними оксидами.
Збираємо прилад для одержання вуглекислого газу. Одержаний газ пропускаємо крізь розчин кальцій гідроксиду.
— Яку ознаку реакції спостерігаємо? (Випадіння осаду) Записуємо рівняння реакції:
СO2 + Са(ОН)2 ![]() СаСO3 + Н2O
СаСO3 + Н2O
Укажіть тип реакції. (Реакція обміну)
Запишіть самостійно: 2KOH + SO2 = K2SO3 + H2O
Дослід 4. Взаємодія лугів із солями
У дві пробірки наливаємо CuSO4, Al2(SO4)3, потім по краплях додаємо розчин їдкого натру.
— Які ознаки реакції спостерігаємо? (Утворення нерозчинного осаду)
Напишемо рівняння реакції:
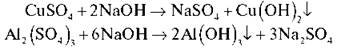
Запишіть самостійно: Al2(SO4)3 + NaOH =
Дослід 5. Розкладання нерозчинних основ у процесі нагрівання.
Нерозчинні основи за нагрівання розкладаються на оксид і воду. Перевіримо це на практиці.
Одержіть Сu(OH)2, закріпіть пробірку в пробірко-тримачі.
• Як правильно нагріти пробірку?
• В якій частині полум'я необхідно нагрівати пробірку? (У верхній, найбільш гарячій)
• Що спостерігаємо? Напишемо рівняння реакції:
Cа(OH)2 ![]() СаO + Н2O
СаO + Н2O
Укажіть тип реакції. (Реакція розкладу)
Запишіть самостійно: 2Al(OH)3 = Аl2O3 + 3H2O
-
Висновок. З якими властивостями основ ми познайомилися на цьому уроці.
- Реакція нейтралізації.
- Реакція обміну.
- Розклад нерозчинних основ.
- Взаємодія лугів з солями.
- Взаємодія лугів з кислотними оксидами.
V. Закріплення вивченого матеріалу
Керована практика, робота в парах.
- Знайти відповідні закінчення реакцій (робота з картками)
- Установити відповідність між вихідними речовинами та продуктами реакцій.
- Установити відповідність між індикаторами і його кольором у лугах.
VI. Домашнє завдання
Опрацювати параграф 33. №3, 8 ст. 180


про публікацію авторської розробки
Додати розробку
