Конспект уроку «Дисоціація води Поняття про водневий показник — рН реакції середовища»
Урок
Тема: Дисоціація води Поняття про водневий показник — рН реакції середовища.
Мета:
- дати теоретичне поняття «водневий показник»,
- навчити розрізняти рН лужного, кислого та нейтрального середовища;
- виявляти в розчині гідроксид-йонів та йонів Гідрогену;
- використовувати значення рН для характеристики кислотного чи лужного середовища;
- оцінювати важливість рН розчинів для визначення
Обладнання: індикатори, універсальний папірець
Тип уроку: засвоєння нових знань
Форми роботи: лекція, виконання вправ
Хід уроку:
І. Організація класу
Самостійна робота
|
Варіант |
Назва речовини |
Формула речовини |
Рівняння дисоціації |
|
1 |
1. Нітратна кислота |
|
|
|
1 |
2. Барій сульфат |
|
|
|
1 |
3. Калій гідроксид |
|
|
|
2 |
1. Силікатна кислота |
|
|
|
2 |
2. Барій нітрат |
|
|
|
2 |
3. Натрій карбонат |
|
|
ІІ. Оголошення теми і мети уроку
ІІІ. Актуалізація опорних знань
- Які сполуки називають електролітами?
- Записати дисоціацію водних розчинів хлоридної кислоти і сульфітної кислоти.
- І хлоридна і сульфітна кислоти дисоціюють на іони, але ступінь дисоціації хлоридної кислоти більше 70%, а сульфітної менше 30%. Отже сульфітна кислота електроліт середньої сили. Ви знаєте, що є електроліти ступінь дисоціації яких менше 2%, такі електроліти називають слабкими. Слабким електролітом е вода.
IV. Мотивація навчальної діяльності
Сьогодні ми вивчимо як вода дисоціює на іони? Що таке водневий показник? І від чого залежить рН середовища
V. Вивчення нового матеріалу
1. Дисоціація води
Вода – це слабкий електроліт. Її ступінь дисоціації = 1,8 *10-9.
Це означає, що:
В 1 л води = 1000 г
Міститься молекул
m = 1000 = 55 моль
M 18
Із 55 моль Н2О
Дисоціює лише – 10-7 моль Н2О = Н+ + ОН-
10-7 моль 10-7 моль 10-7 моль
Отже / Н+/ = /ОН-/ = 10-7 моль/л
Добуток концентрацій Гідроген - йонів і гідроксид-йонів називають йонним добутком води:
І Н2О = / Н+/ * /ОН-/ = 10-7 * 10-7 = 10-14
Розчини в яких / Н+/ = /ОН-/ = 10-7 моль/л називають нейтральними.
Розчини в яких / Н+/ > /ОН-/ , це 10-6 , 10-5, 10-4, 10-3, 10-2, 10-1 моль/л називають кислими
Розчини в яких / Н+/ < /ОН-/ , це 10-8 , 10-9, 10-10, 10-11, 10-12, 10-13 , 10-14моль/л називають лужними
2. Водневий показник.
В 20 ст. для зручності вираження середовища розчину ввели поняття водневий показник.
Водневий показник позначається рН.
Водневий показник рН – це від’ємний десятковий логарифм концентрації Гідроген-йонів.
рН = - lg /Н+/
Це поняття було введено в 1909 році датським хіміком Серенсеном. 
Показник називається pH, за першими літерами латинських слів potentia hydrogeni - сила водню, або pondus hydrogenii
Наприклад:
Для нейтрального розчину
/ Н+/ = 10-7 , тоді рН = - lg 10-7 = - (- 7) = 7
Для кислого розчину
/ Н+/ = 10-6 , тоді рН = - lg 10-6 = - (- 6) = 6
/ Н+/ = 10-5 , тоді рН = - lg 10-5 = - (- 5) = 5
/ Н+/ = 10-4 , тоді рН = - lg 10-4 = - (- 4) = 4
/ Н+/ = 10-3 , тоді рН = - lg 10-3 = - (- 3) = 3
/ Н+/ = 10-2 , тоді рН = - lg 10-2 = - (- 2) = 2
/ Н+/ = 10-1 , тоді рН = - lg 10-1 = - (- 1) = 1
Для лужного розчину
рН = 8, 9, 10, 11, 12, 13, 14
Приклад 1. Визначити рН розчину хлоридної кислоти 0,1н
Розв’язок:
/ Н+/ = Скислоти = 0,1 = 10-1
тоді рН = - lg 10-1 = - (- 1) = 1, розчин кислий
Приклад 2. Визначити рН розчину натрій гідроксиду 0,01н розчину.
Розв’язок:
З рівняння іонного дбутку води І Н2О = / Н+/ * /ОН-/ = 10-14
/ Н+/ = 10-14 , /ОН-/ = 10-2
/ОН-/
тоді рН = - lg 10-12 = - (- 12) = 12, розчин лужний
Це теоретичне визначення рН.
Для практичного визначення рН користуються індикаторами.
Але потрібно пам’ятати, що різні індикатори при різних значеннях рН не однаково змінюють своє забарвлення.:
- метилоранж при рН = 4,
- лакмус – при рН – 7,
- фенолфталеїн – при рН = 9,
- універсальний папірець – при рН = 5
Залежність середовища розчинів від концентрації йонів Н+ и ОН-
|
Середовище |
Концентрація йонів Гідрогена [Н+], моль/л |
Концентрація гідроксид-йонов [ОН-], моль/л |
рН середовища |
|
Нейтральне |
10-7 |
10-7 |
7 |
|
Кисле |
>10-7 |
<10-7 |
<7 |
|
Лужне |
<10-7 |
>10-7 |
>7 |
ЛАБОРАТОРНІ ДОСЛІДИ 1,2
ТЕМА: Виявлення йонів Гідрогену та гідроксид – йонів у розчинах. Установлення приблизного значення рН води, лужних і кислих розчинів (натрій гідроксиду, хлоридної кислоти) за допомогою універсального індикатора.
МЕТА: експериментальним шляхом визначити наявність кислоти, основи і води в пробірках.
ОБЛАДНАННЯ І РЕАКТИВИ: розчин хлоридної кислоти, розчин натрій гідроксиду, вода, індикатори, штатив з пробірками.
ЗАВДАННЯ: Дослідити виявлення йонів Гідрогену та гідроксид – йонів у розчинах. Установити приблизне значення рН води, лужних і кислих розчинів (натрій гідроксиду, хлоридної кислоти) за допомогою універсального індикатора.
РЕЗУЛЬТАТИ ЛАБОРАТОРНОГО ДОСЛІДУ:
|
№ |
Досліджуваний розчин |
рН |
середовище |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
Висновок:
ЛАБОРАТОРНИЙ ДОСЛІД 3
ТЕМА: Дослідження рН харчової і косметичної продукції.
МЕТА: навчитися визначати рН розчинів харчової і косметичної продукції
ОБЛАДНАННЯ ТА РЕАКТИВИ: шампунь, рідке мило, розчин соди, лимонний сік, рідкий мийний засіб для посуду, засіб для чищення скла
ЗАВДАННЯ: Дослідити розчини харчової і косметичної продукції універсальним індикатором.
РЕЗУЛЬТАТИ ЛАБОРАТОРНОГО ДОСЛІДУ:
|
№ |
Досліджуваний розчин |
рН |
середовище |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
Висновок:
рН шкала
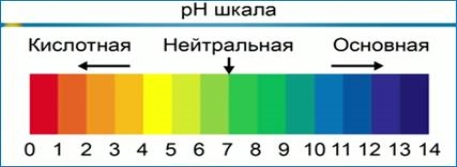
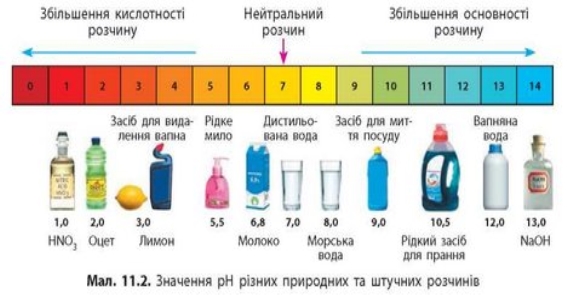
рН деяких рідин
|
Розчин |
рН |
Розчин |
рН |
|
Томатний сік |
4,1 |
Чорна кава |
5,0 |
|
Вода |
7,0 |
Сльози |
7,0 |
|
Кров |
7,4 |
Шлунковий сік |
1,4 |
|
Розчин соди (1% - ний) |
11,6 |
Сік щавлю |
3,7 |
|
Нашатирний спирт |
11,9 |
Яблучний сік «Антонівка» |
2,5 |
|
Вапняна вода |
12,9 |
Розчин натрій гідроксиду |
15,0 |
VІ. Закріплення вивченого матеріалу
1. Обчисліть рН 0,001М розчину хлоридної кислоти.
2. Обчисліть рН 0,001М розчину калій гідроксиду.
VІ. Підведення підсумків уроку
ВИСНОВОК:
1. Кислотно - основні властивості мають велике значення практично у всіх областях народного господарства.
2. Від кислотності або основності води дуже сильно залежить розкладання хімічних забруднювачів в стічних водах, швидкість корозії металевих предметів, що знаходяться у воді, а також придатність водного середовища до проживання в ній риб і рослин.
3. pH крові людини в нормі 7,34 - 7,44 зменшення цієї величини нижче 6,8 і збільшення їх до 8,0 призводить до загибелі організму.
VІІ. Домашнє завдання
§9 ст.47-57 Творче завдання: Підготувати повідомлення «Вплив рН на організм людини»
VІІІ. РЕФЛЕКСІЯ «ЗАКІНЧИ РЕЧЕННЯ»
Сьогодні я дізнався про …
Я запам'ятав …
Мені було цікаво …


про публікацію авторської розробки
Додати розробку
