Презентація на тему :"Реакції обміну між розчинами електролітів. Алгоритм складання йонно-молекулярних рівнянь хімічних реакцій ".
Про матеріал
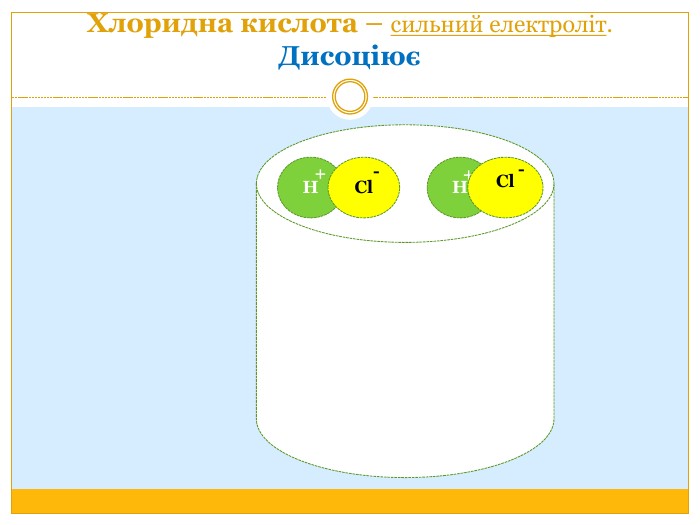
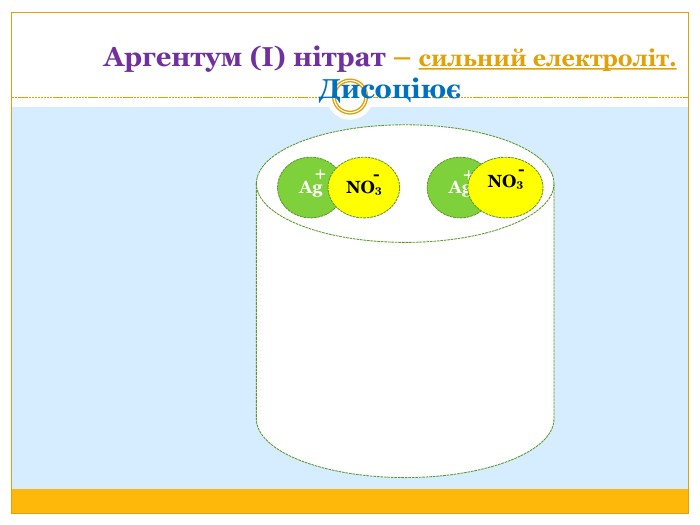
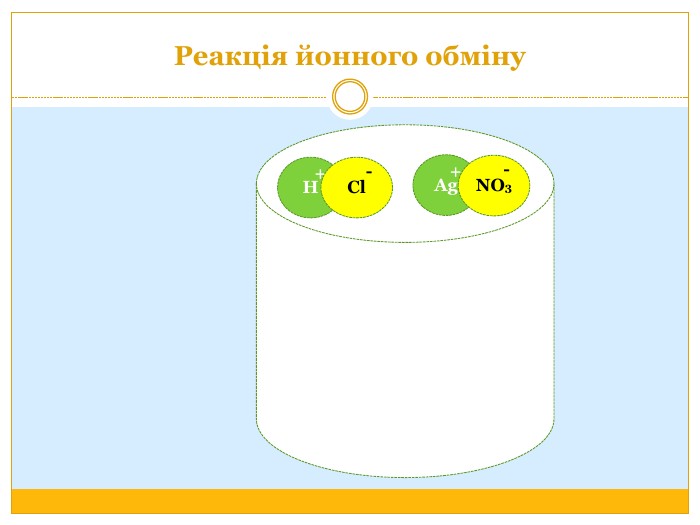
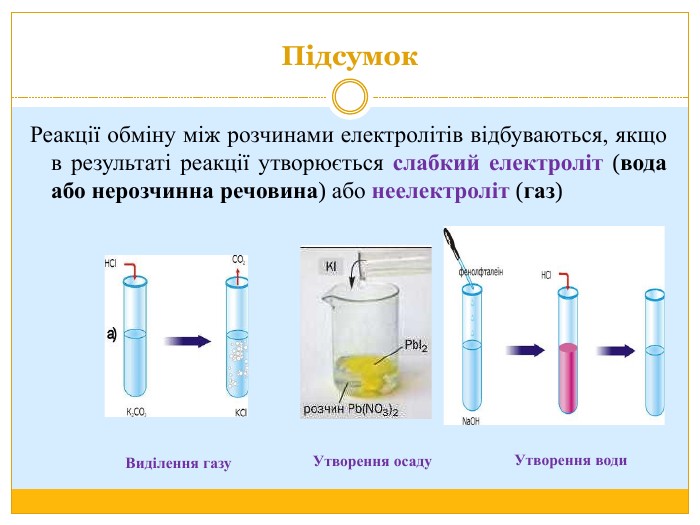
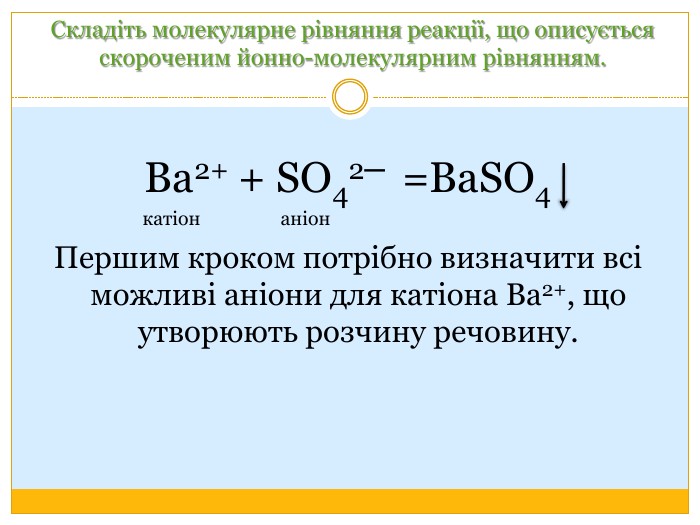
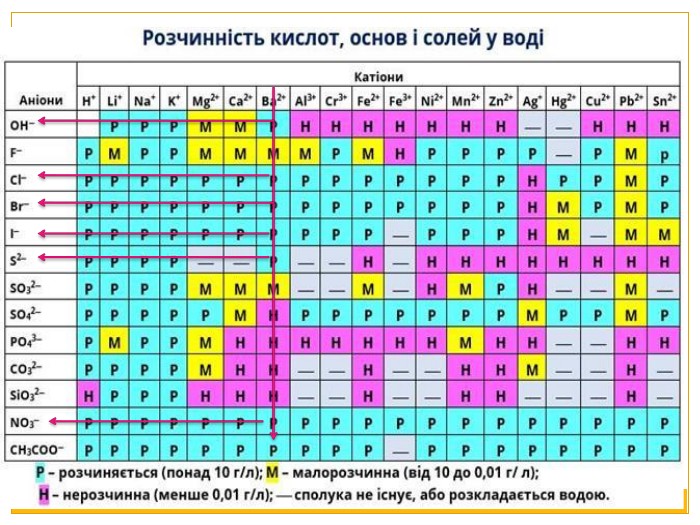
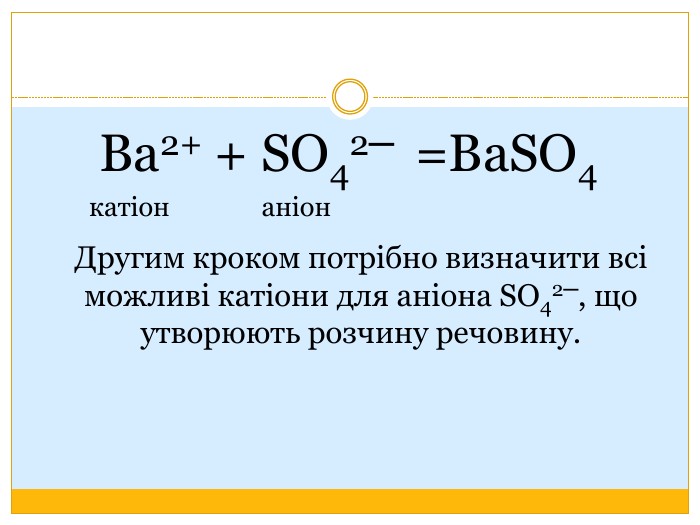
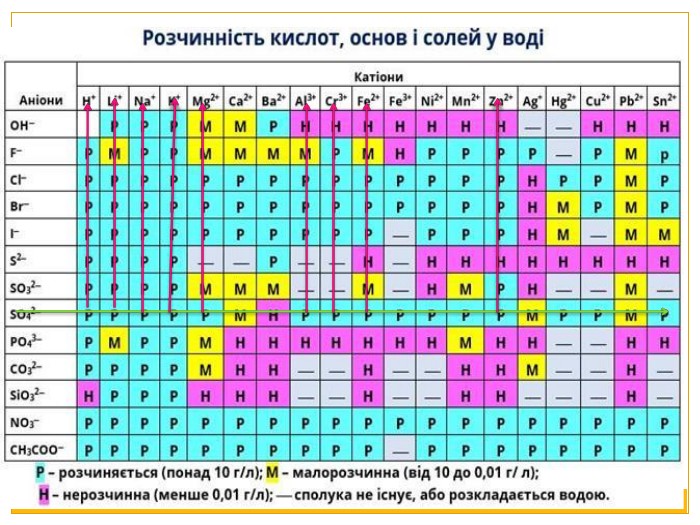
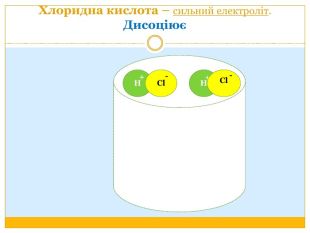
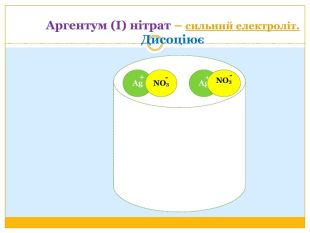
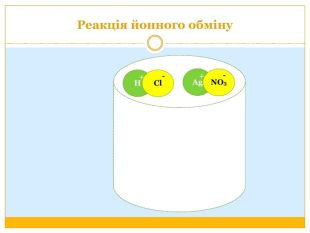
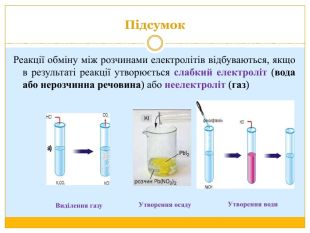
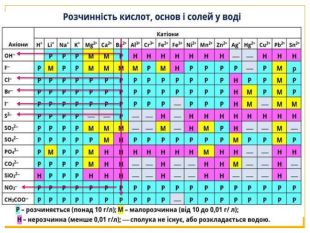
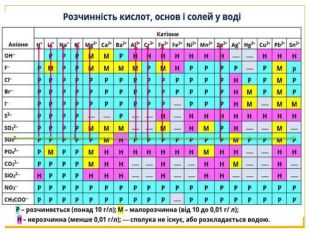
Матеріал можна використати під час вивчення теми :"Реакції обміну між розчинами електролітів. Алгоритм складання йонно-молекулярних рівнянь хімічних реакцій ". Презентація містить теоретичний та практичний матеріал, а також чітко прослідковується вміння визначати напрямок реакції; прогнозувати її результати; користуватися таблицею розчинності речовин; складати йонні рівняння; аналізувати, порівнювати, спостерігати. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку