Презентація до уроку «Дисоціація води Поняття про водневий показник — рН реакції середовища»
Про матеріал
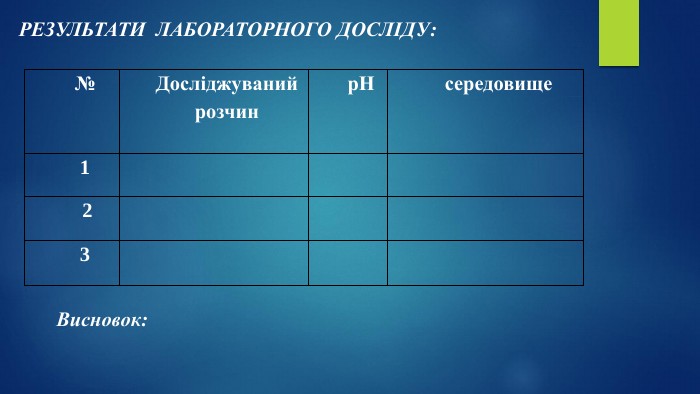
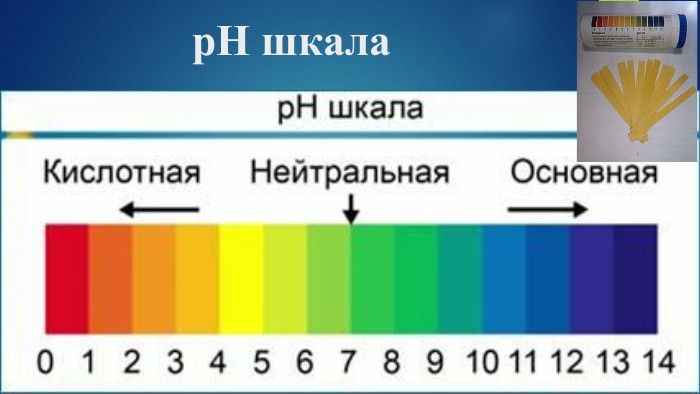
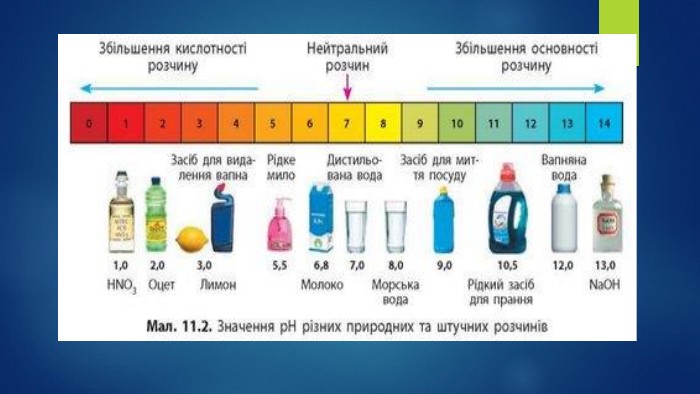
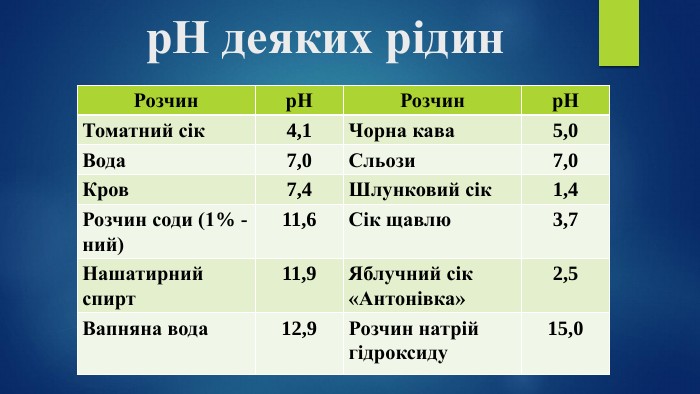
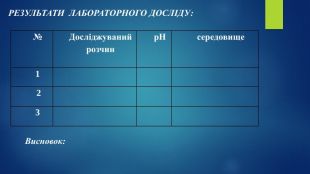
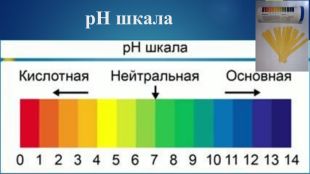
Пропоную добірку матеріалів до уроку в 9 класі по темі " Дисоціація води Поняття про водневий показник — рН реакції середовища". Інформація до цієї теми оформлена у формі презентації. В презентації розміщено досить багато інформації про поняття «водневого показнику», вчить розрізняти рН лужного, кислого та нейтрального середовища, виявляти в розчині гідроксид-йонів та йонів Гідрогену, використовувати значення рН для характеристики кислотного чи лужного середовища, оцінювати важливість рН розчинів. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку













![Залежність середовища розчинів від концентрації йонів Н+ и ОН- Середовище. Концентрація йонів Гідрогена [Н+], моль/л. Концентрація гідроксид-йонов[ОН-], моль/лр. Н середовища. Нейтральне10-710-77 Кисле>10-7<10-7<7 Лужне<10-7>10-7>7 Залежність середовища розчинів від концентрації йонів Н+ и ОН- Середовище. Концентрація йонів Гідрогена [Н+], моль/л. Концентрація гідроксид-йонов[ОН-], моль/лр. Н середовища. Нейтральне10-710-77 Кисле>10-7<10-7<7 Лужне<10-7>10-7>7](/uploads/files/23931/309159/339887_images/13.jpg)