Конспект уроку з хімії для 7 класу на тему "Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню".
Запропонований конспект уроку призначений для надання допомоги вчителям у підготовці та проведенні уроку хімії у 7 класі 11 – річної школи та складений відповідно до чинної програми.
Дата ______Клас _____ Вчитель: Дерев’янко Л.В.
УРОК № 28
Тема. Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню.
Завдання
Знаннєвий компонент:
• наводити приклади реакцій розкладу, пояснювати їх суть.
Діяльнісний компонент:
• розрізняти реакції розкладу і сполучення;
• складати рівняння реакцій: добування кисню з гідроген пероксиду ;
• використовувати лабораторний посуд для добування (з гідроген пероксиду) і збирання кисню;
• визначати наявність кисню дослідним шляхом;
• дотримуватися запобіжних заходів під час використання процесів горіння; інструкції щодо виконання хімічних дослідів та правил безпеки під час роботи в хімічному кабінеті. Ціннісний компонент
• обґрунтовувати застосування кисню;
• оцінювати значення кисню в життєдіяльності організмів; усвідомлювати наслідки небезпечного поводження з вогнем. Наскрізні змістові лінії:
Здоров’я і безпека. Безпечне поводження з речовинами.
Підприємливість і фінансова грамотність. Поняття про каталізатор. Обладнання та реактиви:
1)П.П.Попель, Л.С.Крикля. Хімія:Підручник для 7 класу загальноосвітніх навчальних закладів, - К.:«Академія», 2015;
2)періодична система хімічних елементів Д. І. Менделєєва;
3)лабораторний штатив із тримачем, спиртівка, пробірки, газовідвідна трубка, кристалізатор, скіпка, штатив для пробірок, вата; 4)гідроген пероксид, манган(ІV) оксид, вода.
Базові поняття та терміни: Оксиґен, кисень, гідроґен пероксид, каталізатор, реакція розкладу.
Тип уроку: комбінований.
Хід уроку
І. Організаційний момент
II. Перевірка домашнього завдання Фронтальна бесіда. --
1.Розкажіть про історію відкриття кисню?
2.Охарактеризуйте поширення Оксиґену в природі.
3.Охарактеризуйте склад та будову молекули кисню.
4.Охарактеризуйте фізичні властивості кисню.
III. Актуалізація опорних знань
Бесіда
1.Як кисень утворюється в природі? (У процесі фотосинтезу)
2.Важчий чи легший за повітря кисень? (Важчий)
3.Чи розчиняється кисень у воді?(Практично нерозчинний)
4.Чи здатний кисень горіти? (Кисень лише підтримує горіння)
Задача. Оксиґен міститься у мінералах: гематиті Fe2O3, кварці SiO2, піролюзиті MnO2. У яких з них масова частка Оксиґену найбільша? (Відповідь: w1(O) = 0,30; w2(O) = 0,53; w3(O) = 0,37)
IV. Вивчення нового матеріалу
1.Добування кисню в промисловості Розповідь учителя
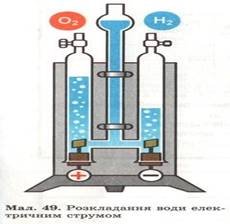
У промисловості кисень добувають електролізом води та зріджуванням повітря:
|
Електроліз води |
Розділення (зрідження) повітря. |
|
Через воду пропускають електричний струм, під дією якого вона розкладається на водень та кисень:
2H2O
ел. струм
|
Цей метод ґрунтується на використанні різних температур кипіння газів, з яких складається повітря.
1.Спочатку повітря сильно стискають (100200 атм.), а після цього різко знижують тиск. Внаслідок цього воно сильно охолоджується й переходить у рідкий стан (при температурі -192 °С). 2.Рідке повітря переганяють у ректифікаційній колоні. Так як азот кипить при -196 °С, а кисень - при -183 °С, то із рідкого повітря спочатку відганяється азот, а потім кисень. |
|
|
Установка для одержання кисню із повітря (киснева станція) |
2.Методи збирання кисню Розповідь учителя
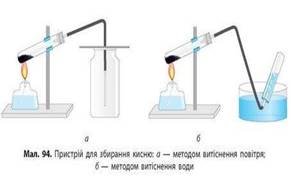
Існує два методи збирання кисню: 1) метод витіснення повітря ; 2) метод витіснення води.
Евристична бесіда:
- Як ви гадаєте на яких фізичних властивостях кисню базуються ці методи?
- Назвіть ці фізичні властивості кисню.
Робота з підручником (§20 ст.122,мал..56)
|
1) метод витіснення повітря.
|
2) метод витіснення води.
|
|
Кисень важчий за повітря, отже посудину-приймач слід тримати дном донизу. Кисень буде збиратися на дні посудини витісняючи повітря, що міститься в ній.
|
Посудину-приймач заповнюють водою по вінця. Закривають та перевертають догори дном. Опустивши отвір посудини у кристалізатор з водою, її відкривають під водою. Вода тримається у посудині. Знизу через трубку надходить кисень, який піднімається вгору, виштовхуючи воду, бо є малорозчинним у воді. |
|
|
|
3.Виявлення кисню Розповідь учителя
Кисень підтримує горіння. Тому жевріюча скіпка спалахує, щойно стикається з киснем.
4.Добування кисню в лабораторії Розповідь учителя
У лабораторії кисень добувають у невеликих кількостях. Для цього використовують речовини, які легко розкладаються з виділенням кисню незалежно від того, зустрічаються вони в природі чи добуті штучно. Для одержання кисню в лабораторії використовують термічно нестійкі оксиди, солі й інші речовини.
Робота з підручником ( §20 ст.120 -122), учні записують у зошит рівняння реакцій розкладу оксиґеновмісних речовин, підписують назви реагентів та продуктів реакції , а також зазначають умови при яких вони відбуваються.
. 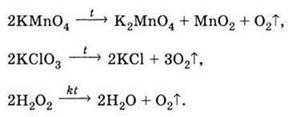
2NaNO3 →2NaNO2 +O2↑ 2 KNO3 →2KNO2 +O2↑
Демонстрації
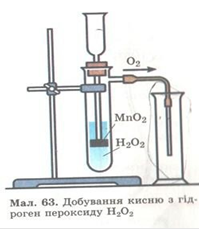
6. Добування кисню з гідроген пероксиду (H2O2)
а)У пробірку наливаємо невелику кількість (2-3 мл) 3%-го розчину H2O2. За кімнатних умов з розчину повільно виділяється кисень.
б) за тих самих умов демонструється дія каталізатора: у пробірку з H2O2 поміщається невелика кількість манган (ІV) оксиду. При цьому спостерігається сильне виділення кисню.
Розповідь учителя
Речовини, які змінюють швидкість реакції (збільшують або зменшують її), але самі при цьому не витрачаються, називаються каталізаторами. Отже, . манган (ІV) оксиду(MnO2) - каталізатор
7.Збирання кисню витісненням повітря та витісненням води.
8.Доведення наявності кисню. Внесемо тліючу скіпку в пробірку заповнену зібраним у попередньому досліді киснем. Скіпка спалахне.
Евристична бесіда:
- Що спільного є у реакціях, які ви записали у зошит?(У всіх реакціях утворюється кисень, ліва частина рівнянь мала по одній речовині) - Чим ці реакції відрізняються? ( У правій частині рівнянь утворюється кілька нових речовин)
Реакції, в результаті яких з однієї складної речовини утворюються декілька інших речовин (простих або складних), називаються реакціями розкладу.
V. Узагальнення й систематизація знань Ст.. 123 № 146 -150.
VІ. Домашнє завдання
• Опрацювати §20, конспект;
• Виконати завдання ст..123 №151;
• Підготуватися до практичної роботи №4 «Добування кисню з гідроген пероксиду з використанням різних біологічних каталізаторів, доведення його наявності»( ст.. 124 -126).
VІІ. Рефлексія
 Емоційно
передайте враження про урок:
Емоційно
передайте враження про урок:
• урок сподобався і тема зрозуміла;
• урок не сподобався і тема не зрозуміла;
• урок сподобався, але не все ще зрозуміло.
VІІІ. Підсумок уроку, оцінювання учнів


про публікацію авторської розробки
Додати розробку