Конспект уроку з хімії для 8 класу "Будова атома. Склад атомних ядер. Протонне число. Нуклонне число"
Автор: вчитель хімії Новоукраїнської ЗОШ №3 Ворона Людмила Миколаївна
8 клас Урок № 7. Тема.
Будова атома. Склад атомних ядер (протони і нейтрони). Протонне число. Нуклонне число. Нуклід. Сучасне формулювання періодичного закону.
Мета:
навчальна: повторити періодичний закон Д.І.Менделєєва, будову періодичної системи, вивчити будову атома, розкрити фізичний зміст порядкового номера, навчити обчислювати число протонів, нейтронів, електронів в атомі, заряд ядра атома, підвести учнів до сучасного формулювання періодичного закону.
розвиваюча: розвивати вміння застосовувати набуті знання на практиці, критично мислити, аналізувати, порівнювати, робити висновки;
виховна: формувати пізнавальний інтерес до предмету, соціальні компетентності учнів - адекватну самооцінку, доброзичливе ставлення один до одного, вміння слухати, сприяти формуванню наукового світогляду учнів.
Тип уроку:
- комбінований урок засвоєння знань, умінь і навичок та їх творчого застосування на практиці.
Форми роботи:
- евристична бесіда , фронтальна робота з класом, робота з текстом підручника.
перевірка знань у формі гри з кубиком, виконання тестів.
Обладнання: таблиці , кубик, мультимедійна презентація, сигнальні картки (А,Б,В,Г)
Хід уроку
І. Актуалізація опорних знань.
Перевірка знань у формі гри з кубиком. Учень, що спіймав кубик, продовжує речення , яке розпочинає вчитель.
- Періодичний закон відкрив російський вчений …..Д. І. Менделєєв
- Це сталося у ……. 1869 році
- Періодичний закон за Д. І. Менделєєвим, полягає в тому, що властивості хімічних елементів та їх сполук перебувають у періодичній залежності від …атомної маси елементів
- Графічним відображенням періодичного закону є …періодична система
- Основними структурними одиницями короткої форми періодичної системи є …періоди і групи
- Горизонтальний ряд хімічних елементів, що починається лужним металом і закінчується інертним газом, називається … період
- Періоди бувають………малі і великі
- Всього в періодичній системі виділяється…….7 періодів
- Вертикальний стовпчик хімічних елементів у ПС має назву … група
- Всього в періодичній системі виділяється…….8 груп
- Кожна група поділяється на ……підгрупи
- Підгрупа, до складу якої входять елементи і малих, і великих періодів, називається …..головною
- Підгрупа, що містить тільки елементи великих періодів, є … побічною
- У групах у міру зростання відносних атомних мас хімічних елементів металічні властивості … посилюються
- У періодах у міру зростання відносних атомних мас хімічних елементів металічні властивості …послаблюються
- У групах вища валентність елементів, як правило, відповідає … номеру групи
ІІ. Мотивація навчальної діяльності.
- Д.І.Менделєєв узагальнив великий обсяг матеріалу, відкрив періодичний закон, але рівень тогочасних знань не давав змоги розкрити фізичний зміст періодичного закону. Чому властивості змінюються періодично?
- Ви вже знаєте, що всі речовини складаються з атомів. Що таке атом? (Хімічно неподільна частинка, або, атом - це електронейтральна частинка, яка складається з позитивно зарядженого ядра та негативно заряджених електронів, що рухаються навколо ядра)
- У науці довго панувала думка, що атоми — найменші частинки речовини і не містять інших, простіших складових частинок. Тому вони неподільні і не можуть перетворюватися на інші атоми.
- Проте наприкінці XIX ст. фізики експериментально підтвердили складність будови атома.
- Відкриття рентгенівських променів (1895),
- Відкриття явища радіоактивності (1896),
- Відкриття електрона (1897)
Ці відкриття спричинили революцію в природознавстві, зокрема сприяли перегляду уявлень про структуру і властивості речовини, оскільки атом виявився складним утворенням. Саме відкриття радіоактивності відіграло велику роль у встановленні складної природи атома і розкритті його структури.
- Мета нашого уроку: з’ясувати, як побудований атом.
- Що ви знаєте про будову атома із курсу фізики, хімії 7 класу та інших наук? (Прийом «Мозковий штурм»)
ІІІ. Вивчення нового матеріалу
- У 1896 р. Беккерель випадково відкрив радіоактивність. Подальші дослідження радіоактивних променів тісно пов’язані з іменами подружжя: польської дослідниці Марії Склодовської та її чоловіка — француза П’єра Кюрі.
- Ернест Резерфорд (1911 р) дослідив неоднорідність природи радіоактивного випромінювання та запропонував планетарну модель будови атома.
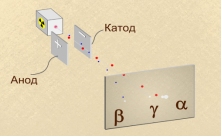
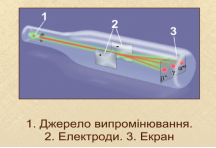
А) Резерфорд виявив, що радіоактивні елементи випромінюють три види променів: α, β, Ɣ. Прилад для доведення неоднорідності радіоактивного випромінювання складається з джерела випромінювання (1) у свинцевому контейнері, двух електродів (2) та екрана для реєстрування випромінювання (3).
Під дією електричного поля радіоактивне випромінювання поділяється на три пучки. Ɣ-випромінювання не відхиляється в електромагнітному полі. α-випромінювання відхиляється у бік катода, β-випромінювання - у бік анода. На основі досліджень Резерфорд запропонував планетарну модель будови атома.
Б) У 1911 р. англійський учений Е. Резерфорд сформулював
основні положення планетарної будови моделі атома
1). У центрі атома знаходиться позитивно заряджене ядро, розмір якого в десятки тисяч разів менший за розмір атома
2). Весь позитивний заряд і майже вся маса атома зосереджена в ядрі
( маса електрона = 1/1836 а.о.м)
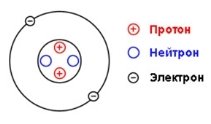
3). Ядро атома складається з нуклонів: протонів та нейтронів.
Число протонів (р+) дорівнює порядковому номеру елемента.
Число нейтронів (n0) в ядрі дорівнює різниці відносної атомної маси та порядкового номера елемента.
4). Навколо ядра рухаються електрони (е). Їх число дорівнює порядковому номеру елемента.
![]()
![]()
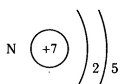 Заряд ядра атома дорівнює порядковому номеру елемента у періодичній системі.
Заряд ядра атома дорівнює порядковому номеру елемента у періодичній системі.
У цьому полягає фізичний зміст порядкового номеру
ядро електрони Кількість електронів в атомі дорівнює порядковому номере елемента у періодичній системі.
 Протонне число – кількість протонів в ядрі атома. Дорівнює порядковому номеру елемента та заряду ядра.
Протонне число – кількість протонів в ядрі атома. Дорівнює порядковому номеру елемента та заряду ядра.
Нуклонне число – сума протонів і нейтронів, масове число.
Нуклід – будь – який різновид атома з певним значенням протонного і нуклонного чисел.
Нейтрон — нейтральна частинка, що не має електричного заряду.
Протон — позитивно заряджена частинка. Заряд протона дорівнює заряду електрона, але протилежний за знаком. І ті, й інші мають масу, що приблизно дорівнює 1 а.о.м.
Порядковий номер = заряд ядра атома = кількість протонів = кількість електронів
-
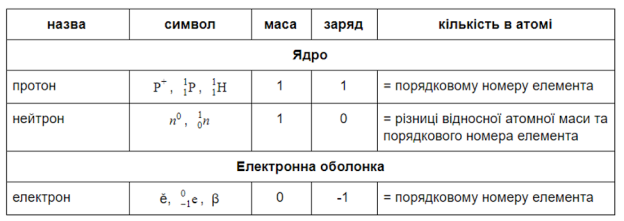 Характеристика часток, з яких складається атом (записуємо в зошит)
Характеристика часток, з яких складається атом (записуємо в зошит)
![]()
- Відкриття фізичного змісту порядкового номера дало нове обґрунтування розміщенню елементів у періодичній системі. З'ясувалося, що елементи розміщені не стільки за зростанням атомної маси, скільки за зростанням заряду ядер їх атомів. Дістала пояснення й удавана суперечність у системі Д. І. Менделєєва — розміщення трьох пар елементів (Аргон і Калій, Кобальт і Нікол, Телур і Йод) не в порядку зростання їх атомних мас, а навпаки. Виявилось, що таке розміщення відповідає величині зарядів ядер атомів цих елементів. Отже, суперечності немає.
Сучасне формулювання періодичного закону
Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів
( тобто хімічні властивості елементів визначає не відносна атомна маса,
а заряд ядра)
.
ІV. Закріплення набутих знань
- Визначення протонних, нуклонних чисел та кількості електронів

![]() 19 р+, 20 n0, 19 ē
19 р+, 20 n0, 19 ē
![]() 31
31
15 15р+, 16n0, 15ē.
![]() 16
16
8 8р+, 8n0, 8ē.
![]() 7
7
3 3р+, 4n0, 3ē.
- Тестове виконання завдань
(завдання демонструються на екрані, відповіді даються сигнальними картками)
- Атом складається з:
а) ядра й електронної оболонки, б) електронів,
в) молекул, г) нейтронів і протонів.
- Ядро атома складається з:
а) електронів, б) електронів і протонів,
в) протонів і нейтронів, г) нейтронів.
- Із порядковим номером елемента збігається:
а) значення відносної атомної маси, б) значення електронегативності,
в) кількість електронів в атомі, г) кількість нейтронів у ядрі.
- Протонне число дорівнює:
а) номеру періоду, б) номеру групи,
в) відносній атомній масі, г) порядковому номеру елемента.
- Кількість протонів у ядрі дорівнює:
а) порядковому номеру, б) номеру періоду,
в)номеру ряду, г) номеру групи.
- Електрони заряджені:
а) позитивно, б)не заряджені, в) додатньо, г) негативно.
- Основний внесок у масу атома роблять:
а) протони й електрони, б) протони і нейтрони,
в) нейтрони й електрони, г) електрони.
- Вкажіть характерну властивість нейтронів:
а) має заряд -1, б) має заряд +1,
в) не має маси, г) не має заряду.
- Вкажіть характерну властивість електронів:
а) має заряд -1, б) має заряд +1,
в) не має маси, г) не має заряду
- Заряд ядра атома Феруму дорівнює:
а) 26, б) 8, в) 56, г)4.
- Число протонів в атомі Фосфору:
а) 31, б) 15, в) 17, г) 46.
- Число електронів в атомі Бору:
а) 5, б) 6, в) 11, г) 22.
- Число нейтронів в атомі Калію:
а) 19,б) 39, в) 58, г) 20.
- Вкажіть номер групи, в якій міститься елемент, заряд ядра якого дорівнює 17:
а) VI, б) II, в) VII, г) I.
- В ядрі Флуору міститься:
а) 19 протонів, б)10 протонів, в) 9 протонів, г) 9 електронів.
Відповіді:
1- а, 2- в, 3- в, 4- г, 5- а, 6- г, 7- б, 8- г, 9-а, 10– а, 11- б, 12 - а, 13- г, 14- в, 15- в.
- Заповнити таблицю
|
Елемент |
Заряд ядра |
Число протонів |
Число електронів |
Число нейтронів |
Протонне число |
Нуклонне число |
|
Карбон |
|
|
|
|
|
|
|
Натрій |
|
|
|
|
|
|
V. Підведення підсумків уроку.
VІ. Домашнє завдання: Вивчити §4. Виконати вправу №24 ст. 25
Це цікаво:
- У 1903 році П’єр і Марія Склодовська-Кюрі разом одержали Нобелівську премію з фізики за відкриття радіоактивності. Після смерті чоловіка М. Склодовська-Кюрі продовжила дослідження й у 1911 році за одержання чистого Радію була удостоєна Нобелівської премії в галузі хімії. Уівіть собі дамські рукавички, які завжди носила М. Склодовська-Кюрі, щоб прикрити руки, безжалісно понівечені Радієм. А поруч, не вмовкаючи, тріскотить лічильник Гейгера. Відвідувачі Всесвітньої виставки в Брюсселі ціпеніли, коли дивилися на ці рукавички. Ще в 1958 році — через півстоліття! — вони відчували від цих рукавичок не запах тонких парфумів, а «голос» того самого Радію, якого безстрашно торкалися руки відважної жінки.
-
Марія Склодовська-Кюрі (1867—1934)
Польська і французька вчена — фізик і хімік, одна з творців учення про радіоактивність. Виявила радіоактивність Торію. Разом із Пером Кюрі відкрила Полоній і Радій. Запропонувала термін «радіоактивність». Добула металічний радій (1910) і дослідила його властивості. Лауреат Нобелівської премії з фізики (1903) разом із П. Кюрі та А. Бек-керелем. Лауреат Нобелівської премії з хімії (1911)
-
Ернест Резерфорд (1871—1937)
Англійський фізик, член Лондонського королівського товариства (з 1903), один із творців учення про радіоактивність і будову атома. Відкрив а- і (5-промені та визначив їхню природу (1899). Вперше експериментально виявив перетворення нераді-оактивних елементів (Нітрогену в Оксиген) внаслідок опромінювання а-частинками. Запропонував ядерну модель будови атома (1911). Здійснив першу штучну ядерну реакцію (1919). Передбачив існування нейтрона. Лауреат Нобелівської премії (1908)
- Творцем ідеї атома прийнято вважати Демокрита. Легенда розповідає, що одного разу Демокрит сидів на камені біля моря, тримав у руці яблуко і розмірковував: «Якщо я зараз це яблуко розріжу навпіл - у мене залишиться половина яблука, якщо я потім знову розріжу цю половину на дві частини – залишиться чверть яблука; але якщо я і далі буду продовжувати таке ділення, чи завжди у мене в руках буде залишатись 1⁄8,1⁄16 і т.д. частина яблука? Чи в якийсь момент котре ділення приведе до того, що частина, яка залишиться, уже не буде мати властивості яблука?» Згодом вчений прийшов до висновку, що межа такого ділення існує, і назвав цю останню, уже неподільну частинку атом. Замислитесь, це написано більше 2 тисяч років тому: «Початок Всесвіту - атоми й порожнина, все інше існує лише у думці. Світів численна кількість, і вони мають початок і кінець у часі. І ніщо не виникає з небуття. І атоми численні за величиною носяться у Всесвіті, і таким чином народжується все складне: вогонь, вода, повітря, земля. Останні є сполученням деяких атомів. Атоми ж не піддаються ніякому впливу і незмінні».


про публікацію авторської розробки
Додати розробку
