Конспект уроку з хімії для 8 класу "Ізотопи"
[Введите текст]
8клас Урок №8 .Тема. Ізотопи
Мета:
навчальна: поглибити знання учнів про склад атомних ядер; формувати вміння визначати число протонів і нейтронів у ядрі конкретного нукліда, дати поняття про ізотопи і на його основі поглибити знання про хімічний елемент як вид атомів з однаковим протонним числом (зарядом ядра).
виховна: сприяти розширенню політехнічного світогляду учнів, практичній спрямованості вивченого матеріалу, розвивати мислення, увагу, вміння використовувати вивчений матеріал для пізнання нового.
розвиваюча: розвивати в учнів самостійність у навчанні, уважність, математичну культуру, здатність до взаємовиручки, колективізму.
Тип уроку: засвоєння нових знань.
Форми роботи: евристична бесіда , фронтальна робота з класом, робота з текстом підручника. практичне використання знань, умінь та навичок.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, кубик, файли з фломастерами, мультимедійна презентація.
Хід уроку
І. Актуалізація опорних знань.
1. Перевірка домашньої вправи
|
елемент |
Кількість в атомі |
|||||
|
Назва |
сим- вол |
поряд-ковий номер (протон-не число) |
Нуклон-не число |
протонів |
електронів |
нейтронів |
|
Цезій |
Cs |
55 |
133 |
55 |
55 |
133-55= 78 |
|
Алюміній |
Al |
13 |
27 |
13 |
13 |
27-13= 14 |
|
Кобальт |
Со |
27 |
59 |
27 |
27 |
59-27= 32 |
2. Перевірка знань у вигляді гри з кубиком.
1). Яку будову має атом?
2). Як визначити заряд ядра? (по порядковому номеру)
3). Як визначити кількість електронів, що рухаються навколо ядра?
(по порядковому номеру)
4). Із яких частинок складається ядро? (протонів і нейтронів)
5). Як визначити кількість протонів? (по порядковому номеру)
6). Як визначити кількість нейтронів? (різниця між нуклонним часлом, або масовим числом і порядковим номером)
3. Заповніть схему:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
4. Робота на файлах:
1) Як позначається протон? ( Р+, ![]() ,
, ![]() )
)
2) Як позначається нейтрон? (n0, ![]() )
)
3) Як позначається електрон? (е-)
4) Яку масу має протон? (1)
5) Яку масу має нейтрон? (1)
6) Який заряд має протон? (+1)
7) Який заряд має нейтрон? (0)
8)Який заряд має електрон? (-1)
ІІ. Мотивація навчальної діяльності.
Нуклід – будь-який вид атома.
 Нуклід - різновид атому, що характеризується певним числом протонів та нейтронів.
Нуклід - різновид атому, що характеризується певним числом протонів та нейтронів.
![]() Нуклонне число, маса
Нуклонне число, маса
![]()
Протонне число, порядковий номер
Вам відомо, що атом складається з протонів, нейтронів, електронів. Маса протона =1, маса нейтрона = 1, маса електрона дорівнює майже 0. Кількість протонів і нейтронів не може бути дробовим (не буває пів протона, чверть нейтрона) .
Тому, якою має бути маса атома, цілим числом чи дробовим? (цілим).
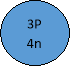
 3+4= 7, але Аr(Li)= 6,941.
3+4= 7, але Аr(Li)= 6,941.
3Li
- Чому в ПС відносна атомна маса виражена дробовими числами?
- Причина в тому, що більшість елементів існує у вигляді кількох нуклідів. Називають ці нукліди ізотопами.
- Мета уроку: познайомитися з поняттям «ізотопи», навчитися записувати ізотопи, знаходити їх серед даних формул.
ІІІ. Вивчення нового матеріалу
- Визначення поняття «ізотопи»
Ізотопи – це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра), але різне нуклонне число (маса)
Ізотопи – це різновиди атомів одного і того ж елемента
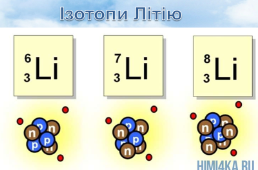
- 20 елементів існують у вигляді 1 нукліда (Be,F,Na,P,Al…), інші утворюють кілька ізотопів.
2.Назви і символи ізотопів збігаються із назвами і символами хімічних елементів.
Наприклад, ![]() ,
, ![]() ,
, ![]() - ізотопи Оксигену (Оксиген-16, Оксиген-17, Оксиген-18)
- ізотопи Оксигену (Оксиген-16, Оксиген-17, Оксиген-18)
![]()
![]() – ізотопи Карбону
– ізотопи Карбону
![]() - ізотопи Купруму
- ізотопи Купруму
Виняток становлять ізотопи Гідрогену
|
|
1Р+ |
0 n0 |
1 е- |
|
|
1Р+ |
1 n0 |
1е- |
|
|
1Р+ |
2 n0 |
1е- |
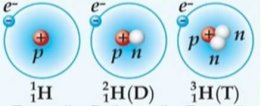
На Землі існує тільки 2 нукліди Гідрогену: Протій та Дейтерій. Тритію всього 0,07% від усіх атомів Гідрогену.
При перегонці великої кількості води на дні перегонного куба збирається небагато важкої води, утвореної важким нуклідом Гідрогену ― Дейтерієм.
Така вода D2O зовні схожа на звичайну воду, але відрізняється від неї рядом властивостей.
Вона замерзає не при 0, а при 3,80 С, перетворюючись у лід, що, на відміну від звичайного льоду, не плаває по поверхні води, а тоне.


3. Відкриття ізотопів дало змогу поглибити поняття «хімічний елемент».
Хімічний елемент – це вид атомів, що характеризуються однаковим протонним числом (зарядом ядра).
Сучасне формулювання періодичного закону
Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів
4.Визначення відносної атомної маси хімічного елемента
Відносна атомна маса елемента, подана в періодичній таблиці, є середньою атомною масою всіх його природних ізотопів із врахуванням їх поширеності.
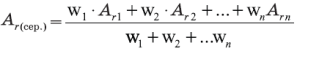 Знаючи масові частки ізотопів у природному елементі та середнє значення їх атомних мас, можна визначити відносну атомну масу елемента у періодичній системі.
Знаючи масові частки ізотопів у природному елементі та середнє значення їх атомних мас, можна визначити відносну атомну масу елемента у періодичній системі.
Загальна формула для розрахунку:
Приклад 1.
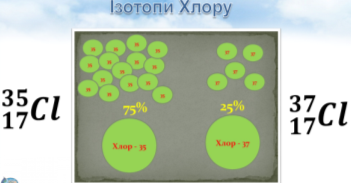
У природному Хлорі частка нукліда 35Cl становить ≈ 75,53 %, а нукліда 37Cl ≈ 24,47 % . Визначити відносну атомну масу елемента Хлору.
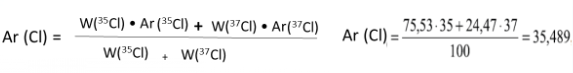
Приклад 2.
Елемент Оксиген являє собою суміш ізотопів — нуклідів
16О - 99,757 %, 17О - 0,039 % і 18О - 0,204 %.
Знайдемо відносну атомну масу Оксигену.
ІV. Закріплення набутих знань
Вправа 1.
Скільки різних елементів зображено такими формулами:
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]()
![]()
![]()
![]() - Флуор
- Флуор
Вправа 2.
Серед поданих нуклідів знайдіть ізотопи:
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]()
Відповідь: оскільки ізотопи – це нукліди одного хімічного елемента, то вони всі мають однаковий порядковий номер, однаковий заряд ядра.
![]() - ізотопи Гелію
- ізотопи Гелію
![]() ,
, ![]() ізотопи Купруму
ізотопи Купруму
Вправа 3. Визначте склад атомів таких нуклідів:
|
|
12C |
13C |
16O |
18O |
1H |
|
Нуклонне (масове) число |
|
|
|
|
|
|
Протонне число
|
|
|
|
|
|
|
Число нейтронів у ядрі |
|
|
|
|
|
|
Загальне число електронів |
|
|
|
|
|
Відповідь:
|
|
12C |
13C |
16O |
18O |
1H |
|
Нуклонне (масове) число |
12 |
13 |
16 |
18 |
1 |
|
Протонне число
|
6 |
6 |
8 |
8 |
1 |
|
Число нейтронів у ядрі |
6 |
7 |
8 |
10 |
0 |
|
Загальне число електронів |
6 |
6 |
8 |
8 |
1 |
Вправа 4. Заповніть порожні клітинки в таблиці
|
Назва елемента |
Сим вол |
Порядковий номер |
Нуклонне число |
Протонне число р+ |
Кількість нейтронів n0 |
Кількість електронів е - |
|
Оксиген |
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
|
|
23 |
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
15 |
Відповідь:
|
Назва елемента |
Сим вол |
Порядковий номер |
Нуклонне число |
Протонне число р+ |
Кількість нейтронів n0 |
Кількість електронів е - |
|
Оксиген |
о |
8 |
16 |
8 |
8 |
8 |
|
Гідроген |
Н |
1 |
1 |
1 |
0 |
1 |
|
Сульфур |
S |
16 |
32 |
16 |
16 |
16 |
|
Натрій |
Na |
11 |
23 |
11 |
12 |
11 |
|
Флуор |
F |
9 |
19 |
9 |
10 |
9 |
|
Фосфор |
Р |
15 |
31 |
15 |
16 |
15 |
ІV. Підведення підсумків уроку.
V. Домашнє завдання: вивчити § 5, виконати вправу 30 ст.31.
Для бажаючих – вправа 35 ст. 31


про публікацію авторської розробки
Додати розробку