Конспект уроку з хімії для 8 класу "Стан електронів в атомі. Електронні орбіталі"
[Введите текст]
8клас Урок №9 Тема. Стан електронів у атомі. Електронні орбіталі.
Мета
навчальна: ознайомити учнів з особливостями електрона як мікрочастинки, розглянути хвильовий характер руху електрона; ввести поняття «орбіталь», «спін»,
сформувати уявлення про види орбіталей та структуру їх розміщення в атомі; поглибити уявлення про складну будову атома;
розвиваюча: розвивати творчі здібності учнів, уважність,
виховна: сприяти розширенню політехнічного світогляду учнів, виховувати любов до предмету.
Тип уроку: засвоєння нових знань.
Форми роботи: евристична бесіда , фронтальна робота з класом, самостійна робота. практичне використання знань, умінь та навичок.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, кубик, повітряні кульки, картки із завданнями, мультимедійна презентація.
Хід уроку
І. Актуалізація опорних знань.
1. Перевірка домашньої вправи
№30 ст 31(П.П. Попель, Л.С.Крикля
![]() 10 p+, 10 n0, 10 е-
10 p+, 10 n0, 10 е-
![]() 10 p+, 11 n0, 10 е-
10 p+, 11 n0, 10 е-
![]() 19 p+, 21 n0, 19 е-
19 p+, 21 n0, 19 е-
![]() 20 p+, 20 n0, 20 е-
20 p+, 20 n0, 20 е-
![]() 78 p+, 114 n0, 78 е-
78 p+, 114 n0, 78 е-
№35ст 31![]()
|
W(
W(
Ar(Mg)-?
|
|
2. Фронтальна робота з класом – повторення основних понять про будову атома ( у формі гри з кубиком)
1) Що ви знаєте про будову атома?
2)Як можна визначити заряд ядра? (по порядковому номеру)
3) Як можна визначити кількість протонів? (по порядковому номеру)
4) Як можна визначити кількість електронів? (по порядковому номеру)
5) Як можна визначити кількість нейтронів? (різниця між відносною атомною і порядковим номером)
5) Що таке нукліди?
(Нуклід - різновид атому, що характеризується певним числом протонів та нейтронів)
6) Що таке ізотопи?
(Ізотопи – це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра), але різне нуклонне число (маса)
3. Виконання самостійної роботи ( 2 варіанта, зміст завдань не картках)
Самостійна робота «Будова атома. Ізотопи»
Варіант 1
- Порядковий номер хімічного елемента дорівнює:
А. заряду ядра атома; Б. кількості електронів;
В. відносній атомній масі ; Г. протонному числу.
2. Вкажіть розташування в періодичній системі елемента № 6 :
А .2 період; Б.4 період; В. 2 група; Г. 4 група;
Д. Головна підгрупа; Е. Побічна підгрупа.
3. Елемент з порядковим номером 20 має :
А. Ядро із зарядом + 20 і 20 електронів;
Б. .Ядро із зарядом + 10 і 10 електронів;
В. Ядро із зарядом + 40 і 40 електронів.
4. Елемент з порядковим номером 12 утворює вищій оксид типу :
А. R2O ; Б. RO ; В. R2O 3.
5.Скільки протонів , нейтронів і електронів має нуклід ![]()
![]() .
.
6.Нукліди яких елементів позначено формулами :![]()
![]() ,
, ![]()
7. Атомне ядро якого елемента містить 19 протонів і 20 нейтронів ?
Варіант 2
- Порядковий номер хімічного елемента дорівнює:
А. заряду ядра атома; Б. кількості електронів;
В. відносній атомній масі ; Г. протонному числу.
2. Вкажіть розташування в періодичній системі елемента № 16 :
А .6 період; Б.3 період; В. 6 група; Г. 3 група;
Д. Головна підгрупа; Е. Побічна підгрупа.
3. Елемент з порядковим номером 3 має :
А. Ядро із зарядом + 3 і 3 електрона;
Б. .Ядро із зарядом + 7 і 7 електронів;
В. Ядро із зарядом + 10 і 10 електронів.
4. Елемент з порядковим номером 11 утворює вищій оксид
типу : А. R2O ; Б. RO ; В. R2O 3.
5.Скільки протонів , нейтронів і електронів має нуклід ![]()
6.Нукліди яких елементів позначено формулами : ![]() ,
, ![]()
7. Атомне ядро якого елемента містить 12 протонів і 12 нейтронів ?![]()
Відповіді:
|
І вар.
5. 6. В, Mg – 2 бал.
7.
|
І вар. 1. А, Б, Г – 1,5 бал. 2. Б, В, Д - 1,5 бал. 3. А (Li) – 2 бал 4. А (Na2O) – 1 бал.
5. 6. Cu, O – 2 бал.
7.
|
ІІ. Мотивація навчальної діяльності
На попередніх уроках ми познайомилися з будовою ядра. Що ще входить до складу атома? Електрони. У якому стані перебувають електрони в атомі? Як вони рухаються навколо ядра? Скільки, де і які електрони оточують ядро? Це ми маємо з’ясувати протягом кількох уроків.
Сьогодні ми визначимо, що являє собою електрон, познайомимося з новими для вас поняттями «орбіталь», «спін електрона», з’ясуємо форми і розміщення орбіталей у просторі.
ІІІ. Вивчення нової теми
- Що являє собою електрон.
Що ви знаєте про електрон?
- Це частинка, що має масу близько до 0 (1/1837).
- Це частинка, що має заряд -1.
- Кількість електронів в атомі дорівнює порядковому номеру елемента в ПС.
- Позначається електрон літерою е-
Електро́н — стабільна, негативно заряджена елементарна частинка, що входить до складу всіх атомів.
- Подвійна природа електрона
- Частинки з такими малими розмірами, як електрон, мають унікальні властивості, що відрізняють їх від звичайних тіл, з якими ми маємо справу у звичайному житті.
- Електрон одночасно проявляє властивості і частинки, і хвилі – говорячи науковою мовою, має двоїсту природу:
Подібно іншим частинкам, електрон має певну масу і заряд.
У той же час електрон при русі проявляє хвильові властивості. Хвиля відрізняється від частинки тим, що її положення в просторі в даний момент часу не можна точно визначити.
- Особливості руху електрона
а) Отже, електрони рухаються . Але як?
По – перше, дуже швидко. Чому електрон, що має негативний заряд, не падає на ядро, що має позитивний заряд? Може ви бачили, як рухається мотоцикліст на циркових атракціонах по стіні? Чому він не падає? Бо рухається з дуже великою швидкістю.
б) Раніше вважали, що електрони рухаються за певною траєкторією (пригадайте планетарну модель атома Резерфорда), але потім було встановлено, що електрон рухається не утворюючи траєкторію.
Для електрона поняття «траєкторія» застосовувати не можна. Про електрон можна говорити, що в даній точці простору є певна імовірність його існування.
в) Швидкість обертання електрона навколо ядра настільки велика, що він одночасно може перебувати в різних точках навколо ядра.
Чи однаково часто перебуває електрон в різних точках простору навколо ядра? Ні.
Уявіть собі футбольний матч. Де розміщується воротар?
- У воротах. Найвірогідніше його розташування у безпосередній близькості біля воріт.
- Менша ймовірність знайти його в середині футбольного поля.
- Ще менше – у воротах супротивника.
- Практично неможливо знайти воротаря під час матчу на трибунах уболівальників.
Так і електрон, перебуває в атомі не в одній конкретній точці, а утворює електронну хмару, густина якої показує, в яких місцях електрон буває частіше, а в яких рідше.
Електро́нна хма́рка — графічне зображення області, де можливе перебування електрона . Термін використовується для унаочнення розташування електронів (розподілу електронної густини в просторі) на атомних орбiталях.
- Атомна орбіталь
Розглянемо атом Гідрогену, ядро якого складається з одного протона навколо якого рухається один електрон.
 Як бачимо, ймовірність перебування електрона в ядрі дорівнює нулю.
Як бачимо, ймовірність перебування електрона в ядрі дорівнює нулю.
В міру віддалення від ядра вона швидко зростає й на деякій відстані від ядра досягає максимуму, після чого поступово зменшується.
![]() Точно обмежити ділянку простору і зазначити перебування електрона в ньому неможливо. Електрон може бути в будь-якій точці атомного простору, однак ймовірність знаходження в ньому буде не однаковою. Тому було введено поняття атомна орбіталь. (Ст. 32 Хімія8 кл. П.П.Попель)
Точно обмежити ділянку простору і зазначити перебування електрона в ньому неможливо. Електрон може бути в будь-якій точці атомного простору, однак ймовірність знаходження в ньому буде не однаковою. Тому було введено поняття атомна орбіталь. (Ст. 32 Хімія8 кл. П.П.Попель)
Атомна орбіталь – це частина простору навколо ядра, ймовірність перебування електрона в якому дорівнює до 95%, тобто найімовірніше.
- Поняття про спін електрона
1)Рухаючись навколо ядра, електрон ще й обертається навколо своєї осі. Цей рух називається «спін».(Демонстрація на повітряній кульці)
Спін – це рух електрона навколо власної осі. (ст. 33, мал. 17 ст 34)
2) Якщо 2 електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні, тобто, один обертається за годинниковою стрілкою, а інший – проти, то це електрони з антипаралельними спіними. Такі електрони створюють навколо себе магнітне поле, що забезпечує взаємне притягання електронів.
3) Орбіталі зображують квадратиком, а електрон у ній – стрілкою.
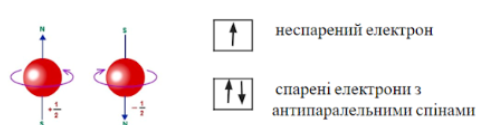
На одній орбіталі може перебувати лише 2 електрона, які мають протилежні спіни.
- Характеристика орбіталей
1) Орбіталі, які утворюють електрони, відрізняються одна від одної
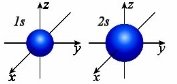 а) Орбіталі мають різні розміри.
а) Орбіталі мають різні розміри.
Чим ближче орбіталь до ядра, тим менше її розмір.
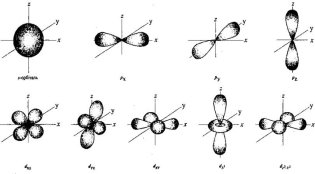
б) Орбіталі мають різні форми.
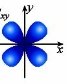
Вони можуть бути кулястими, гантелоподібними, у формі чотирьох або шестипелюсткової квітки.
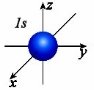

Орбіталі різної форми позначають різними буквами: s, p, d i f.
s-орбіталі мають форму сфери, а електрони з такою формою електронної хмари називаються s-електронами;
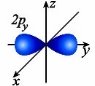
p-орбіталі мають форму об’ємної вісімки (гантелі), а електрони з такою формою електронної хмари називаються р-електронами.
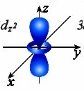
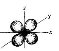
d – орбіталі. Електрони набувають ще більшого запасу енергії, складніших рухів, у результаті утворюються складні і красиві об’ємні геометричні фігури у формі чотирьохпелюсткових квіток
Електрони з такою формою електронної хмари називаються d-електронами.
в) Орбіталі мають різні положення у просторі.
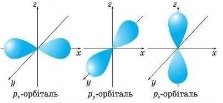
s-орбіталь має одне положення в просторі;
p-орбіталь – 3 положення в просторі.
d-орбіталь – 5 положень в просторі
f-орбіталь – 7 положень в просторі
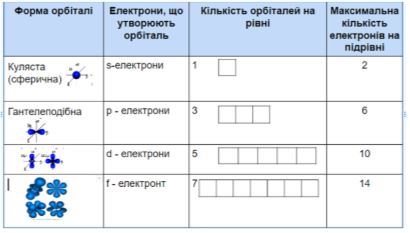
2) Найважливіша характеристика електрона – його енергія. Чим компактніше орбіталь і чим ближче до ядра перебуває електрон, тим його енергія менша
(ст. 34)
Електрони мають різний запас енергії, тому розміщуються на різній відстані від ядра, утворюючи електронні шари (енергетичні рівні). Про це ми поговоримо на наступному уроці.
ІV. Закріплення набутих знань (виконання тестів, зміст на екрані, відповіді картками з буквами «А», «Б», «В», «Г».) Відповідей може бути одна, або декілька.
- Електрон – це
А. Позитивно заряджена частинка, що входить до складу ядра.
Б. Негативно заряджена частинка, що входить до складу ядра.
В. Стабільна, негативно заряджена елементарна частинка, що входить до складу всіх атомів.
Г. Частинка, що має значну масу.
2. Як можна визначити кількість електронів у атомі:
А. По номеру періоду, де розташований хімічний елемент.
Б. По номеру групи, де розташований хімічний елемент.
В. По підгрупі, в якій розташований хімічний елемент.
Г. По порядковому номеру елемента.
3. Виберіть правильне твердження:
А Електрон – це частинка, що одночасно проявляє властивості і частинки, і хвилі – говорячи науковою мовою, має двоїсту природу.
Б. Електрон рухається в атомі за певною траєкторією.
В. Рухаючись навколо ядра, електрон утворює орбіталь.
Г. Спін, це рух електрона біля ядра.
4. Орбіталь –це
А. Траєкторія руху електрона навколо ядра.
Б. Частина простору навколо ядра, ймовірність перебування електрона в якому дорівнює до 95%, тобто найімовірніше.
![]() В. Будь яку орбіталь спрощено зображують квадратом
В. Будь яку орбіталь спрощено зображують квадратом
![]() Г. Будь яку орбіталь спрощено зображують колом
Г. Будь яку орбіталь спрощено зображують колом
5. S – орбіталі мають форму
![]() А. кулясту
А. кулясту
![]()
Б. гантелопдібну
![]()
 В. еліпсоподібну
В. еліпсоподібну
Г. чотирьохпелюсткової квітки.
6. Р – орбіталі мають форму
![]() А. кулясту
А. кулясту
![]()
Б. гантелопдібну
![]()
 В. еліпсоподібну
В. еліпсоподібну
Г. чотирьохпелюсткової квітки.
- Кількість S – орбіталей на одному енергетичному рівні:
А. 1
Б. 2
В. 3
Г. будь - яка
- Кількість Р – орбіталей на одному енергетичному рівні:
А. 1
Б. 2
В. 3
Г. будь - яка
9. Знайдіть відповідність:
|
|
А) неспарений електрон;
Б) спарені електрони с протилежними спінами;
В) порожня (вакантна орбіталь);
Г) неможливий варіант розташування електронів на орбіталі |
Відповіді: 1В, 2Г , 3 А,В, 4 Б,В, 5 А, 6 Б, 7 А, 8 В, 9 1-В, 2-А, 3- Б, 4 - Г
V. Підведення підсумків уроку.
VІ. Домашнє завдання: вивчити § 6 ст. 32-34, виконати вправу №40 ст.37.
Виліпити з пластиліну або іншого зручного матеріалу моделі S і Р орбіталей.
-
-
-
Цікава розробка, відповідає програмі, корисна для вчителів. Дякую що поділилися своїм досвідом.


про публікацію авторської розробки
Додати розробку
